宰后冷却时间对鹅肌肉僵直过程中理化特性的影响
2012-10-16张宇宁何淑清孟质文张瑞红安玥俞龙浩
张宇宁,何淑清,孟质文,张瑞红,安玥,俞龙浩
(黑龙江八一农垦大学食品学院,大庆163319)
动物宰后处理方法对动物宰后的肌肉理化特性影响巨大[1-4],尤其是温度对宰后肌肉僵直过程中理化特性指标变化的影响极为显著[3-4]。Geesink等(2000)报告,宰后热剔骨羔羊的背最长肌在不同温度下储藏,其肌节长度有显著差异[5]。不同温度对僵直期间火鸡胸脯肌肉的僵直值、肌糖原含量及pH值变化都有显著影响;温度越高,肌肉进入僵直速度越快,肌糖原的消耗也越快[3]。Jeremiah等(1992)研究了鼓风冷却的时间对猪肉品质的影响,发现鼓风冷却1 h的猪肉嫩度优于冷却2 h及3 h的猪肉嫩度[6]。Kondjoyan等(1997)研究结果,在商业屠宰过程中冷却时间的长短对宰后动物肌肉的重量损失有显著影响[7]。但是Ali等(2008)报告,不同冷却温度对宰后未剔骨鸭胸肉的肌节长度影响没有差异[4]。Yu等(2009)报告,宰后储藏温度不同对鸡胸脯肌肉的MFI影响不显著[8]。这可能是由于实验材料及处理方式不同所致,说明动物种类及宰后处理不同,导致宰后僵直过程中理化特性差异。
目前,鹅屠宰是参照鸡的商业屠宰工艺进行,并没有独立的鹅屠宰工艺规范[9]。由于鹅和鸡品种不同,鸡的屠宰工艺未必适用于鹅。虽然有许多学者就不同宰后处理方式对鸡肉、火鸡肉、鸭肉及牛、羊、猪肉的宰后理化指标的影响做了大量研究[1,4,5,8],但是对鹅肉的研究很少。因此,本研究测定鹅宰后分别冷水冷却0.5 h和1.5 h,测定冷却时间对鹅肉僵直过程中理化特性变化的影响,为确定鹅屠宰工艺提供基础依据。
1 材料与方法
1.1 肌肉的样品准备
从当地鹅饲养户购买草原放牧方式饲养的同一批东北大白鹅80只(100日龄,体重3~3.5 kg,公母各半),傍晚时(下午5~6点,距离35 km)运到黑龙江八一农垦大学动物实验室。为了使鹅恢复体力,减少捕捉和运输过程对鹅造成的应激反应,在实验室滞留一夜(断食不断水),第二天早晨7点开始屠宰。用100 V的电压致昏6~8 s,采用三管切断法割断食管、动脉和静脉,放血3 min。在62℃的热水中浸烫3 min,利用脱毛机(56型,德龙贸易有限公司,中国)煺毛,去内脏(此时为宰后0 h)。然后随机分为两组(每组40只鹅,公母各半),在0℃冰水中分别冷却0.5 h和1.5 h。随后在4℃的冷库中继续冷却至宰后24 h。宰后0、3、6、9及24 h,分别从胸脯肌肉和腿肌肉中取样约50 g,利用液氮冷冻后在-80℃超低温冰箱中保存备用。
1.2 测定方法
1.2.1 冷却后温度
在鹅屠宰并经过冰水冷却后,利用自动温度记录仪(Thermo Recorder TR-52,T&D Co.,Japan)的探头直接插入到鹅的胸脯肌和腿肌中,显示数据稳定时读取肉的温度。每只鹅胸脯肌和腿肌分别测定三次后,取平均值。
1.2.2 pH值
利用肌肉pH计(HI99163,HANNA,Italy)在宰后0、3、6、9、24 h,把测定探头直接插入到鹅胸脯肌肉和腿肌肉中,显示数据稳定时读取肉的pH值。每只鹅胸脯肌肉和腿肌分别测定三次后,取平均值。测定前用pH=4.01和pH=7.00的标准溶液对pH计进行校准。
1.2.3 肌节长度
鹅宰后0、3、6、9、24 h,用手术刀顺着肌纤维方向取样(肌纤维长度约3 cm,1~2 g),浸在缓冲液(2%戊二醇,2%葡萄糖和0.1 mol·L-1磷酸盐,pH=7)中,在4℃存放30 min后,利用激光仪(№.212-2,Research electro-optics,USA)依照Voyle(1971)方法测定肌节长度[10]。
1.2.4 肌糖原含量
鹅宰后0、3、6、9和24 h的肌糖原含量是按照Dreiling(1987)的方法进行测定[11]。准确称取2 g肌肉样品添加9%的高氯酸20 mL,低温条件下(0~4℃) 用均质机 (FA25,FLUKO,Germany)以10 000 r·min-1转速均质1 min后转至低温离心机(5 417 R,Eppendorf,Germany)离心20 min(0~4℃,12 000 r·min-1),取上清液用Whatman№.1滤纸过滤,用移液枪吸取0.4mL上清液到试管中,添加2.6mL碘显色剂(0.26 g碘化钾,10 mL蒸馏水,100 mL饱和氯化钙溶液)混合发色20min后,利用紫外分光光度计(T-6,北京普析通用仪器设备有限公司,中国)测定吸光值(450 nm)。
1.2.5 肌原纤维小片化指数(MFI)
肌原纤维小片化指数的测定是采用Olson等人的(1976)方法,分别在鹅宰后0、3、6、9和24 h进行测定[12]。称取4 g样品加入20 mL的MFI缓冲液(0.02mol·L-1,K2HPO4/KH2PO4,pH=7;0.01mol·L-1,KCL溶液,1mol·L-1的EDTA溶液,1mol·L-1的NaN3)。用均质机在(FA 25,FLUKO,Germany)10 000 rpm·min-1转速均质3 min后,用低温离心机(5 417 R,Eppendorf,Germany)在4℃,3 500 rpm·min-1,离心15 min,用MFI缓冲液洗涤三次,沉淀物中添加MFI缓冲液混合均匀,用纱布过滤。用MFI缓冲液稀释至滤液的蛋白质浓度为0.5±0.05mg·mL-1,用紫外分光光计(T-6,北京普析通用仪器设备有限公司,中国)在波长540 nm下测定其吸光值。MFI=OD540×200。
1.2.6 僵直值(R-value)
Koh等人(1993)的方法稍作改进[13]测定僵直值。分别在0、3、6、9和24 h进行测定。称取4 g肌肉样品加入20 mL 6%的高氯酸溶液,用均质机(FA 25,FLUKO,Germany)均质1分钟(10 000 rpm·min-1)。用Whatman№.1滤纸过滤,并KOH溶液(2 mol·L-1)调节滤液pH值为6.0~6.5,4℃静止60分钟。取上清液0.1mL添加2.9mL磷酸盐缓冲液(0.1mol·L-1,pH=6.5),然后利用紫外分光光度计(T-6,北京普析通用仪器设备有限公司,中国)测定溶液在250 nm和260 nm处的吸光值,依照Calkins(1982)的方法计算[14]。
1.3 统计分析
数据统计分析是利用SAS软件包(SAS Institute,2000)中的普通线性模型(GLM),对所测定的变量通过邓肯氏复极差测验确定不同处理组间的差异性。并在95%水平上表示差异显著性(P<0.05)。每个样品均平行测定三次。
2 结果与分析
2.1 冷却后肌肉的中心温度
冰水冷却结束时肌肉中心温度测定结果如表1。冰水冷却0.5 h处理组鹅胸脯肌肉和腿肌肉中心温度,分别显著高于冰水冷却1.5 h处理组的鹅胸脯肌肉和腿肌肉中心温度。
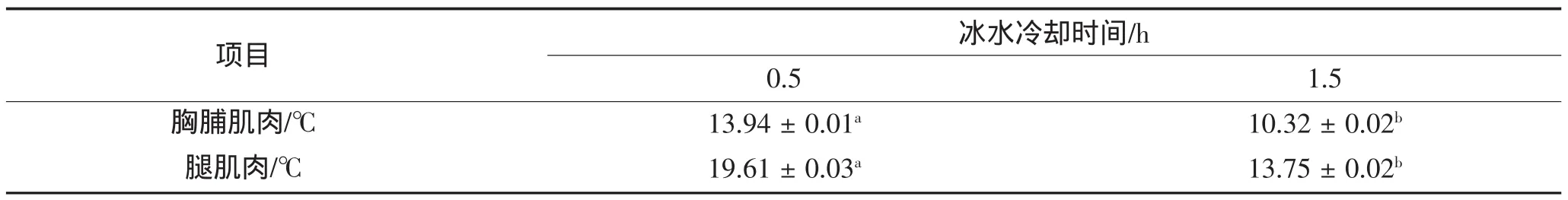
表1 冰水冷却后鹅胸脯肌肉和腿肌肉中心温度/℃Table1 Effects of Postmortem Chilling-time on the Core Temperature in breast and leg muscle of Geese
2.2 pH值、肌糖原含量及僵直值
鹅宰后僵直过程中肌肉的pH值,肌糖原含量和僵直值变化如表2。在宰后僵直过程中,鹅胸脯肌肉和腿肌肉的pH随宰后时间的增加而降低。两处理组的鹅胸脯肌肉在宰后0 h和24 h时其pH值差异不显著,但在宰后的僵直过程中(3~9 h)1.5 h处理组显著高于0.5 h处理组(P<0.05)。鹅腿肌肉在0、9、24 h时两者的pH值差异不显著,而在宰后3 h和6 h时,冷却0.5 h处理组显著低于1.5 h处理组。
糖原含量测定结果显示,在宰后僵直过程中,鹅胸脯肌肉和腿肌肉中的肌糖原含量随宰后时间的增加而降低。在宰后3 h、6 h,冷却0.5 h处理组鹅胸脯肌肉和腿肌肉的肌糖原含量显著低于1.5 h处理组(P<0.05)。0.5 h处理组和1.5 h处理组在宰后0~6 h期间,鹅胸脯肌肉糖原含量分别下降54%和42%,鹅腿肌肉的肌糖原含量分别下降了62%和55%。即0.5 h处理组的糖原消耗速度1.5 h处理组快。这一结果与胸脯肌肉和腿肌肉的同期pH值变化相吻合。
僵直值是用来衡量腺苷核苷酸转化为肌苷核苷酸程度的指标,能间接测定宰后肌肉的僵直程度[17-18]。0.5 h处理组的鹅胸脯肌肉在宰后0、3、6、9、24 h均显著大于冰水冷却1.5 h处理组宰后相应时间的鹅胸脯肌肉僵直值(P<0.05)。说明鹅胸脯肌肉0.5 h处理组的僵直进程比1.5 h处理组快。然而,0.5 h处理组的鹅腿肌肉在宰后0、3、6、9、24 h的僵直值与1.5 h处理组宰后相应时间的僵直值基本相同。本实验中导致宰后6 h,胸脯肌肉和腿肌肉0.5 h处理组的糖原含量和pH降低速度比1.5 h处理组快,0.5 h处理组的胸脯肌肉僵直值升高速度比1.5 h处理组快,可能是由于经冰水冷却0.5 h处理的鹅胸脯肌肉和冰水冷却1.5 h处理的腿肌肉的中心温度分别13.94和13.75℃,比冰水冷却1.5 h处理的鹅胸脯肌肉和0.5 h处理的腿肌肉的中心温度(分别为10.32和19.61℃)更接近于15℃的缘故。通常肌肉pH值与糖原分解速度和温度有关,宰后处理温度越高,肌肉中生化代谢过程越快[15]。同时,红色肌肉比白色肌肉容易发生冷收缩(Farouk&Lovatt,2000)加快生化代谢速度,Sheridan(1990)主张为了避免羊胴体肌肉发生冷收缩,宰后10 h内不要冷却到10℃以下[16-17]。
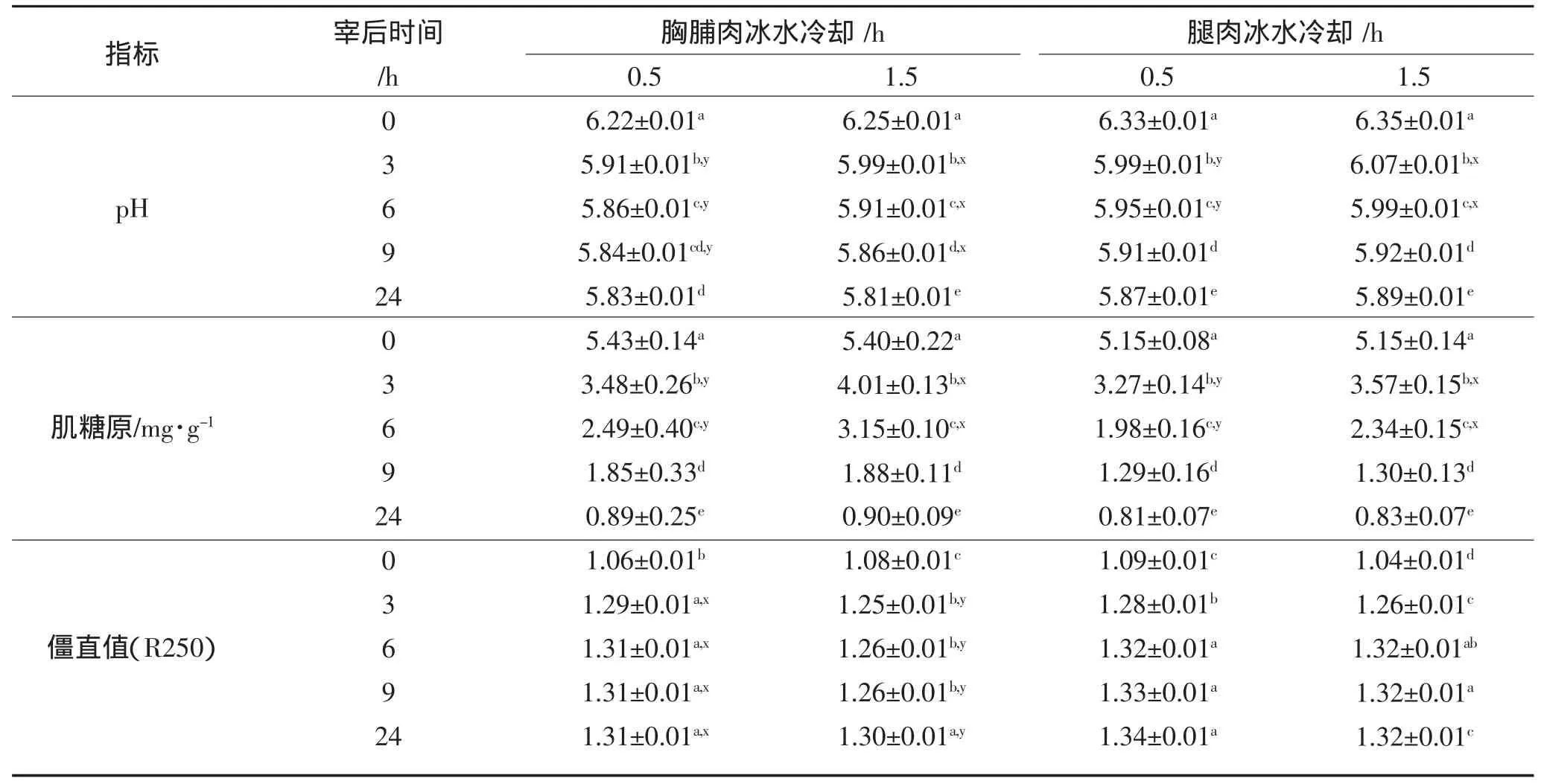
表2 冷却时间对宰后僵直过程中鹅胸脯肌肉和腿肌肉的pH值、肌糖原含量及僵直值的影响Table2 Effects of Postmortem Chilling-time on the pH、Glycogen content and R-value in breast and leg muscle of Geese
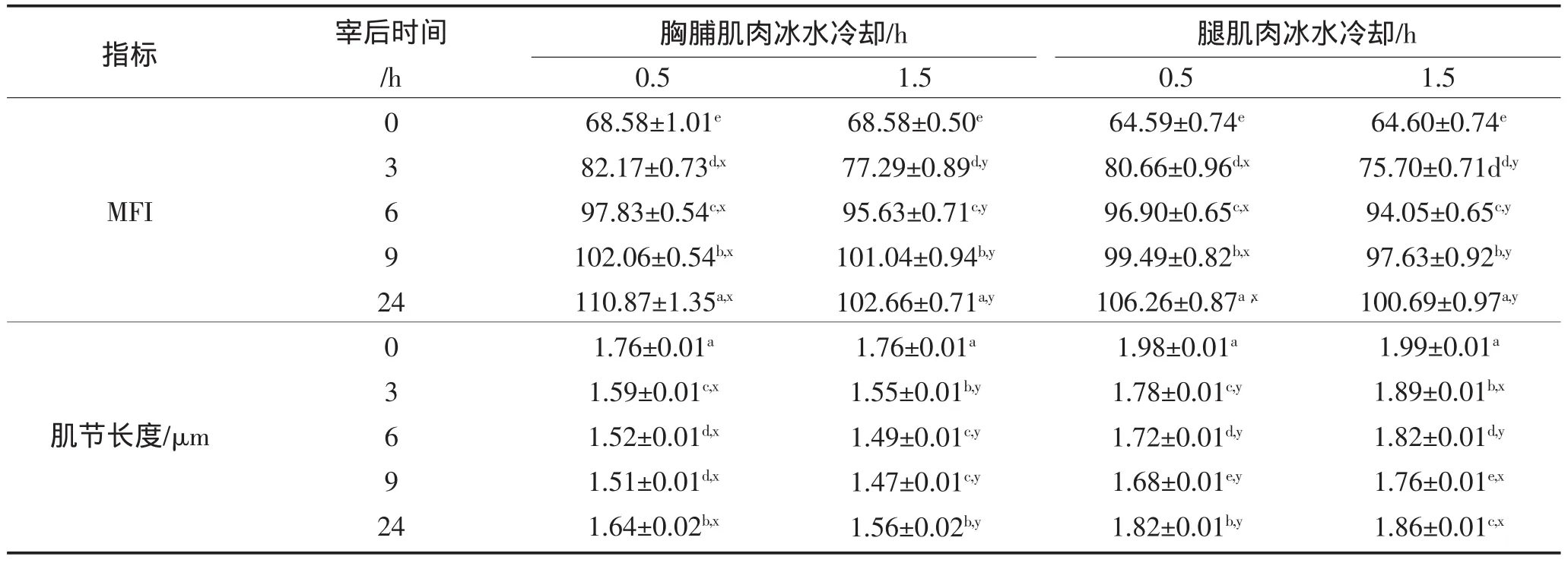
表3 冷却时间对宰后僵直过程中鹅胸脯肌肉和腿肌肉的MFI及肌节长度的影响Table3 Effects of Postmortem Chilling-time on the My ofibrillar fragmentation index(MFI)and Sarco mere length in breast and legmuscle of Geese
2.3 MFI和肌节长度
宰后肌肉在僵直和解僵过程中,肌原纤维断裂成小片,肌原纤维小片化指数(MFI)可用来衡量宰后动物肌肉嫩化成度的指标[18]。本实验结果,鹅胸脯肌肉和腿肌肉的MFI值随着宰后时间的增加而增加(表3)。在宰后同一时间,冰水冷却0.5 h鹅胸脯肌肉和腿肌肉的MFI值显著大于冰水冷却1.5 h鹅胸脯肌肉和腿肌肉的MFI。Yu等(2009)报告,在宰后僵直过程中,不同储藏温度对鸡胸脯肌肉的MFI值影响差异不显著[8],与本实验的研究结果不符。这种差异可能是由于实验材料不同所致。Yu等(2009)所用的实验材料是鸡胸脯肌肉,属于白肉,而本实验所用的材料是鹅胸脯肌肉和腿肌肉,均属于红肉。红肉对温度的敏感程度也比白肉的灵敏。
肌节长度是肌肉嫩度的评定指标之一,通常在僵直过程中肌节长度收缩程度越小,其肉越嫩。肌节长度一般随着僵直逐渐缩短,达到僵直高峰时,肌节长度最短,随着僵直解除,肌节长度略有增加[9]。本实验测定鹅胸脯肌肉和鹅腿肌肉的肌节长度结果如表3。在宰后同一时间,0.5 h处理组胸脯肌肉的肌节长度显著大于1.5 h处理组(P<0.05)。与此相反,1.5 h处理组的鹅腿肌肉肌节长度显著大于0.5 h处理组的肌节长度(P<0.05)。这一结果可能是由于鹅胸脯肌肉的中心温度0.5 h处理组(13.94℃)经冰水冷却后比1.5 h处理组(10.32℃)接近15℃;而1.5 h处理组腿肌肉的中心温度(13.75℃)比0.5 h处理组腿肌肉的中心温度(19.61℃)更接近15℃的缘故。因为,红色肌肉在较低温度下(10℃以下)容易发生冷收缩[16];与此相反,宰后胴体越高,通常20℃以上时,随着温度的提高,肌肉中生化代谢过程越快[15]。因此,可能导致了胸脯肌肉在冰水冷却0.5 h的肌节长度收缩程度比1.5 h处理组长;而腿肌肉在冰水冷却0.5 h的肌节长度收缩程度比1.5 h处理组短。
3 结论
宰后冰水冷却时间对僵直过程中鹅胸脯肌肉和腿肌肉的pH值、肌糖元含量、肌节长度、僵直值及MFI均有显著影响。冰水冷却0.5 h处理组的胸脯肌肉和腿肌肉糖原含量和pH值的降低速度小于1.5 h处理组,0.5 h处理组比1.5 h处理组僵直进程快。胸脯肌肉在僵直过程中冰水冷却0.5 h处理组的肌节长度收缩程度比1.5 h处理组长;与此相反,腿肌肉在僵直过程中冰水冷却0.5 h处理组的肌节长度收缩程度比1.5 h处理组短。这一结果提示,鹅宰后对胸脯肌肉和腿肌肉分别进行冰水冷却处理为宜。即胸脯肌肉冰水冷却0.5 h,腿肌肉冰水冷却1.5h处理,对提高嫩度等肉品质更有利。
[1]Gorsuch V,Alvarado C Z.Postrigo r tumble marination strategies for improving color and water-holding capacity in normal and pale broiler breast fillets[J].Poultry Science,2000(89):1002-1008.
[2]Huezo R,Northcutt JK,Smith D P,et al.Effect of chilling method and deboning time on broiler breast fillet quality[J].Poultry Science,2007(16):537-545.
[3]Mceek SR,Sams A R.Rigor mortis develop mentatelevated temperatures induces pale exudative turkey meat characteristics[J].Poultry Science,1998(77):169-174.
[4]Ali M S,Yang H S,Jeong J Y,et al.Effect of chilling temperature of carcass on breast meat quality of duck[J].Poultry Science,2008(87):1860-1867.
[5]Geesink G H,Bekhit A D,Bickerstaffe R.Rigor temperature and meat quality characteristics of lamb longissimus muscle[J].Journal of Animal Science,2000(78):2842-2848.
[6]Jeremiah L E,Jones SD M,Tong A KW,etal.The effects of gender and blast-chilling time and temperature on cooking properties and palatability of pork longissimus muscle[J].Canadian Journal of Animal Science,1992,72(3):501-506.
[7]Kondjoyan A,Daudin J D.Optimisation of air-flow conditions during the chilling and storage of carcasses and meat products[J].Journal of Food Engineering,1997,34(3):243-258.
[8]Yu L H,Lee E S,Jeong JY,et al.Effects of Post-mortem Temperature on the Physicochemical Properties of Hotboned Chicken Breast Muscles[J].Food Sci,2009(29):55-61.
[9]赵悦,杨焕民,王琳琳,等.东北白鹅抑制素/活化素β_B亚基成熟区cDNA的克隆[J].黑龙江八一农垦大学学报,2007,19(2):59-62.
[10]Voyle C A.Sarcomere length and meat quality.Proceed 17th European Meeting of Meat Research Workers[C].Bristol,England,1971:95-97.
[11]Dreiling C E,Brown D E,Casale L,Kelly L.Muscle glycogen:Comparison of iodine binding and enzyme digestion assays and application tomeat samples[J].Meat Science,1987,20(3):167-177.
[12]Olson D G.,Parrish F C,Stromer M H.Myofibril fragmentation and shear resistance of three bovine muscles during postmortem storage[J].Journal of Food Science,1976(41):1036-1041.
[13]Koh K C,Bidner T D,McMillan K W,et al.The relationship between ATP and R-values in postmortem bovine longissimus dorsi muscle[J].Meat Science,1993,33(2):253-263.
[14]Calkins C R,Dutson TR,Smith G C,et al.Concentration of creatine phosphate,adenine nucleotides and their derivatives in electrically stimulated and nonsti mulated beef muscle[J].Journal of Food Science,1982(47):1350-1353.
[15]Dransfield E.Optimisation of tenderization,ageing and tender-ness[J].Meat Science,1994,36(1):105-121.
[16]Farouk M M,Lovatt S J.Initial chilling rate of pre-rigor beefmuscles as an indicator of colour of thawedmeat[J].Meat Science,2000,56(2):139-144.
[17]Sheridan J.The ultra rapid chilling of lamb carcasses[J].Meat Science,1990,28(1):31-50.
[18]Papa CM,Fletcher D L.Pectoralismuscle shortening and rigor development at different locations within the broiler breast[J].Poult.Sci,1988(67):635-640.
