海洋硫酸多糖几种脱硫方法的比较研究
2012-10-13王玉峰曾洋洋王培培韩章润吴建东于广利
刘 鑫, 王玉峰, 曾洋洋, 王培培, 韩章润, 吴建东, 于广利
(1. 海洋药物教育部重点实验室, 山东 青岛 266003; 2. 山东省糖科学与糖工程重点实验室, 中国海洋大学医药学院, 山东 青岛 266003)
海洋动植物中存在着种类繁多、结构独特的硫酸多糖[1-3], 而各种硫酸多糖具有广泛的生物活性[4-5]。为了确定多糖结构, 探讨多糖活性与其硫酸基含量之间关系, 对其进行脱硫处理变得十分重要。
常用的多糖脱硫方法, 目前主要有二甲基亚砜-甲醇法(下称DMSO法)[6-7]、三甲基氯硅烷法(下称CTMS法)[8]以及苯并四甲酸-Sb2O3法(下称PMA法)[9]。其中DMSO法操作简单, 但脱硫酸基效率不高; CTMS法是一种非选择性的脱硫方法, 由于所用试剂容易爆炸, 实验具有一定危险性; PMA法操作虽较复杂, 但用时短、安全性好。虽然国外学者对上述方法分别进行了脱硫效果研究, 但缺乏对它们在同一样品的得率、脱硫率以及脱硫前后分子质量变化的综合评价。
卡拉胶(carrageenan)是某些红藻中广泛存在的硫酸多糖。根据其单糖种类以及硫酸酯基取代位置的不同, 卡拉胶有十几种(如α、β、κ、ι、λ、ν、π、θ、ω、ζ、γ等), 其中κ-卡拉胶在食品中应用最多, 它是由(1→3)-4-硫酸-β-D-半乳糖和(1→4)-3,6-内醚-α-D-半乳糖交替连接而成, 因其具有显著的免疫调节[10]和抗病毒[11]活性而受到广泛关注。作为硫酸半乳聚糖的κ-卡拉胶, 分子中不仅含有酸不稳定的3,6-内醚半乳糖, 且其硫酸酯基处于难脱除的半乳糖 C4位, 是研究脱硫方法的良好原料。本文以κ-卡拉胶为研究对象, 首次比较了三种脱硫方法的优缺点, 并利用建立的方法评价了其他海洋来源硫酸多糖的脱硫效果, 为各种硫酸多糖的脱硫, 尤其是硫酸多糖的结构分析提供了有用参考。
1 材料和方法
1.1 试剂及仪器
材料:κ-卡拉胶(K. Striatium), 烟台市润隆海洋生物制品有限公司, 精制后使用;λ-卡拉胶、ι-卡拉胶,sigma公司。岩藻聚糖硫酸酯, 实验室自制。
试剂: 苯并四甲酸(pyromellitic acid, PMA),sigma公司; 三甲基氯硅烷(chlorotrimethylsilane,CTMS), Acros organics公司; 其他试剂均为国产分析纯。
仪器: Shodex OHpak SB-806M HQ凝胶色谱柱(8.0 mm ID×300 mm, 13μm), 日本昭和电工; 732#阳离子交换树脂小柱(18mm ID×50mm), 国药集团化学试剂有限公司; 红外光谱仪(Nicolet Nexus 470型),Thermo Electron公司; 高效液相色谱仪(Agilent 1260,配柱温箱, 自动进样器, 示差检测器), 美国安捷伦公司; 紫外可见分光光度计(UV-2102 PCS), 尤尼柯上海公司; 十八角度激光散射仪(DAWN HELEOSTMⅡ Light Scattering Instrument), 美国Wyatt Technology 公司; 透析袋(MWCO 3.5kD),Spectrum Laboratories公司。
1.2 方法
1.2.1κ-卡拉胶吡啶盐制备[8]
将精制后的50 mgκ-卡拉胶样品溶于5 mL去离子水中, 过732#阳离子交换树脂小柱, 用10 mL去离子水洗脱, 收集水洗组分。用吡啶调节 pH至 9, 旋转蒸发浓缩至1 ~ 2 mL, 冷冻干燥, 得到κ-卡拉胶吡啶盐(κPy)。
1.2.2 DMSO脱硫法[6-7]
将 60 mgκPy(约 50 mgκ-卡拉胶)加到 10 mL 干燥具塞玻璃瓶中, 加入4.5 mL无水DMSO和0.5 mL无水甲醇, 超声溶解后, 于 80 ℃沙浴反应 10 h后,冷却至室温, 加入5 mL蒸馏水终止反应。产物经透析袋透析去除有机溶剂、盐等杂质, 内液离心后过0.22 μm膜, 旋蒸、冻干。
1.2.3 CTMS法[8]
取 60 mgκPy(约 50 mgκ-卡拉胶), 加到 10 mL干燥具塞玻璃瓶中, 用5 mL无水吡啶溶解后, 加入CTMS 0.67 mL, N2保护下100 ℃油浴反应8 h后, 缓慢加入5 mL蒸馏水终止反应。其他步骤同上。
1.2.4 PMA法[9]
取 60 mg κPy(约 50 mgκ-卡拉胶), 加到 100 mL干燥圆底烧瓶中, 加入9 mL 无水DMSO和1 mL无水吡啶, 磁力搅拌溶解后, 分别加入65 mg PMA和60 mg Sb2O3, 再加入1 mL吡啶, 在N2保护下, 在120 ℃磁力搅拌油浴中搅拌反应3 h后, 冷却至室温,向反应体系中加入 3 %碳酸氢钠水溶液 5mL, 终止反应。其他处理步骤同上。
1.2.5 硫酸基含量分析[12]
采用硫酸钡比浊法测定。
“数学教育中的历史与认识论欧洲暑期大学”中的“认识论”主要是指(2)中的“历史认识论”,尤其强调数学知识建构中的问题、错误、猜想及“认识论断裂”这个概念的作用.
1.2.6 红外光谱分析
取各多糖样品以及脱硫后样品适量, 用 P2O5干燥48 h, 取1 ~ 2 mg经KBr压片后进行红外光谱分析, 扫描范围为 400 ~ 4 000 cm-1。
1.2.7 分子质量测定
将样品用0.1 mol/L Na2SO4配成5 g/L溶液, 经Shodex OHpak SB-806 HQ色谱柱分离, 采用示差和十八角激光散射仪联用技术分析测定各样品分子量。进样量100 μL, 柱温35 ℃, 流速0.5 mL/min。
2 结果与讨论
2.1 样品得率和硫酸基含量
样品经三种方法脱硫后, 分别冻干、称重, 计算产率, 结果如表1所示。由表1可知, PMA法(62.0 %)及 CTMS法(50.6 %)产率相对较高, 而 DMSO 法(45.3 %)产率较低。产率的高低主要与以下因素有关,一是原料起始为钠型, 使用阳离子交换树脂将其转变为氢型, 与吡啶反应生成吡啶盐, 以增加其溶解度, 然后脱除硫酸基, 最终原料二糖单位分子质量降低(图 1), 导致产率降低; 另一个原因是由于脱硫过程中造成了多糖的降解, 形成降解产物, 在后续透析过程中造成损失, 从而降低得率。
本实验κ-卡拉胶钠盐二糖重复单元的分子质量为 408.3 D, 当转变为吡啶盐后, 二糖单元分子质量变为 464.4 D。如果κ-卡拉胶全部脱硫, 则得到β-卡拉胶, 其二糖重复单元的分子质量为306.3 D。由κ-卡拉胶变为β-卡拉胶的理论得率为 75.0 %(306.3/408.3)(图1)。由于三种方法脱硫所用的温度、试剂等均不同, 产物颜色也不同, 如 DMSO法产物为白色, 其余两个产物均为浅褐色, 但所用产物均为无定型粉末。
从表1可看出, 不同方法脱硫效果不同, CTMS法及DMSO法对于κ-卡拉胶脱硫效果不如PMA法, PMA法的脱硫率为82.8 %, 是一种较理想的脱硫方法。
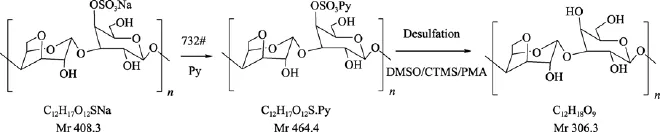
图1 脱硫前后卡拉胶二糖重复单元结构Fig. 1 Repeating disaccharide structure of κ-carrageenan before and after desulfation
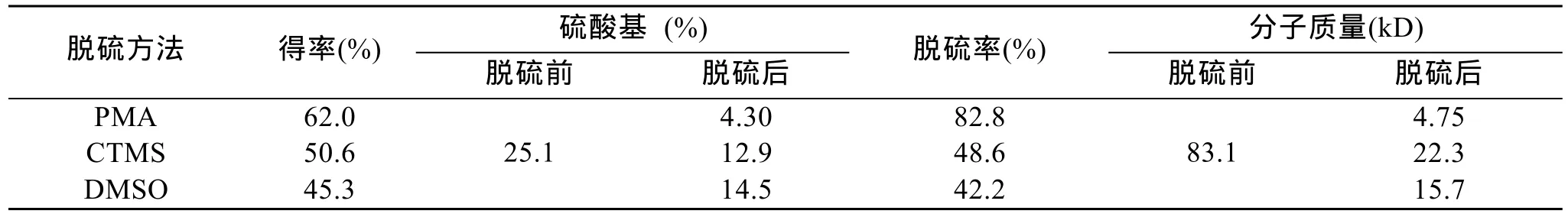
表1 κ-卡拉胶脱硫前后得率、硫酸基含量及分子质量分析Tab. 1 The yield, sulfate content and molecular mass analysis of κ-carrageenan before and after desulfation
2.2 样品分子质量分析
脱硫反应均会造成多糖不同程度的降解, 其降解程度与样品结构、反应体系温度、含水量及溶剂种类等因素有关。本文将样品转化为吡啶盐, 有利于提高样品在体系中的溶解度。κ-卡拉胶在采用 PMA法、CTMS法和DMSO法脱硫后, 峰型不同, 出峰时间延长, 表明分子质量均降低,结果见图2和表1。
示差和十八角激光散射仪联用技术是一种不需标准品, 可以直接测定样品分子质量的分析技术,示差信号显示样品组成, 激光信号测定分子质量。选取激光信号与示差信号重合部分进行计算, 获得样品分子质量数据。从表1可知, 产物的峰位分子质量由83.1 kD分别降为4.75 、22.3 和15.7 kD, 与脱硫前相比, 分子质量均明显降低。DMSO法得率较低,是由于产生大量寡糖(dp 4-20), 在透析过程中损失所致, 这一点经Toshi[13]研究组用DMSO法制备脱硫的硫酸软骨素寡糖证实; 而PMA法虽然产物分子质量降低, 但不会降解产生寡糖[9], 因此在透析过程中损失较少, 产率相对较高。
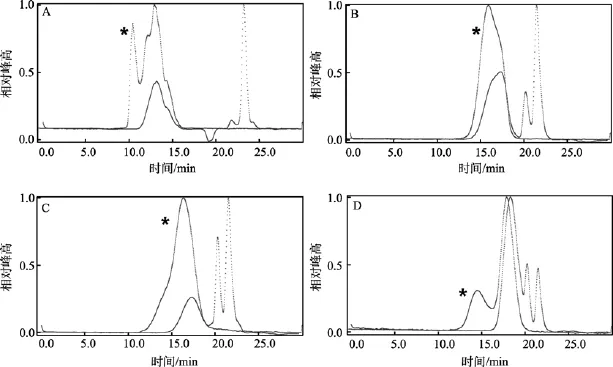
图2 不同脱硫方法多糖样品HPGPC-RI-MALLS图谱Fig. 2 HPGPC-RI-MALLS chromatographs of polysaccharides before and after desulfation by different methods
2.3 红外光谱分析
从分子质量分析可知, 多糖脱硫前后发生不同程度降解, 降解后多糖骨架是否破坏是重要的评价指标。脱硫前后κ-卡拉胶的红外光谱分析如图 3所示。1 250 cm-1左右为硫酸酯基中S=O伸缩振动峰,其强弱可以初步判定硫酸基的多少, 通过比较其与1069 cm-1处C-O伸缩振动峰(表征糖总量), 可以考察脱硫效果。κ-卡拉胶中C4位硫酸基的红外特征吸收峰在 845 cm-1处, 比较此处吸收, 可表征硫酸基脱除效果; 930 cm-1为3,6内醚特征吸收峰。
由图3可知, DMSO法脱硫产物在1 250 cm-1处吸收峰峰值仍很高, 脱硫效果不理想; CTMS法与DMSO法比较, 1 250 cm-1处峰值有所降低, 但总体仍较高, 而且 850 cm-1(C4位硫酸基)有较明显吸收峰,说明脱硫效果不理想; PMA法在1 250 cm-1吸收峰小, 850 cm-1没有明显吸收峰, 说明脱硫效果显著,且脱硫后多糖特征吸收没有明显改变, 说明没有破坏κ-卡拉胶主链结构。

图3 κ-卡拉胶及脱硫样品的FTIR图谱Fig. 3 FTIR spectra of κ-car and different samples of desulfation
2.4 PMA法在其他硫酸多糖脱硫中应用
为了验证PMA法的有效性, 本文进一步对其他硫酸多糖进行脱硫分析。
选择λ-卡拉胶、ι-卡拉胶为实验对象, 应用PMA法进行脱硫, 产物进行红外光谱分析, 其结果如图 4和图5。
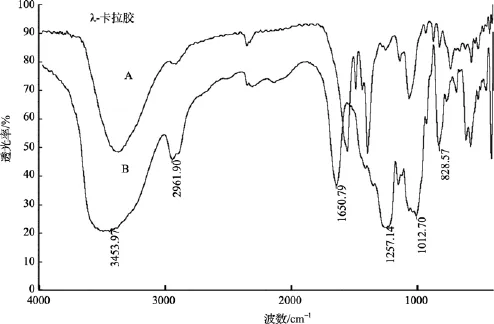
图4 λ-卡拉胶脱硫前后样品FTIR图谱Fig. 4 FTIR analysis of λ-carrageenan before and after desulfation
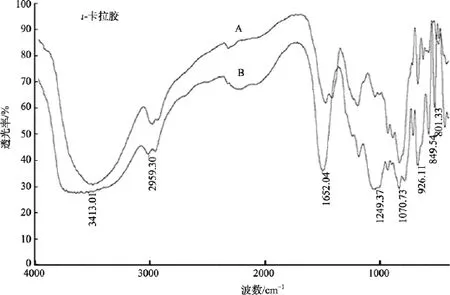
图5 ι-卡拉胶脱硫前后样品红外光谱分析Fig. 5 FTIR analysis of ι-carrageenan before and after desulfation
由图4和图5 可知, 脱硫产物在1 250cm-1处吸收峰明显降低, 而且λ-卡拉胶在830 cm-1、806 cm-1(C2位硫酸基吸收)及820 cm-1(C6位硫酸基吸收)处吸收峰降低,ι-卡拉胶在 806 cm-1(C2位硫酸基吸收)、845 cm-1(C4位硫酸基吸收)处吸收峰降低, 说明PMA法对C2、C4、C6位硫酸基均有较好的脱除效果。
海蒿子(Sargassum pallidum)水提取物用强阴离子交换色谱(Q Sepharose FF, 1 mol/L NaCl)分离获得一种岩藻聚糖硫酸酯, 用 PMA 法脱硫, 将脱硫前(A)与脱硫后(B)样品进行了红外光谱分析, 其结果如图6所示。脱硫前该组分在1 250 cm-1处峰值很高, 脱硫产物(B)在 1 250 cm-1处吸收峰几乎消失, 说明PMA法对此多糖的脱硫效果较理想, 其硫酸基含量由脱硫前的20 %降低到4 %左右。
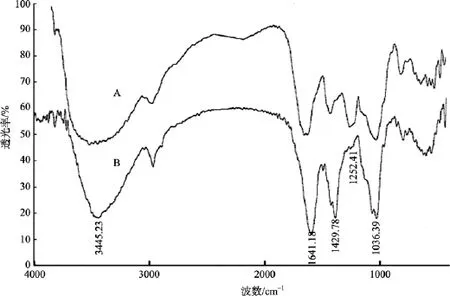
图6 海蒿子岩藻聚糖硫酸酯脱硫前(A)和脱硫后(B)红外光谱图Fig. 6 FTIR spectra of polysaccharides from Sargassum Pallidum after (A) and before (B)desulfation
3 结论
本文以κ-卡拉胶为研究对象, 考察了PMA法、CTMS法、DMSO法对其脱硫的效果, 从产率、硫酸基含量、红外光谱、分子量等方面考察, 表明 PMA法是一种较理想的多糖脱硫方法, 该法脱硫效率高,用时短, 优于CTMS法、DMSO法。利用PMA法对其他海洋硫酸多糖样品进行脱硫实验, 同样得到了较理想的效果。本方法为从事糖类构效关系研究, 以及海洋糖类药物开发提供了基础。
[1]胡艳南, 于广利, 吴建东. 珊瑚藻硫酸多糖的提取分离及其结构表征[J]. 中国海洋大学学报, 2010, 40(10): 90-94.
[2]于广利, 嵇国利, 冯以明. 刺松藻水溶性多糖的提取分离及其理化性质研究[J]. 中国海洋大学学报, 2010,40(11): 90-94.
[3]文松松, 赵峡, 于广利. 海洋动物多糖研究进展[J].中国海洋药物, 2009, 28(4): 46-51.
[4]Stephanie B, Eric D, Sophie F M, et al. Carrageenan fromSolieria chordalis(Gigartinales): Structural analysis and immunological activities of the low molecular weight fractions[J]. Carbohy Poly, 2010, 81(2): 448-460.
[5]Chen Shiguo, Xue Changhu, Yin Li’ang, et al. Comparison of structures and anticoagulant activities of fucosylated chondroitin sulfates from different sea cucumbers[J]. Carbohy Poly, 2011, 83: 688-696.
[6]Ciucanu I, Kerek F. A simple and rapid method for the permethylation of carbohydrates[J]. Carbohydrate Research, 1984, 131(2), 209-217.
[7]Patankar M S, Oehninger S, Barnett T. A revised structure for fucoidan may explain some of its biological activities[J]. The Journal of biological chemistry, 1993,268(29): 21770-21776.
[8]Adriana A. Kolender, Marıa C. Matulewicz. Desulfation of sulfated galactans with chlorotrimethylsilane.Characterization of b-carrageenan by1H-NMR spectroscopy[J]. Carbohydrate Research, 2004, 339:1619-1629.
[9]Miller I J, Blunt J W. Desulfation of algal galactans [J].Carbohydrate Research 309(1998): 39-43.
[10]周革非, 李树福, 王长海. κ-卡拉胶硫酸多糖的免疫调节活性初步研究[J]. 海洋科学, 2010, 8: 56-59.
[11]郭丹, 栾晖, 孙藜玮. 低分子量卡拉胶及其衍生物的生物学活性研究进展[J]. 安徽农业科学, 2010, 5:2581-2583.
[12]丛建波, 王长振, 李妍. 褐藻硫酸多糖硫酸基含量测定-硫酸钡比浊法研究[J]. 解放军药学学报, 2003,19(3): 181-183.
[13]Toida T, Sato K, Sakamoto N. Solvolytic depolymerization of chondroitin and dermatan sulfates[J]. Carbohydrate Research, 2009, 344: 888-893.
