南繁条件下转基因水稻对根际土壤微生物的影响
2012-10-12黄启星孔祥义王旭初郭安平海南大学农学院海南海口5708中国热带农业科学院热带生物技术研究所海南海口570三亚市南繁科学技术研究院海南三亚57000
徐 林,黄启星,左 娇,孔祥义,王旭初,郭安平海南大学农学院,海南海口5708;中国热带农业科学院热带生物技术研究所,海南海口570;三亚市南繁科学技术研究院,海南三亚57000
南繁是指秋冬季节全国各地人员到海南从事农作物品种选育、种子生产和种质鉴定等活动。长期以来,海南省南部三亚、乐东、陵水等地形成了南繁基地。南繁地区是我国独一无二的天然大温室,能够提供动植物周年生长、繁殖的优良自然条件(陈冠铭等,2006),为缩短农作物繁育年限和加速世代繁育提供了条件。近年来,随着转基因技术的发展,转基因作物安全评价备受关注。为保障南繁育种区的育种安全,急需在加强对转基因作物监管的同时,研究南繁条件下转基因作物对环境的影响,为开展转基因作物育种安全评价提供支撑。土壤微生物群落结构是衡量土壤质量的指标之一(Sharma et al.,2011)。因此,研究转基因作物对根际土壤微生物的影响已经成为转基因作物安全评价的一项重要内容。国内外关于转基因作物对其根际土壤微生物的影响已屡见报道(张美俊等,2008;Andreote et al.,2009),但针对南繁条件下的此类研究较少(王昊等,2011)。本研究经过对水稻3个种植周期的试验,探讨转基因水稻对根际土壤可培养微生物的影响,以期为在南繁区开展转基因水稻的安全评价提供数据支持。
1 材料与方法
1.1 水稻品种
本研究选取转cry1Ab/cry1Ac基因水稻华恢1号(TT51)为材料,以其亲本水稻明恢63(MH63)为对照。2种材料均由中国农业科学院植物保护研究所提供。
1.2 种植规格
试验田位于海南省三亚市南繁科学技术研究院内(18°18'10″N、109°24'44″E),海拔 27 m。试验地为砂壤土,肥力中等偏上。试验地面积为30 m×20 m,周围有围墙隔离。转基因水稻种植区面积(5×5)m2,株行距20 cm×20 cm,其余地块均种植非转基因水稻,不同水稻由田埂进行隔离。种植期间未施用农药。
1.3 土壤样品采集
在水稻种植中心区域,采用对角线采样法随机多点采样,然后均匀混合成1个样品。每10 d采1次样。将土壤样品置于室内,自然风干。
1.4 根际土壤理化性质监测
将在水稻幼苗期和收获期采集的土壤经20目过筛后,分别对其理化性质进行测定。测定指标包括pH,全氮、碱解氮、全磷、速效磷、全钾、速效钾等含量。该部分试验委托中国热带农业科学院分析测试中心检测。
1.5 土壤微生物培养和计数
采用平板菌落计数法(沈萍等,1999)对土壤微生物进行计数。细菌、放线菌和真菌分别用牛肉膏蛋白胨、高氏一号和孟加拉红培养基培养。采用人工计数方法统计菌落数量,计算每克干土中的菌落数/(CFU·g-1)。
1.6 细菌种属鉴定
根据菌落形态,从每个样品中挑选30个单菌落进行平板划线纯化。提取菌体DNA,使用16S通用引物27F、1492R(王昊等,2011)对细菌、放线菌16S rDNA进行PCR扩增。采用AxyPrep DNA gel extraction Kit回收目的条带,送上海生工生物工程公司测序。采用BLAST序列比对方法,将测序结果与Gen-Bank数据库进行比对,初步鉴定到属一级。
1.7 土壤线虫的计数
参考王昊等(2011)报道的方法统计土壤线虫数量。
1.8 数据分析
运用Microsoft excel 2007软件对数据进行t-test等统计分析。
2 结果与分析
2.1 根际土壤理化性质
由表1可以看出,水稻收获期与幼苗期相比,TT51和MH63都存在以下情况:土壤pH略有上升;全氮含量基本未发生变化;碱解氮含量明显上升;全磷含量大幅度降低;速效磷、速效钾含量均明显上升。不同的是,TT51幼苗期土壤的有机质少于收获期,而MH63则相反;TT51收获期全钾含量高于幼苗期,而MH63在2个时期的全钾含量变化较小。此外,在幼苗期或收获期,TT51与MH63各土壤理化指标的差异较小,说明TT51对其根际土壤理化性质的影响较小。

表1 水稻幼苗期和收获期土样理化性质Table 1 Chemical properties of soil sampled at the start of the experiments and after the growth of non-transgenic rice and transgenic rice at the Plant Breeding Base of Hainan
2.2 转基因水稻对根际土壤微生物数量组成的影响
由表2可以看出,细菌方面,在3个种植周期(42个监测时间点)中,有16个监测点出现明显变化。TT51根际土壤细菌群落数量显著高于对照MH63的监测点有7个(P<0.05),其中,极显著高于对照的监测点有3个(P<0.01);TT51根际土壤细菌群落数量显著低于MH63的监测点有9个(P<0.05),其中,极显著低于对照的监测点有3个(P<0.01)。
真菌方面,在3个种植周期(42个监测时间点)中,有21个监测点出现明显变化。TT51根际土壤真菌数量显著高于对照MH63的监测点有5个(P<0.05),其中,极显著高于对照的监测点有3个(P<0.01);TT51根际土壤真菌数量显著低于MH63的监测点有16个(P<0.05),其中,极显著低于对照的监测点有7个(P<0.01)。
放线菌方面,在3个种植周期(42个监测时间点)中,有20个监测点出现明显变化。TT51根际土壤放线菌数量显著高于对照MH63的监测点有10个(P<0.05),其中,极显著高于对照的监测点有8个(P<0.01);TT51根际土壤放线菌数量显著低于MH63的监测有10个(P<0.05),其中,极显著低于对照的监测点有3个(P<0.01)。
此外,通过连续3个种植周期监测水稻根际土壤微生物种群数量,发现土壤微生物种群数量变化与水稻生育期之间无明显相关性。TT51与对照MH63根际土壤细菌、真菌和放线菌的数量变化趋势相似。从总体上看,转基因水稻对土壤微生物数量未造成明显影响。仅有个别监测时间点显示两者间存在明显差异,但变化不成规律,这可能是由于采样和计数误差造成。
2.3 转基因水稻对根际土壤微生物物种组成的影响
采集第一种植周期水稻收获时的土壤,分别用牛肉膏蛋白胨、高氏一号培养基培养,纯化细菌、放线菌。分子鉴定及与GenBank序列BlastN比对结果显示,TT51与MH63细菌种类大体相同,为芽孢杆菌属Bacillus、假单胞菌属Pseudomonas、链霉菌属Streptomyces(表3)。
2.4 转基因水稻对根际土壤线虫的影响
在第三种植周期(14个监测时间点)中,有6个监测点出现明显变化。TT51根际土壤线虫数量显著高于对照MH63的监测点有5个,MH63根际土壤线虫数量显著高于TT51的监测点有1个(图1)。
3 结论与讨论
本研究在南繁条件下连续2年对转cry1Ab/cry1Ac水稻根际土壤可培养微生物群落数量动态进行了监测。结果显示,转cry1Ab/cry1Ac基因水稻TT51对根际土壤细菌、真菌和放线菌的群落数量没有明显影响,这与 Kim et al.(2008)和 Wu et al.(2009)的研究结果一致。此外,Lee et al.(2011)运用T-RFLP和实时荧光定量PCR方法对转基因水稻的根际细菌、真菌群落进行研究,发现与非转基因水稻相比,转基因水稻不会对土壤细菌和真菌的群落结构产生影响。然而,杨保军等(2009)认为,转基因水稻根际土壤细菌、真菌和放线菌数量显著高于非转Bt基因水稻MH63,并且转Bt基因水稻对根际细菌数量的影响与水稻生育期相关。本研究中仅有部分监测结果显示转基因水稻与其对照的根际土壤微生物数量存在明显差异,其中既有转基因水稻根际土壤微生物数量显著高于非转基因的情况,也有相反的情况,但总体变化趋势一致。这可能是由平板计数的技术特点和大田试验中多种不可控条件(如气候、温度)等因素造成。因此,目前获得的初步结论仍有待进一步验证。
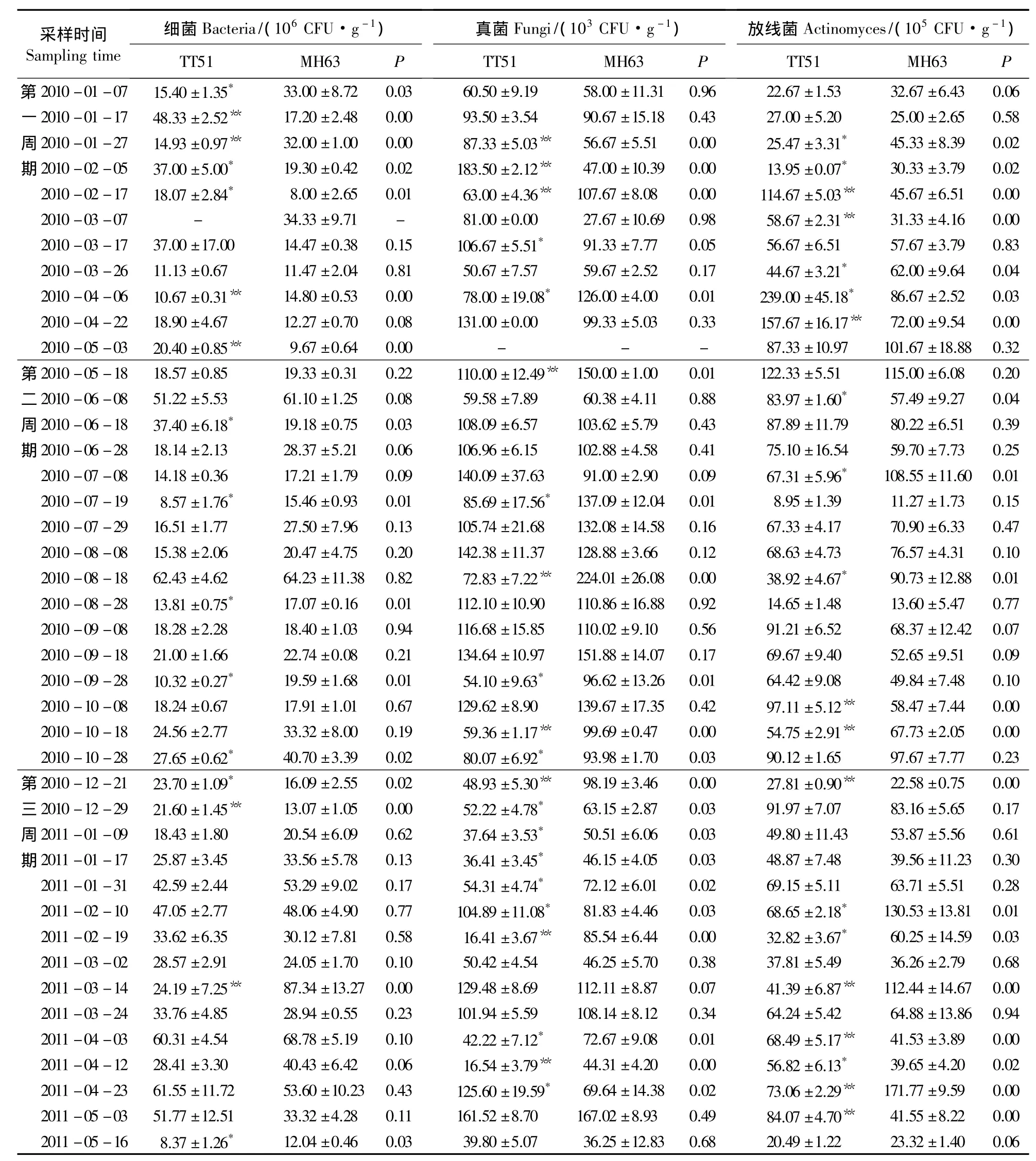
表2 水稻根际土壤细菌、真菌和放线菌群落数量变化Table 2 Population dynamics of bacteria,fungi and actinomyces isolated from rice rhizosphere soil

表3 水稻根际土壤细菌序列BlastN比对结果Table 3 BlastN results of rice rhizosphere soil bacterial sequences

图1 水稻根际土壤线虫群落数量变化Fig.1 Population dynamics of nematode isolated from rice rhizosphere soil
土壤微生物种属鉴定结果显示,TT51与MH63根际主要微生物类群一致。但由于在常规培养条件下,土壤中可培养微生物不到其总量的1%,仅鉴定出3个属,即芽孢杆菌属、链霉菌属、假单胞菌属。经过连续3个种植周期的监测,发现种植转基因水稻短期不会对其根际土壤微生物种类构成产生明显影响,也不会对根际微生物产生累积影响。
土壤微生物群落结构是土壤生态监测的重要内容,因此,转基因作物对其根际土壤微生物群落结构的影响还有待进一步研究,特别是采用新技术(如宏基因组测序)对不可培养微生物的研究。此外,植物主要通过植物组织(包括植物残茬和花粉)(Icoz & Stotzky,2008;Wu et al.,2009)和根部分泌物(Bardgett et al.,1999)影响土壤微生物的多样性。转基因植物组织降解后,具有生物活性的外源片段有可能向土壤微生物发生基因横向转移(Pontiroli et al.,2009),从而使土壤微生物获得新的性状,进而改变土壤微生物多样性(包括生物多样性和功能多样性),造成潜在的生态风险。因此,后续研究还可采取ELISA等技术探讨外源基因及其表达产物对土壤微生物的影响(付庆灵,2011)。
陈冠铭,曹兵,李劲松,林亚琼.2006.农业南繁的形成发展与重要影响.中国种业,12(7):7-8.
付庆灵.2011.种植转Bt基因棉土壤中Bt蛋白的分布.应用生态学报,22(6):1493-1498.
沈萍,范秀容,李广武.1999.微生物学试验.北京:高等教育出版社.
王昊,黄启星,孔祥义,袁经天,郭安平.2011.南繁条件下转基因棉花对根际土壤微生物及棉田虫害影响的初步研究.热带作物学报,32(5):874-880.
杨保军,唐健,江云珠,彭于发.2009.转cry1Ab基因克螟稻对根际可培养细菌类群的影响.生态学报,29(6):3036-3043.
张美俊,杨武德,李燕娥.2008.不同生育期转Bt基因棉种植对根际土壤微生物的影响.植物生态学报,32(1):197-203.
Andreote F D,Rossetto P B,Mendes R,Avila L A,Labate C A,Pizzirani-Kleiner A A,Azevedo J L and Araujo W L.2009.Bacterial community in the rhizosphere and rhizoplane of wild type and transgenic eucalyptus.World Journal of Microbiology& Biotechnology,25(6):1065-1073.
Bardgett R D,Denton C S and Cook R.1999.Below-ground herbivory promotes soil nutrient transfer and root growth in grassland.Ecology Letters,2(6):357 -360.
Icoz I and Stotzky G.2008.Fate and effects of insect-resistant Bt crops in soil ecosystems.Soil Biology and Biochemistry,40(3):559-586.
Kim M C,Ahn J H,Shin H C,Kim T,Ryu T H,Kim D H,Song H G,Lee G H and Kai J O.2008.Molecular analysis of bacterial community structures in paddy soils for environmental risk assessment with two varieties of genetically modified rice,Iksan 483 and Milyang 204.Journal of Microbiology and Biotechnology,18(2):207-218.
Lee S H,Kim C G and Kang H.2011.Temporal dynamics of bacterial and fungal communities in a genetically modified(GM)rice ecosystem.Microbial Ecology,61(3):646-659.
Pontiroli A,Rizzi A,Simonet P,Daffonchio D,Vogel T M and Monier J M.2009.Visual evidence of horizontal gene transfer between plants and bacteria in the phytosphere of transplastomic tobacco.Applied and Environmental Microbiology,75(10):3314-3322.
Sharma S K,Ramesh A,Sharma M P,Joshi O P,Govaerts B,Steenwerth K L and Karlen D L.2011.Microbial community structure and diversity as indicators for evaluating soil quality.Biodiversity,Biofuels,Agroforestry and Conservation Agriculture,5:317 -358.
Wu W X,Liu W,Lu H H,Chen Y X,Devare M and Thies J.2009.Use of C-13 labeling to assess carbon partitioning in transgenic and non-transgenic(parental)rice and their rhizosphere soil microbial communities.FEMS Microbiology E-cology,67(1):93-102.
