长白猪微卫星标记的遗传多样性
2012-10-10巩元芳段玲欣吴建华任铁艳王沛芳刘铮铸李凤敏
巩元芳,段玲欣,倪 静,吴建华,任铁艳王沛芳,刘铮铸,李凤敏
(1河北科技师范学院动物科技学院,河北省预防兽医学重点实验室,河北秦皇岛,066600;2河北省宣化县职业技术教育中心)
微卫星是20世纪80年代末期发展起来的一种新型DNA标记,一般由1~6 bp的短核苷酸为核心序列,呈串联重复状分布于生物整个基因组,重复数在10~20次之间,具有分布广泛、多态信息含量高、呈共显性遗传、稳定性好、保守性强及检测方便快速等特点而倍受青睐,被广泛用于评估生物遗传多样性、构建高分辨率的遗传连锁图及复杂相关基因定位等的研究[1]。联合国粮农组织(FAO)在其持续发展和管理动物遗传资源的战略计划中,也将微卫星标记作为优先推荐的分析工具[2]。
长白猪原产于丹麦,原名兰德瑞斯(Landrace),是世界上第一个育成的最著名的瘦肉型品种,它是丹麦本地猪与英国大白猪杂交,经过长期系统选育形成的,迄今已有70多年历史。由于该品种具有适应性好、生长快、遗传性稳定、饲料利用率高,而且母猪产仔数多、泌乳性能好、断乳窝重较高以及胴体瘦肉产量高等优点,所以在当代世界范围内成为数量最多、分布最广的一个瘦肉型品种[3]。
目前,对于长白猪,有关借助微卫星标记对其遗传结构和遗传多样性方面的研究鲜有报道。基于以上研究背景,本研究利用3个微卫星标记在长白猪中进行遗传多样性的分析,以期为长白猪遗传资源保护和合理的开发利用等提供科学依据。
1 材料与方法
1.1 试验猪群及样品的采集
80头长白猪来自于中国农科院保种场,所有试验猪身体健康,在常规饲养环境下饲养。用消毒过的耳号钳采取3 mm×6 mm大小的耳组织2~3块,放于盛有体积分数为0.70的分析醇的EP管中,-20℃保存待用。
1.2 基因组DNA的提取
采用常规的酚-氯仿抽提法[4]。
1.3 微卫星标记的选择
根据USDA-MARC(美国肉畜中心)最新猪微卫星标记遗传连锁图,选择扩增效果好、多态信息含量大、重复次数多、等位基因数目在4个以上的微卫星座位作为研究对象[5]。为了实现微卫星多态性的荧光半自动检测,必须对引物进行荧光修饰,即在上游引物的5’端加上发光基团。当荧光引物扩增的PCR产物在ABI377测序仪上进行电泳检测时,在激光的激发下荧光基团发光,系统自动收集荧光信号,从而获得PCR产物的数据信息。所选微卫星标记的相关信息如表1和表2所示。
1.4 微卫星标记的PCR扩增及反应条件
PCR 反应总体积为 20.0 μL,其中 10 × buffer(含 15 mmol/L MgCl2的缓冲液)2.0 μL,dNTPs 1.6 μL,上下游引物(10 μmol/L 的引物)分别为0.4 μL,模板 DNA 1.0 μL,TaqDNA 聚合酶(5 ×106 U/L)0.1 μL,双蒸水 14.5 μL。
PCR 反应条件为94℃预变性5 min;94℃变性30 s,55.8~66.8℃退火30 s,72℃延伸30 s,35个循环;72℃总延伸10 min,最后4℃保存。

表1 3个微卫星标记的相关信息
1.5 电泳检测
每次PCR反应设不含模板的空白对照,扩增产物经质量浓度为25 g/L的琼脂糖凝胶电泳并在凝胶自动成像仪上检测。

表2 3个微卫星标记的引物序列、退火温度及荧光修饰情况
1.6 微卫星基因型的分型
利用ABI377自动DNA测序仪和GeneScan V3.7软件进行微卫星基因型的检测和分型。
1.7 数据的整理与统计分析
微卫星呈共显性遗传,对测得的基因型做简单统计即可计算出等位基因频率[6]。本研究采用Pop-Gene32(ver1.31)软件和自编程序进行了微卫星基因座的群体遗传变异分析,其中,进行了每个微卫星标记的等位基因频率、有效等位基因数(Ne)和遗传杂合度(H)的计算,用自编程序进行了多态信息含量(PIC)的计算。
式中,pi为第i个等位基因的频率,n为等位基因数。
式中,pi为某一位点上第i个等位基因频率,n为某一位点的等位基因数。
式中,pi,pj分别为群体中第i,j个等位基因频率,n为等位基因数。
2 结果与分析

图1 基因组DNA琼脂糖凝胶电泳检测结果
2.1 基因组DNA的提取结果
基因组DNA琼脂糖凝胶电泳检测结果如图1所示。由图1可以看出,DNA条带清晰,DNA量较大,点样孔干净,说明提取的猪基因组DNA无蛋白质污染。
2.2 微卫星标记的基因型判定
2.2.1 PCR产物的琼脂糖电泳检测结果 3个微卫星标记的扩增产物在25 g/L的琼脂糖凝胶电泳上检测,结果如图2所示。可以看出,每孔都有产物,且所有条带浓度均匀一致,适合进行后期的GeneScan检测。ESTMS20,SW2570和S0002的PCR产物网上公布分别在111~131 bp,152~178 bp和189~212 bp之间,而图2(a)近100 bp有1条带,图2(b)在100 bp和200 bp之间有1条带,图2(c)在近200 bp有1条带,这些结果与网上公布的基本一致。事实上后期经GeneScan检测在长白猪中ESTMS20的产物在113~135 bp之间,SW2570的产物在158~180 bp之间,S0002的产物在189~209 bp之间。
2.2.2 利用GeneScan V3.7软件完成基因型的分型 图3是3个微卫星标记经GeneScan V3.7软件识别后的等位基因情况,ESTMS20只有1个等位基因,SW2570和S0002均有2个等位基因。
2.3 3个微卫星标记的等位基因频率、有效等位基因数(Ne)、遗传杂合度(H)和多态信息含量(PIC)
观察3个微卫星标记的等位基因频率,各等位基因分布不均匀,每个微卫星标记都有其优势等位基因的存在(表3)。在3个微卫星中,ESTMS20多态性最小,等位基因数为4个,以123 bp的频率最高,其频率为0.44。SW2570和S0002的等位基因数均为5个,而在SW2570的扩增结果中,158 bp频率最高,其频率为0.35,其次是178 bp,其频率为0.33;在S0002的扩增结果中,207 bp的频率最高,其频率为0.75。另外,3个微卫星标记在长白猪群体中的遗传杂合度为0.41~0.70;多态信息含量为0.38~0.65,有效等位基因数为 1.7 ~3.4。
3 讨 论

图2 3个微卫星扩增产物的琼脂糖凝胶电泳检测结果
有效等位基因数(Ne)是遗传纯合度的倒数,它表明等位基因间的相互影响,反映其实际作用的等位基因数目,也可以作为群体遗传变异的一个测度。等位基因在群体中分布越均匀,有效等位基因数越接近检测的等位基因绝对数[5]。由表3可以看出,本研究中的ESTMS20和SW2570在群体中分布比较均匀,而S0002中存在1个分布极显著的等位基因(207 bp),由此推测此等位基因在遗传上起的作用可能更大一些。根据微卫星的选择标准[2,7],每个微卫星位点有4个等位基因,可以使每个位点的有效等位基因数大于2,本研究的3个微卫星的有效等位基因数分别为3.3,3.4和1.7(接近于2),由此表明这3个微卫星均可用于长白猪遗传多样性的评估。
遗传杂合度(H)的大小能近似反映出群体遗传结构和变异程度的高低。杂合度越高,群体的遗传多样性越高[5,8]。ESTMS20,SW2570和 S0002在长白猪中的杂合度分别为0.69,0.70 和0.41,平均杂合度为0.60,与 Nei等[9]报道的微卫星杂合度(0.3~0.8)以及泽格·欧特[10]对基因杂合度不小于0.1的要求基本一致。由此可见,本研究的3个微卫星标记均具有较高的多态性。
多态信息含量(PIC)也是衡量位点多态性的一个重要指标[5],Bostein 等[6]和 Cooper等[11]均以 0.25 和 0.50 作为位点多态性高、中、低不同层次的分界标准,他们认为当PIC>0.50时,标记具有高度可提供的信息;当0.25<PIC <0.50,标记能较合理的提供信息;当PIC<0.25,标记提供的信息量较差,本研究中的3个微卫星标记在长白猪中的PIC分别为0.64,0.65和0.38,平均PIC为0.57,这又一次证明本研究的3个微卫星在长白猪中均为高度多态位点。
综上所述,长白猪群体内的遗传多样性都比较丰富,具有较高的选择潜力,所选3个微卫星标记能够用于长白猪的群体遗传多样性的分析。本研究结果将为今后很好利用和开发长白猪提供较好的参考依据。
4 结 论
本研究采用ESTMS20,SW2570和S0002等3个微卫星标记对长白猪进行了遗传多样性的研究。结果发现,3个微卫星标记在长白猪中均具有多态性,基因杂合度分别为0.69,0.70和0.41,多态信息含量分别为0.64,0.68和0.38,由此推测,这3个微卫星标记在长白猪群体中属于高度多态性座位,可以用于长白猪遗传多样性的评估。
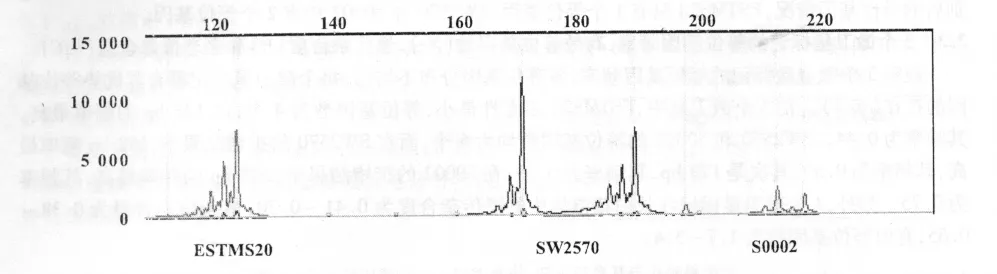
图3 3个微卫星通过GeneScan V3.7软件的判型结果

表3 3个微卫星标记在长白猪中的有效等位基因数(Ne)、遗传杂合度(H)、多态信息含量(PIC)和等位基因频率
[1]张桂香,王志刚,孙飞舟,等.56个中国地方猪种微卫星基因座的遗传多样性[J].遗传学报,2003,30(3):225-233.
[2]BARKER J S F.A global protocol for determining genetic distances among domestic livestock breeds[J].proc 5th world cong genet appl livest prod,1994,21:501-508.
[3]候五云,邓学法.丹麦长白猪的繁殖性能及其胴体品质表现[J].百泉农专学报,1982(1):55-60.
[4]SAMBEOOK J,FRITSCH E F,MANIATIS T.Molecular Cloning:Second edition[M].New York:Cold Sp ring Habor Laboratory Press,1989.
[5]张富,巩元玲,栾庆江,等.三个微卫星标记在松辽黑猪中的遗传多样性研究[J].畜牧与饲料科学,2010,31(9):57-59.
[6]BOTSTEIN D,WHITE R L,SKOINCK M,et al.Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J].Am J Hum Genet,1980,32(3):314-331.
[7]储明星,程金华,过纬.微卫星标记OarAE101和BM1329在五个绵羊品种中的初步研究[J].遗传学报,2001,28(6):510-517.
[8]孙伟.湖羊、同羊遗传检测的研究[D].江苏:扬州大学,2003.
[9]NEI M,TAKEZAKI N.Estimation of genetic distances and phylogenetic trees from DNA analysis[J].Proceedings of the 5th World congress on Genetic Applied to Livestock Production,1994,21:405-412.
[10]泽格·欧特.人类遗传连锁分析[M].北京:中国农业大学出版社,1995.
[11]COOPER D N,SCHMIDTKE J.DNA restriction fragment length polymorphism and heterozygosity in the human genome[J].Hum Genet,1984,66(1):1-16.
