河北省滦县牛梨形虫的分子检测
2012-10-10张香斋陈丽凤王秋悦刘朋朋邹亚学
张香斋,陈丽凤,陈 娟,王秋悦,刘朋朋,石 芳,邹亚学
(河北科技师范学院动物科技学院,河北省预防兽医学重点实验室,河北秦皇岛,066600)
梨形虫病是一类经硬蜱传播,由梨形虫纲巴贝斯科或泰勒科原虫引起的血液原虫病的总称。迄今为止,全世界已记载的各种哺乳动物的巴贝斯虫有67种,泰勒虫有13种[1]。牛梨形虫病是世界性分布的严重危害养牛业发展的一类重要疾病,给畜牧业和国民经济造成巨大损失。在我国已报道的病原有牛巴贝虫(Babesia bovis)、双芽巴贝虫(B.bigemina)、大巴贝虫(B.major)、卵形巴贝虫(B.ovata)、一种尚未命名的巴贝虫(B.sp.)[2]、环形泰勒虫(Theileria annulata)、瑟氏泰勒虫(T.sergenti)和中华泰勒虫(T.sinensis)[3]。牛梨形虫病的传播媒介蜱有3种:残缘璃眼蜱(Hyalomma detritum)、长角血蜱(Haemaphysalis longicornis)和微小牛蜱(Boophihismicrophis)。据FAO统计,世界上有80%的牛遭到蜱的侵袭,仅硬蜱给畜牧业造成的损失,全球每年就高达70亿美元[4]。本试验应用PCR诊断技术,对采自河北省滦县某牛场的牛进行梨形虫检测,以便了解和分析该地区梨形虫自然感染状况,为更好地防治该病提供一些参考。
1 材料与方法
1.1 试验材料
1.1.1 牛血液 采自河北省滦县某牛场。
1.1.2 主要试剂及缓冲液配制 50 ×TAE:取 Tris碱242 g,冰乙酸57.1 mL,0.5 mol/L EDTA(pH 8.0)100 mL加入纯水定容至1 L,储存备用;蛋白酶K(德国Merck公司)、无水乙醇(天津市北方天医化学试剂厂)、琼脂糖(西班牙进口分装)。PCR相关试剂,2×Taq MasterMix(北京康为世纪生物科技有限公司),引物(北京赛百盛生物技术有限责任公司)。DL2000(北京博润德生物科技发展中心)。
1.1.3 仪器设备 超级恒温水浴箱(601型、金坛市医疗仪器厂)、高速台式离心机(TGL-16G,上海安亭科学仪器厂)、可调微量移液器(0.1 ~2.5,5 ~50,100 ~1 000 μL,德国普兰德)、梯度 PCR 仪(Mastercycler gradient,德国Eppendorf公司)、双稳定时电泳仪(DYY-6C型,北京六一仪器厂)、血液基因组小量提取试剂盒(北京康为世纪生物科技有限公司),基本常规仪器等均由河北省预防兽医学重点实验室提供。
1.2 试验方法
1.2.1 样本 从唐山滦县某牛场中抽检28头牛,静脉抽血,加肝素抗凝,分装入试管,放入冰盒带回实验室,保存待检。
1.2.2 模板DNA制备 使用血液基因组小量提取试剂盒(北京康为世纪生物科技有限公司)按操作说明书操作。
1.2.3 引物设计 根据GenBank上发表的环形泰勒虫Tams1基因序列合成THX-F1/THX-R1和THXF2/THX-R2两对引物;根据GenBank上已发表的牛瑟氏泰勒虫P32表面蛋白基因序列,合成TSSH-F/TSSH-R引物对;根据文献已发表的巴贝斯虫18S rRNA基因序列[5,6],合成BSHY-F/BSHY-R引物对,用于双芽巴贝斯虫18S rRNA基因的扩增;合成NBBS-F1/NBBS-R1和NBBS-F2/NBBS-R2两对引物对,用于其它巴贝斯虫18S rRNA基因的扩增,引物名称及序列见表1。以上梨形虫中仅环形泰勒虫为巢式PCR方法检测,其余虫种均为常规PCR方法检测。
1.2.4 PCR反应体系 PCR扩增均在20 μL反应体系中进行。该体系包括:2×Taq MasterMix 10 μL,上、下游引物各0.5 μL,模板各1.0 μL,超纯水补足至20 μL。离心混匀后选择适当的反应条件在PCR扩增仪上进行扩增。

表1 引物名称及序列
1.2.5 PCR 反应参数
(1)环形泰勒虫巢式PCR反应参数:第1轮PCR反应:预变性94℃,3 min;变性94℃,1 min;退火55℃,1 min;延伸72℃,1 min,40个循环,最后延伸72℃,7 min。第2轮PCR反应(以第1轮PCR产物为模板):预变性94℃,3 min;变性94℃,1 min;退火55℃,1 min;延伸72℃,1 min,30个循环,最后延伸72℃,7 min。
(2)瑟氏泰勒虫PCR反应参数:预变性95℃,3 min;变性95℃,2 min;退火63℃,2 min;延伸72℃,2 min,30 个循环,最后延伸72 ℃,5 min。
(3)牛双芽巴贝斯虫PCR反应参数:预变性94℃,3 min;变性94℃,30 s;退火58.1℃,1 min;延伸72 ℃,1 min,32 个循环,最后延伸72 ℃,5 min。
(4)其他牛巴贝斯虫PCR反应参数:预变性95℃,3 min;变性95℃,2 min;退火63℃,2 min;延伸72℃,2 min;30个循环,最后延伸72℃,5min。
1.2.6 电泳检测 反应结束后取5 μL扩增产物于质量浓度为10 g/L的琼脂糖凝胶电泳30 min,紫外灯下观察结果并拍照。
2 结果与分析
本试验检测的28个样本中,其中7个样本扩增出了约1 700 bp(图1,图2)特异性条带,双芽巴贝斯虫阳性样本7份,阳性率为25.00%;3个样本扩增出了约900 bp和1 300 bp两条特异性条带(图3,图4),其他牛巴贝斯虫阳性样本3份,阳性率10.71%;而环形泰勒虫和瑟氏泰勒虫均未检测到阳性样本。

图1 双芽巴贝斯虫18SrRNA基因扩增结果

图2 双芽巴贝斯虫18SrRNA基因扩增结果

图3 其他牛巴贝斯虫18SrRNA基因扩增结果
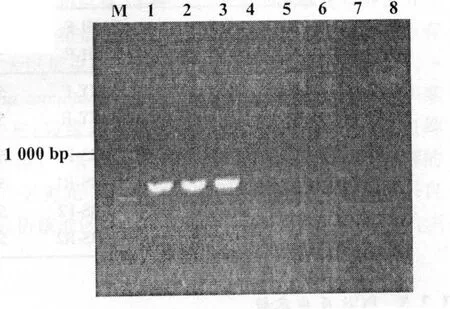
图4 其他牛巴贝斯虫18SrRNA基因扩增结果
3 讨 论
梨形虫病是一类必须通过硬蜱传播的家畜血液原虫病,侵袭牛的梨形虫主要是牛双芽巴贝斯虫、牛巴贝斯虫和牛泰勒虫[7]。我国疆域辽阔,地跨古北、东洋两大区,从寒温带到热带,自然条件复杂,许多地区存在着大量可作为本病传播媒介的硬蜱,因此我国家畜中梨形虫种类较多,对畜牧业的威胁很大。罗建勋等获得34个牛和羊的梨形虫不同地区分离株,并对病原进行了分类鉴定,结果共分离到牛羊梨形虫9种、21株,牛巴贝斯虫未定种1株,羊巴贝斯虫未定种7株,羊泰勒虫未定种5株[6]。双芽巴贝斯虫,分布较广,主要在南方各省;牛巴贝斯虫,发现于贵州、安徽、湖南、陕西及河北等地;卵形巴贝斯虫,发现于贵州、湖南、河南及吉林等地;环形泰勒虫,分布较广,主要在内蒙古及东北、西北各地;瑟氏泰勒虫,发现于贵州、吉林、辽宁、河北、河南、湖南、云南、陕西、甘肃及宁夏。
多年来,为了控制梨形虫病,世界各国均开展了大量的研究工作,20世纪80年代以后,随着现代分子生物学技术在这一领域的不断应用,解决了许多应用经典生物学技术难以证实或明确的问题,并为梨形虫病的防治提供了很多新的理论和手段,取得了巨大的成果。国际上,对梨形虫病的诊断方法己从血涂片检查、补体结合试验、间接荧光抗体发展到了DNA探针、PCR和酶联免疫吸附实验等更快速、准确的检测方法。Martin-Sanchez等[8]建立了巢式PCR技术,将采集自牛环形泰勒虫病不同流行地区的214份样品分别用血涂片显微镜检查、荧光抗体和PCR检测,结果阳性率分为62.26%,69.86%,78.04%。显然,PCR方法的检出率高于其它两种方法。本试验参考的GenBank上发表的环形泰勒虫Tams1基因序列、牛瑟氏泰勒虫P32表面蛋白基因序列以及文献已发表的巴贝斯虫18S rRNA基因序列[9,10]合成的梨形虫特异引物,现已广泛用于种的鉴定和基因相关性的研究。本试验采用PCR技术,对河北省滦县某牛场采集的28份血样进行梨形虫检测,结果显示,牛总感染率为25%(7/28),感染牛中均有双芽巴贝斯虫感染(7/28),与其他牛巴贝斯虫混合感染率为10.71%,表明河北省滦县牛梨形虫的自然感染情况较为严重,应给予高度重视。
[1]蒋金书.动物原虫病学[M].北京:中国农业大学出版社,2000.
[2]罗建勋,殷宏,刘光远,等.牛的巴贝斯虫18S rRNA基因序列比较研究[J].畜牧兽医学报,2005,36(9):906-911.
[3]白启,刘光远,韩根凤,等.在我国新发现的一种牛的泰勒虫(Theilria)未定种[J].中国兽医学报,1995,15(1):16-20.
[4]SAUER J R,MCSWAIN J L,BOWMAN A S,et al.Tick salivary gland physiology[J].Annu Rev Entoml,1995,40:245-267.
[5]王修文,林桌臣,危粹凡.贵州牛的原虫初步调查与研究[J].贵州畜牧兽医科技,1984(3):35-40.
[6]罗建勋,殷宏,刘光远,等.我国牛羊梨形虫病病原的收集与鉴定[J].中国寄生虫学与寄生虫病杂志,2006,24(增刊):48-53.
[7]杨茂生,吴位珩,廖梅,等.牛梨形虫病的诊断与防治[J].中国兽医寄生虫病,2008,16(2):48-49.
[8]MARTIN-SANCHEZ J,VISERAS J,ADROHER F J,et al.Nested polymerase chain reaction for detection of Theileria annulata and comparison with conventional diagnostic techniques:its use in epidemiology studies[J].Parasitology Research,1999,85(3):243-245.
[9]ALL SOPP M T,CAVALIER SMITH T,DE WAAL D T,et al.Phylogeny and evolution of the piroplasms[J].Parasitol,1994,108:147-152.
[10]REDDY G R,CHAKRABARTI D,YOW ELL C A,et al.Sequence micro hetero geneity of the three small subunit ribosomal RNA genes of Babesia bigemina:expression in erythrocyte culture[J].Nucleic Acids Res,1991,19(13):3 641-3 645.
