从《粗盐的提纯》教学谈新课程下初高中衔接教学的处理技巧
2012-10-09曾钢
曾 钢
(湖北省潜江市江汉教育集团广华中学 湖北 潜江 433124)
学生升入高中后,感觉化学比初中难度大,内容多,一部分学生经过一段时期的高中学习后,常会落在后面,甚至对高中化学心生恐惧。这就要求我们要熟练地把握学生已有的化学知识,并以此为基础衍生至高中化学的基本要求,稳扎稳打。化学是一门以实验为基础的学科,现行的高中化学人教版更是将实验作为必修一第一章的第一节,实际教学中发现以初中学生非常熟悉的提纯实验为切入点可以渗透高中的实验要点,又能使学生循序渐进,充分感受到学习探究的乐趣。作者在初中高中均参与过教学,发现在教学中如果注意联系学生的已知实施教学,学生印象深刻,理解迅速。
学生在初中时就对粗盐提纯实验印象深刻,分为三步:溶解,过滤,蒸发。上了高中知道粗盐中除了不溶于水的杂质之外还有易溶于水的杂质,人教版必修一P7中指出:经过溶解,过滤和蒸发操作得到的盐中仍然含有可溶性杂质,包括硫酸盐、MgCl2、CaCl2等。那么这些可溶于水的杂质究竟如何除去呢?在这里为了和学生已有的知识更好的挂钩,因为讲到这里时离子反应方程式还没有讲到,如果从离子的角度去讲,一般的学生难以接受,那么就做这样的修改:杂质是氯化镁、氯化钙、硫酸钠,这里我将书上所说的可溶性杂质硫酸盐改为硫酸钠,这样将物质具体化,回避了从离子角度考虑除杂的思路,降低了难度,学生会觉得比较亲切,易于接受。学生自然容易想到的是用适量的氢氧化钠除去氯化镁,适量的碳酸钠除去氯化钙,适量的氯化钡除去硫酸钠,所涉及的方程式如下:
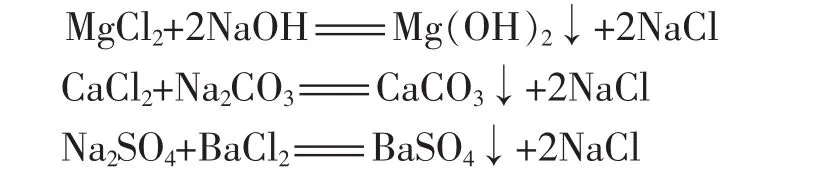
这样从方程式就可以看出,三种杂质完全除去,生成的全是氯化钠,没有引入新的杂质。其操作步骤是:溶解,加入适量的氢氧化钠溶液,加入适量的碳酸钠溶液,加入适量的氯化钡溶液,过滤,蒸发,得到精盐。此时可以询问实验操作的顺序是否还有其他可能,当然由于是适量的试剂,不存在先加的试剂还要后来的试剂除去的问题,所以所加的沉淀试剂可以任意组合。
此时进一步提出在实际的实验操作中,加入适量的沉淀试剂根本无法做到,一般都要加入过量的沉淀试剂以保证某可溶性杂质沉淀完全,这就有了新的问题:加入的过量沉淀试剂引入了新的杂质怎么办?再提出新的方案:溶解,加入过量的氯化钡溶液,加入过量的碳酸钠溶液,加入过量的氢氧化钠溶液,过滤,加入适量盐酸,再讨论实验的顺序是否可以有其他的排法,还可以采取两种方法:溶解,加入过量的氯化钡溶液,加入过量的氢氧化钠溶液,加入过量的碳酸钠溶液,过滤,加入适量盐酸;溶解,加入过量的氢氧化钠溶液,加入过量的氯化钡溶液,加入过量的碳酸钠溶液,过滤,加入适量盐酸。在这里我们可以询问学生如何判定某种物质沉淀完全,注意语言叙述的严谨性和简洁性。这也是高考的基本要求。我们所见到的很多资料都到这个地方就停下了,其实为了和初中的知识对应起来,再讨论一下为什么盐酸可以加入“适量”?可以解释为加入盐酸是为了除去过量的碳酸钠和氢氧化钠,我们可以通过测定pH值的方法,当pH值等于7时说明盐酸将氢氧化钠和碳酸钠恰好完全反应,会有一个判断适量的方法,而前面判断沉淀是否完全时则需要继续滴加沉淀试剂若无沉淀产生时才能说明沉淀过量,势必会加入过量的沉淀试剂。
很多资料在设计实验时加完适量的盐酸后,操作就结束了,实际上此时得到的是氯化钠溶液,如果要和初中的粗盐提纯实验对应起来,再增加一步蒸发,这样得到精盐的固体。即操作步骤为:溶解,加入过量的氯化钡溶液,加入过量的碳酸钠溶液,加入过量的氢氧化钠溶液,过滤,加入适量盐酸,蒸发。
可以看出这样的教学设计是实现了实验设计的三级跳,一步步地接近更好的方法,在这个过程中,学生体会了探究的乐趣,自己参与设计实验的乐趣,不断进取获得成功的乐趣,学生自然而然也就乐在其中,接受起来也就容易得多了。
讲完之后可以以下面的这个题目为例看学生掌握的程度:
KNO3固体中混有 K2SO4、MgSO4,为制得纯净的KNO3溶液,现有如下实验方案。请问答下列问题:

(1)实验操作①的名称_______。E溶液中的溶质为________。
(2)操作②~④加入的试剂顺序可以为:_________________________________。
(3)如何判断 SO2-4已尽?_______________________________________________。
(4)实验过程中产生的多次沉淀_______(选填:需要、不需要)多次过滤,其理由是________________。
(5)该同学的实验设计方案是否严密,说明理由____________________________。
经过这道例题的训练,既可以检查学生的掌握程度,又能训练学生的迁移思维和严密的逻辑思维,在做题中学生进步了。
其实在实验方法的教学中,究其理,抓其根,才能让学生深刻领会内在的精髓,类似的例子比如讲萃取时,书上所讲向碘水中加入四氯化碳形成下层碘的四氯化碳溶液,上层是水层,经过分液后得到碘的四氯化碳溶液,很多老师讲到这个地方就戛然而止,此处如果再问学生你觉得费这么老大劲将碘的水溶液转变成碘的四氯化碳溶液,其目的何在?可以在问之后给出以下信息:①经实验发现碘从45℃左右即开始升华,到77℃时,碘升华管中已充满浓密的紫色碘蒸气。②1标准大气压下水的沸点100℃,四氯化碳的沸点77℃。同时提醒学生注意观察四氯化碳取的用量和原碘水体积的关系。不难得出其目的一是富集碘二是将碘水转变为碘的四氯化碳溶液,是为了便于更好的分离溶质和溶剂。这样地处理使学生明其所以然,而不会糊里糊涂而失去学习的兴趣和动力。
总之,在教学中要注意学生已有的基础和可能触发的感性认识,使学生感觉知识是一层一层上去的,不是一蹴而就的,很多学生觉得高中化学一个是杂、碎,知识点很多很碎,一个是玄,一会是这样,一会又那样,好像总是抓不住,虚无缥缈,久而久之就产生了对化学的恐惧和厌烦心理,再想学好化学就相当困难了。高中化学与初中化学联系紧密,在教学中如果能够注意循序渐进,在初中化学中寻找高中化学的落脚点,势必事半功倍,取得意想不到的教学效果。
