新型肿瘤标志物用于原发性肝癌诊断的临床研究
2012-10-09张宏叶迎宾李淑敏张志涛李强贺建军李军贾爱红
张宏 叶迎宾 李淑敏 张志涛 李强 贺建军 李军 贾爱红
原发性肝癌(PHC)是全球恶性肿瘤死亡的第三大原因,每年约有60万人死于肝癌。在我国癌症患者中,其中56%的为肝癌,已成为第二恶性肿瘤。普遍认为肝癌的发生是一个包括癌基因激活和抑癌基因失活的多因素、多步骤过程[1]。但关于肝癌的确切病因尚不清楚。在我国主要以病毒性肝炎(HBV、HCV)的慢性持续感染是肝癌发生的主要背景,乙型肝炎相关者占70% ~80%,丙型与丁型肝炎相关者为15% ~20%。约5%的肝癌可能与黄曲霉毒素、饮用水污染、遗传因素等有关[2]。往往当发现肝癌时,已错过最佳的治疗时间,因此当务之急就是要找到一种对肝癌细胞灵敏度和特异性高的标志物(如AFP-L3、GPC3、AFU)。本文通过对肝癌患者的 AFP-L3、GPC3、AFU的检测数据的分析,探讨三者联合检测来诊疗肝癌的效果。
1 资料与方法
1.1 一般资料 选择2010年5月至2011年1月在我院肝病科住院且经病理学(瘤体直径>2 cm)证实的肝癌患者100例(PHC组),男62例,女38例;年龄30~72岁,平均年龄53.2岁。肝硬化患者50例(肝硬化组),男37例,女13例;年龄31~65岁,平均年龄48.7岁。肝癌和肝硬化患者均符合2000年中华医学会传染病与寄生虫病学分会、肝病学分会联合修订的“病毒性肝炎防治方案”中病毒性肝炎诊断标准。正常对照者50例为对照组,男25例,女25例;年龄20~30岁,平均年龄24.5岁。3组一般资料具有均衡性。
1.2 仪器与试剂 仪器为Thermo公司的 MK3酶标仪(简称“酶标仪”);AFP-L3、GPC3、AFU试剂盒均由上海雅吉生物科技有限公司提供。检测AFP的仪器为西安核仪器厂提供的XH—6080十探头全自动智能γ免疫计数器,其试剂盒有北京北方生物技术研究所提供,严格按照说明书操作。
1.3 标本采集 取被检者空腹静脉血5 ml,分离血清,置-20℃冰箱保存备用。
1.4 方法 AFP-L3、GPC3、AFU三者检测均采用ELISA法,严格按照试剂盒说明书操作。用酶标仪检测其OD值,根据标准浓度曲线图,分别计算出其浓度。AFP检测采用放射免疫法,AFP>20μg/L,AFP-L3>10%视为阳性;GPC3检测值 >3.0μg/L视为阳性;AFU检测值>40μg/L视为阳性。
1.5 统计学分析 应用SPSS 11.0统计软件,3组阳性率比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组AFP-L3阳性率比较 PHC组的阳性率明显高于肝硬化组和正常对照组(P<0.01);肝硬化组的阳性率与对照组差异无统计学意义(P >0.05)。见表1。
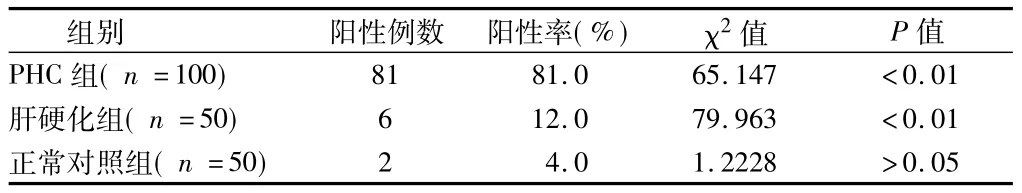
表1 3组AFP-L3阳性率比较
2.2 3组GPC3阳性率比较 PHC组的阳性率明显高于肝硬化组和正常对照组(P<0.01);肝硬化组的阳性率与对照组差异无统计学意义(P>0.05)。见表2。
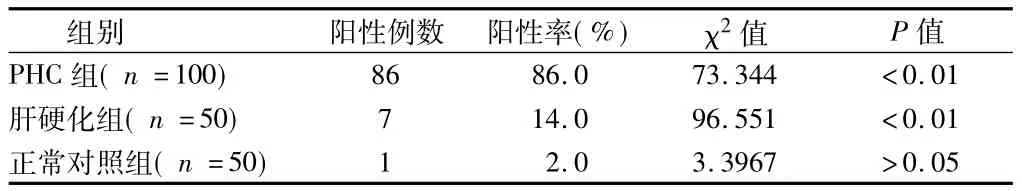
表2 3组GPC3阳性率比较
2.3 3组AFU阳性率比较 PHC组的阳性率明显高于肝硬化组和对照组(P<0.01);肝硬化组的阳性率与正常对照组的差异有统计学意义(P<0.01)。见表3。

表3 3组AFU阳性率比较
2.4 单项或AFP-L3与 GPC3和AFU联合检测3组的结果比较 联合检测中有一项为阳性即为联合检测阳性。三者联合检测时,PCH的敏感度为96.0%(192/200),特异度为76.0%(76/100),准确度为89.3%(268/300),高于任何单项和联合检测的敏感度和准确度。见表4、5。
3 讨论
目前,诊断原发性肝癌的主要血清标志物是AFP,其在各种肝病中均有不同程度的升高[3],是由于肝细胞再生的过程产生一定量的 AFP[4]。由于 AFP 敏感度和特异性不高[5],不能满足临床的需要。
1970年,通过对原发性肝癌患者血清的淀粉凝胶电泳试验,发现AFP电泳移动度不同源于唾液酸含量的不同,因此提出AFP异质体这一概念[6]。1981年有学者报道了LCA结合型AFP在肝癌诊断中的价值,并很快得到了临床资料的验证[7]。Sato等[8]报道,AFP异质体升高的肝硬化患者多数在3~18个月内被诊断为肝癌。Shiraki等[9]对AFP异质体阳性的肝癌患者进行回顾分析后也发现在影像学检查发现肝癌特征性占位性病变前12个月就有41%的患者AFP异质体升高。甲胎蛋白异质体AFP-L3现已列入1999年第四届全国肝癌学术会议上通过的原发性肝癌临床诊断标准的肝癌标记物之一,也已经列入2007年6月卫生部颁布的临床检验项目列表中,临床意义清晰,但是长期以来缺乏能够应用于临床常规使用的方法而无法推广。美国食品药品监督管理局(FDA)2005年批准检测AFP-L3指标用于肝癌预警,并把AFP-L3诊断肝癌的阳性临界值定为10%[10]。2007年6 月,王永忠等[11]报道,AFP-L3 是肝癌鉴别诊断的有用指标,其灵敏度为72.3%,特异性为97.2%。2010年9月,丁贤等[4]报道,表明AFP-L3用于肝癌的诊断不受AFP≥400μg/L作为肝癌诊断标准的限制,当AFP-L3% >10%而AFP轻度升高提示发生肝癌的可能性较大。从表1和表5中联合分析,由于本文收集的肝癌标本其瘤体直径大于2 cm,所以ALP-L3的敏感度、特异度和准确度高于国内其他文献。PHC和肝硬化的鉴别,ALP-L3运用具有明显的优势。

表4 3组联合检测模式患者分布 例

表4 AFP-L3/GPC3/AFU单项或联合检测PHC的诊断效能比较%
GPC3是1996年克隆出来的一种新型基因[12],对生长调控起着重要作用。由于该基因的突变导致了细胞增殖和凋亡失去平衡。Hsu等[13]报道154例肝癌组织中,74.8%检测到GPC3mRNA,而在正常肝和肝炎组织中只有3.2%检测到GPC3基因。2010年7月Bruix等[14]共同指出,小病灶的肝活组织病理学检查不能确认为HCC的组织,应用所有可用标志物之一的磷脂酰肌醇蛋白聚糖3进行染色,以提高诊断准确性。宋孟锜[15]等指出,GPC3在肝癌组织表达高于癌旁和正常肝组织,GPC3与肿瘤大小、肿瘤数目、HBsAg及AFP水平无明显相关,而与病理分级和临床分期有关。因此,提示临床要慎重对待高于正常肝组织的GPC3的检测值,要科学合理地进行检查,防止漏检,进而提高肝癌的诊治率。到目前为止文献多次报道[16-18],本文显示,GPC3作为一项灵敏度和特异性较高的新型指标,为今后诊断早期肝癌走向常规化奠定坚实的基础。
1980年法国学者 Deugnier等[19]研究发现,AFU在诊断肝细胞癌中敏感性好,阳性率高,是AFP阳性率的三倍以上,对AFP阴性病例及小细胞肝癌的诊断价值极大,是早期原发性肝癌诊断的有用指标。AFU的高低与肿瘤的大小无明显的关系,可能有利于小肝癌的诊断。2004年,徐伟等[20]在AFU和AFP联合检测对原发性肝癌的临床意义中表明AFU和AFP在诊断PHC时无相关性,但有较大的互补性。联合检测AFU和AFP则可显著提高PHC阳性检出率。2007年5月,殷建立等[21]提出AFU诊断PHC存在假阳性,与慢性肝病间有重叠现象,AFP和AFU联合检测远高于单项检测。2008年,许勇臣等[22]提出,虽然AFP是原发性肝癌最特异的肿瘤标志物,但灵敏度不如AFU,二者联合用于检测原发性肝癌可相互补充,如果二者检测结果同时为阴性时,该联合检测不能作为排除性诊断的依据。从表5中发现也能证实这一点。
总之,蛋白质组学本身正在迅速发展,同时随着其在肿瘤标志物研究中的广泛应用,新的肿瘤标志物不断被发现。因此要通过试验组织的合作,综合分析大量实验数据,使我们能够发现具有高敏感度和高特异度的肿瘤标志物用于临床。
1 陈洪,王智,吴健.肝癌循环肿瘤细胞的研究现状.临床肝胆病杂志,2011,27:796-800.
2 韩硬海,李树桐主编.临床肝脏病学.第1版.济南:山东科学技术出版社,2004.471.
3 李永利,马洪滨,郭静霞,等.甲胎蛋白异质体L3预警原发性肝癌的研究.中华实验和临床病毒学杂志,2008,22:336-338.
4 丁贤,刘树业,周淑芬,等.甲胎蛋白异质体在鉴别良恶性肝病中的应用价值.天津医药,2010,38:821-822.
5 徐万菊,韩玉刚,张芊,等.甲胎蛋白异质体与高尔基体蛋白73在甲胎蛋白低浓度肝细胞癌诊断中的意义.中华医学检验杂志,2012,35:174-176.
6 CassandraW,Researchers look for“sweet”metho to diagnose cancer.Nature Medicine,2007,13:1267.
7 殷正丰.甲胎蛋白异质体作为肿瘤标志物的临床应用.实用肿瘤杂志,2004,19:1-4.
8 Sato Y,Nakatak T,Kato Y,et al.Early recognition of hepatocellular carcinoma based on altered profilesofalpha-fetoprotein.N Engl Jmed,1993,328:1802-1806.
9 Shiraki S,Takasek W,Tameda Y,et al.A clinical study of lectin-reactive alpha-fetoprotein as a newly indicator of hepatocellular carcinoma in the follow-up of cirrhotic patients.Hepatology,1995,22:802-807.
10 U.S.Food and Drug Administration.Guidance for Industry and FDA Staff.Class ⅡSpecial Controls Guidance Document:AFP-L3%Immunological Test Systems[EB/OL].(2005-10-04)http://www.fda.gov
11 王永忠,吴国祥,陈敏,等.甲胎蛋白异质体检测在肝癌鉴别诊断中的应用.江苏医药,2007,6:565-567.
12 Pilia G,Hughes-Benzie RM,MacKenzie A,et al.Mutations in GPC3,a glypican gene,cause the Simpson-Golabi-Behmel overgrowth syndrome.Nature Genet,1996,12:241-247.
13 Hsu HC,ChengW,Lai PL.Cloning and expression of a developmentally regulated transcriptMXR7 in hepatocellular carcinoma:biological significance and temporospatial distribution.Cancer Res,1997,57:5179-5184.
14 Bruix J,Sherman M.Management of hepatocellular carcinoma:an update.Hepatology,2011,53:1020-1022.
15 宋孟锜,杨永飞,王冬冬等,磷脂酰肌醇蛋白聚糖-3和甲胎蛋白联合检测对原发性肝癌的诊断价值.临床肝胆病杂志,2011,27:391-393.
16 付顺军,李绍强,林杰,等.血清磷脂酰肌醇蛋白聚糖3蛋白测定在肝细胞癌诊断中的价值.中华普通外科学文献(电子版),2010,12:553-554.
17 王涛,王凤梅,高英堂,等.磷脂酰肌醇蛋白聚糖3在肝穿刺活检标本中鉴别诊断的意义.世界华人消化杂志,2011,19:693-699.
18 刘斐烨,苏宁,梁继珍,等.Glypican-3蛋白在肝癌患者血清中的表达及意义.山东医药,2010,50:55-56.
19 Deugnier Y,Letreat A,Glaise D,et al.A study of lysosomal enzyme activities in serum and leakocytesion chronic hepatic disease.Clin Chim Acta,1980,128:385.
20 徐伟,魏丽晶,王美霞.联合检测血清α-L-岩藻糖苷酶、甲胎蛋白对原发性肝癌患者的临床意义.临床肝胆杂志,2004,2:42-43.
21 殷建立,周秦蜀,段仲璧,等.α-L-岩藻糖苷酶与甲胎蛋白联合检测对原发性肝癌诊断的临床评价.肝胆外科杂志,2007,5:177-178.
22 许勇臣,陶玉滨,杨春生.血清甲胎蛋白、α-L-岩藻糖苷酶联合检测对原发性肝癌的诊断价值.实用预防医学,2009,16:1591-1592.
