脂肪族聚酯接枝聚多糖仿生材料研究进展
2012-10-08周开文宋继胜
周开文,宋继胜
(浙江和勤通信工程有限公司,浙江金华,321017)
0 引言
良好生物相容性、可降解吸收材料是组织工程材料的重要发展方向,其中材料的功能是为细胞的增殖提供三维空间和新陈代谢的环境[1],并决定新生组织、器官的形状和大小。为获得理想的材料,人们提出各种材料的设计策略,其一便是按照生物模拟或仿生的方法来设计[2],如利用体内可降解代谢的天然多糖改性脂肪族聚酯[3]。多糖(Polysaccharides),又称聚多糖,是由醛糖或酮糖通过糖苷键连接而成的链状化合物[4],种类繁多,广泛存在于植物、动物、海藻、微生物等有机体中,如葡聚糖、壳聚糖、纤维素、海藻酸和果胶等。具有来源丰富、可再生、良好生物相容性、无免疫原性,允许特定的粘膜粘附和受体识别[5],参与细胞的各种生命活动的条件,如免疫细胞间信息的船体和感受等优点;此外其分子链上存在众多活泼基团,便于修饰制备功能性结构仿生材料[6]。然而由于多糖大分子链上大量羟基的存在,使得分之内以及分子间容易形成很强的氢键,导致多糖的成型加工性能很差。为实现多糖作为生物材料在组织工程材料的应用必须对其进行改性,而多糖与脂肪族聚酯接枝改性是一种行之有效的方法。脂肪族聚酯包括:聚交酯,如聚丙交酯、聚乙交酯等;聚内酯,如聚(ε-己内酯)、聚(δ-戊内酯);聚碳酸酯,如聚(三亚甲基碳酸酯);聚羟基烷酸酯,如聚(β-羟基丁酸)等。由于脂肪族聚酯具有良好的生物相容性、可生物降解性,因此利用多糖与脂肪族聚酯接枝改性,制备完全可生物降解的生物医用高分子材料成为研究的热点,在药物控制释放、组织工程支架材料、基因转染载体材料等方面进行了深入的研究[7],本文就其接枝改性主要采用直接开环接枝聚合和端基偶联两种方法进行了研究。
1 开环接枝聚合
聚多糖分子链上带有众多活性基团,如羟基、氨基、乙酰氨等,可以在催化剂下,直接引发脂肪族聚酯单体(丙交酯、乙交酯、己内酯等)开环接枝聚合。反应所使用的催化剂主要有以下3类:Lewis酸催化剂,如辛酸亚锡[Stannous octotate,Sn(Oct)2]、钛酸丁酯[Ti(OBu)4]、二月桂酸二丁基锡等;烷氧基金属化合物,如三异丙醇铝等[Alumium isoproxide,Al(OiPr)3];烷基金属化合物,如三乙基铝(Triethyl aluminum,AlEt3)等。其中辛酸亚锡是最常用的催化剂之一。开环接枝反应可以在无溶剂条件下进行本体聚合,也可以在水相[8]或其它有机溶剂如四氢呋喃[9]、二甲基亚砜、甲苯等中进行。该方法具有反应条件简单、操作方便、可规模化生产等优点,然而直接开环接枝聚合法也具有接枝率较低、支链分子量不可控等缺点。
Wang[10]以辛酸亚锡[Sn(Oct)2]为催化剂,将三甲基硅烷羟丙基纤维素(Trimethylsilyl hydroxypropyl cellulose,TMS-HPC)和己内酯单体(Caprolactone,CL)在二甲苯中,于120℃、N2保护下直接开环接枝聚合,制备了含聚己内酯侧链的两亲性羟丙基纤维素衍生物,如图1所示。
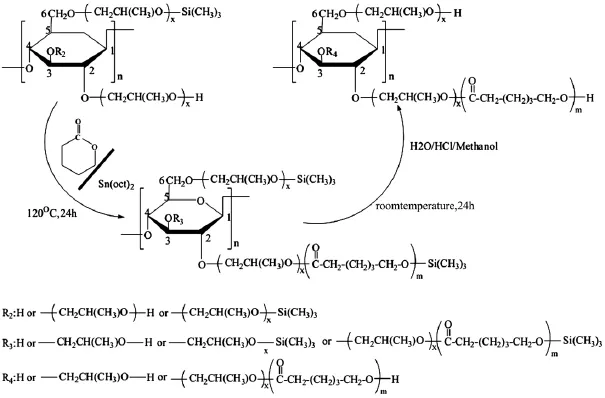
图1 羟丙基纤维素衍生物合成路线图
以三乙胺(Trietylamine)为催化剂,将水溶性壳聚糖(Chitosan,CS)和丙交酯单体(DL-Lactide,LA)在二甲基亚砜溶液中,于80℃、高真空下直接开环接枝聚合,制备了含聚乳酸侧链的壳聚糖衍生物[11],如图2 所示。
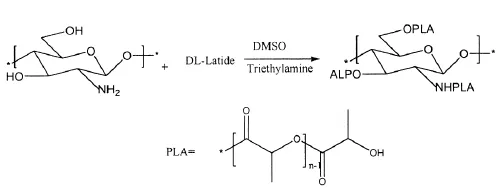
图2 含聚乳酸侧链的壳聚糖衍生物合成路线图
在不加入催化剂的条件下,将羟丙基纤维素(Hydroxypropyl cellulose,HPC)和己内酯单体(ε-Caprolactone,CL),于150℃、N2保护下,采用本体开环接枝共聚,制备了羟丙基纤维素接枝聚己内酯(HPC- PCL)共聚物[12]。
在以氯化锂(LiCl)或辛酸亚锡[Sn(Oct)2]为催化剂,将乙基纤维素(Hydroxyethyl cellulose,HEC)和左旋丙交酯单体(L-lactide),在128℃,N,N-二甲基乙酰胺溶液中,开环接枝共聚,制备了羟乙基纤维素接枝聚乳酸(HEC-PLA)共聚物[13]。
以辛酸亚锡[Stannous Octotate,Sn(Oct)2]为催化剂,将三甲基硅烷葡聚糖(Trimethylsilyl dextran,TMSD)和左旋丙交酯单体(L-lactide),于140℃、真空下采用本体开环聚合,制备了含聚乳酸链段两亲性葡聚糖衍生物[14]。
2 端基偶联
可生物降解脂肪族聚酯虽然具有良好的生物相容性和可生物降解性,然而其高分子链缺乏可反应性基团,致使其进一步化学改性受到限制,也限制了其应用范围,采用脂肪族聚酯单体(丙交酯、乙交酯、己内酯等)在催化剂作用下与共引发剂,如小分子醇、氨基酸、胆固醇等,可制备出带有羟基、羧基、异氰酸酯基等反应性官能团的脂肪族聚酯齐聚物,通过端基偶联法接枝到聚多糖主链上,得到含脂肪族聚酯侧链的两亲性聚多糖衍生物。该方法较直接开环接枝共聚法,具有支链分子量可调控、接枝率比较高、结构规整等优点,然而在合成过程中需要使用大量有机溶剂且步骤繁琐。按照端基偶联时采用的不同端基,可以分为以下3条路线:
2.1 与含羟基的脂肪族聚酯的偶联反应
采用乙醇作为引发剂,制备了具有端羟基的聚乳酸;利用羰基二咪唑(Carobonyldiimidazole,CDI)活化羟基,再以4-二甲氨基吡啶[4-(N,N-dimethyl-lamino)pyridine,DMAP]为催化剂,将其接枝到葡聚糖主链,得到葡聚糖接枝聚乳酸共聚物(Dex-g-PLA)[15],如图3所示。
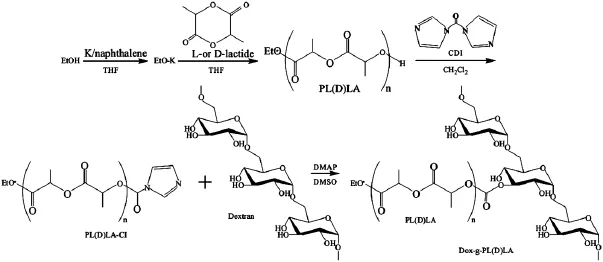
图3 葡聚糖接枝聚乳酸合成路线图
2.2 与含有羧基的脂肪族聚酯的偶联反应
以癸酸为引发剂,不加催化剂,于230℃、高真空通氩气的条件下,引发己内酯开环聚合,首先制备了具有端羧基的聚己内酯高分子链,然后再与羰基二咪唑(CDI)在四氢呋喃溶液中反应得到具有活化酯端基的聚己内酯,最后在二甲基亚砜溶液中和葡聚糖(Dextran)反应,制备了葡聚糖接枝聚乳酸共聚物(Dex-PCL)[16],如 图4 所示。
2.3 与含有异氰酸酯基的脂肪族聚酯的偶联反应
采用端羟基的聚左旋乳酸(PLLA)和二苯基甲烷二异氰酸酯 (4,4-diphenylmethane diisocyanate,MDI)在二甲基甲酰胺(DMF)溶液中,于60℃下反应2 h,得到一端带有异氰酸酯基的聚乳酸大分子(PLLA-NCO),然后与壳聚糖(CS)和二月桂酸二丁基锡[Tin(Ⅱ)Dibutyl Dilaurate,DBTL]在DMF中在氮气保护下于80℃下反应4 h,得到壳聚糖接枝聚乳酸共聚物(CS-g-PLLA),该共聚物可以在三氯甲烷、四氢呋喃、二甲基甲酰胺等有机溶剂中溶解,并能在水溶液中自组装形成14.8-65.1 nm的胶束[17]。如图5所示。
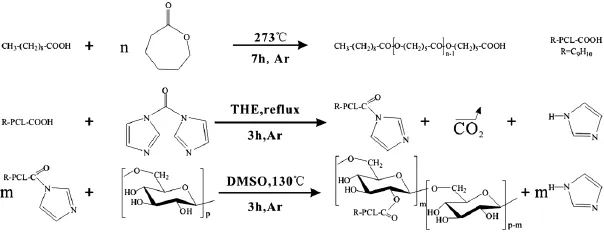
图4 葡聚糖接枝聚己内酯合成路线图
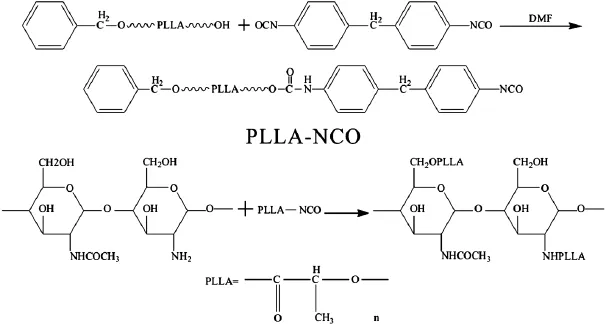
图5 CS-g-PLLA合成路线图
3 结束语
随着材料科学和生命科学的不断发展和相互渗透,生物可降解材料在医学领域的应用越来越广泛。依据生物仿生设计的脂肪族聚酯接枝聚多糖材料,生物可降解型医用材料,由于其优异的性能必将在组织工程和药物释放等领域中得到广泛应用。
[1]Sun F F,Zhou H J,Lee J.Various preparation methods of highly porous hydroxyapatite/polymer nanoscale biocomposites for bone regeneration[J].Acta Biomaterialia,2011,7(1):3 813–3 828.
[2]Sanchez C,Arribart H,Guille M,et al.Biomimetism and bioinspiration as tools for the design of innovative materials and systems[J].Nature Materials,2005,4(4):277 -288.
[3]李勇刚,王远亮,付春华,等.聚乳酸接枝多糖类生物仿生材料的研究进展[J].高分子材料科学与工程,2008,24(6):9-17.
[4]张翼伸.怎样研究植物多糖[J].生命的化学,1999,19(6):296-297.
[5]Lee J W,park J H,Robinson J R.Bioadhesive-based dosage forms:the next generation[J].Journal of Pharmaceutical Science,2000,89(4):750-866.
[6]Lu X S,Weng L H,Zhang L N.Morphology and properties of soy protein isolate thermoplastics reinforced with chitin whiskers[J].Biomacromolecules,2004,(5):1 046 -1 051.
[7]Amass W,Amass A,Tihge B.A review of biodegradable polymers:uses,current developments in the synthesis and characterization of biodegradable polyesters,blends of biodegradable polymers and recent advances in biodegradation studies[J].Polymer International,1998,47(2):89 -144.
[8]Choi E J,Kim C H,Park J K.Synthesis and characterization of starch-g-polycaprolactone copolymer[J].Macromolecules,1999,32(22):7 402 -7 408.
[9]Chen L,Qiu X Y,Deng M X,et al.The starch grafted poly(L - lactide)and the phusical properties of its blending composites[J].Polymer,2005,46(15):5 723 -5 729.
[10]Wang C Q,Tan H M,Dong Y P,et al.Trimethylsilyl hydroxypropyl cellulose:Preparation,properties and as precursors to graft copolymerization of ε - caprolactone[J].Reactive and Functional Polymers,2006,66(10):1 165 –1 173.
[11]Wu Y,Zheng Y L,Yang W L,et al.Synthesis and characterization of a novel amphiphilic chitosan–polylactide graft copolymer[J].Carbohydrate Polymers,2005,59(2):165 –171.
[12]Shi R W,Burt H M.Synthesis and characterization of amphiphilic hydroxypropylcellulese-graft-poly(ε-capro-lactone)[J].Journal of Applied Polymer Science,2003,89(3):718-727.
[13]Chen D P,Sun B Q.New tissue engineering material copolymers of derivatives of cellulose and lactide:their synthesis and characterization[J].Materials Science and Engineering C,2000,11(4):57-60.
[14]Cai Q,Wan Y Q,Wang S G.Synthesis and characterization of biodegradable polylactide-grafted dextran and its application as compatilizer[J].Biomaterials,2003,24(20):3 555 -3 562.
[15]Nagahama K,Mori Y S,Ohya Y C,et al.Biodegradable nanogel formation of polylactide-grafted dextran copolymer in dilute aqueous solution and enhancement of its stability by stereocomplexation[J].Biomacromolecules,2007,8(7):2 135-2 141.
[16]Gref R,Rodrigues J,Couvreur P.Polysaccharides grafted with polyesters:novel amphiphilic copolymers for biomedical applications[J].Macromolecules,2002,35(7):9 861 -9 867.
[17]Feng H,Dong C M.Preparation,characterization,and self-assembled properties of biodegradable chitosan-poly(L-lactide)hybrid amphiphiles[J].Biomacromolecules,2006,7(11):3 069 -3 075.
