低白蛋白血症,胸腔积液与重症急性胰腺炎死亡危险因素的相关性
2012-09-28梁晖艾新波潘文胜
梁晖 艾新波 潘文胜
重症急性胰腺炎(severe acute pancreatitis,SAP)是一种发病快,进展迅速,病死率较高的内科疾病,一项多中心临床研究的数据表明中国SAP患者病死率为11.8%[1]。李小彦等[2]回顾性分析186例SAP患者,多脏器功能衰竭相关性病死率为49.0%。对比分析暨南大学附属珠海医院和浙江大学医学院附属第二医院100例SAP患者,两所医院根据中华医学会消化病学分会胰腺病学组,中华医学会消化病学分会胰腺病学组诊治共识意见,进行规范化诊治。对于SAP内科治愈标准定义:①感染控制;②坏死物的良好吸收;③无需外科手术干预。SAP外科治愈标准定义:①感染控制;②坏死物的良好吸收[3]。本文研究目的在于识别SAP患者死亡高危因素,便于临床医师评估其预后。
1 资料与方法
1.1 一般资料
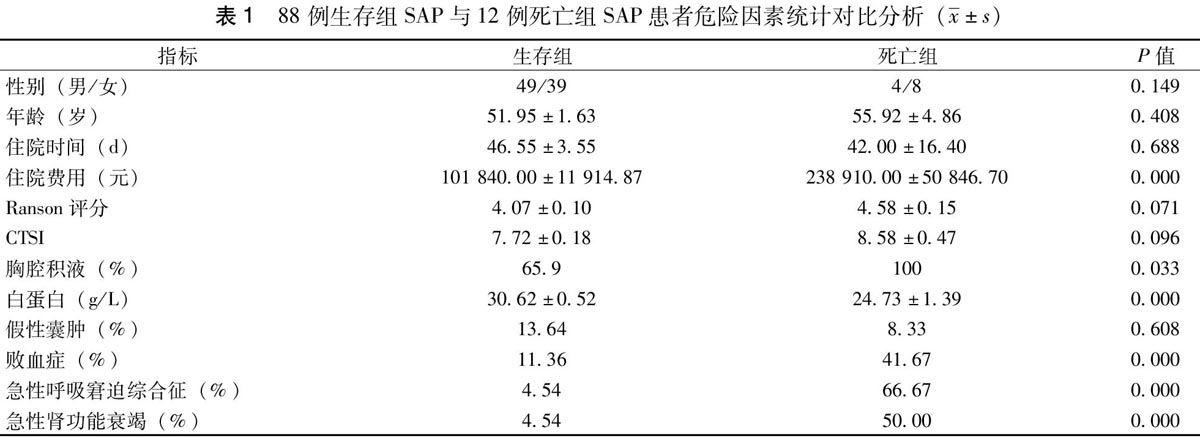
生存组SAP患者88例,男性49例,女性33例,年龄(51.95±1.63)岁,住院时间(46.55±3.55)d,住院费用(101 840.00±11 914.87)元,Ranson评分(4.07±0.10),CTSI(7.72±0.18),血清白蛋白水平(30.62±0.52)g/L,胸腔积液发病率65.9%,假性囊肿发病率13.64%,败血症发病率11.36%,ARDS发病率4.54%,急性肾功能衰竭发病率4.54%。死亡组SAP患者12例,男性4例,女性8例,年龄(55.92±4.86)岁,住院时间(42.00±16.40)d,住院费用(238 910.00±50 846.70)元,Ranson评分(4.58±0.15),CTSI(8.58±0.47),血清白蛋白水平(24.73±1.39)g/L,胸腔积液发病率100%,假性囊肿发病率8.33%,败血症发病率41.67%,ARDS发病率66.67%,急性肾功能衰竭发病率50.00%。100例SAP患者,其发病原因:胆源性42例,酒精性30例,高脂血症性21例,内镜逆行性胰胆管造影术(ERCP)后2例,病因不明者5例。
1.2 诊断标准
中华医学会消化病学分会胰腺病学组专家关于SAP的内科规范治疗建议[4],SAP的诊断至少应该满足以下3项中的2项:①上腹痛、血清淀粉酶水平升高3倍以上;②计算机断层成像(CT)或磁共振(MR)有急性胰腺炎的变化,同时有胰周广泛渗出和(或)胰腺坏死、和(或)胰腺脓肿等改变;③器官功能衰竭。
1.3 住院诊治
SAP患者72 h内均安排胰腺增强CT检查,心电监护,监测心、肝、腎、肺、脑等重要脏器有无并发症,禁食,胃肠减压,补液,纠正水、电解质、酸碱失衡,营养支持,抑制胰酶分泌,制酸,抗炎等内科保守治疗。若出现以下并发症者则行外科手术治疗:①胰腺坏死范围呈进行性扩大,并发腹腔间隔室综合征(ACS);②胰腺脓肿,内科引流无效;③胰腺假性囊肿,内科引流无效;④胆道梗阻,ERCP内镜取石失败[5]。本研究22例SAP患者符合上述外科手术适应证,行外科手术。
1.4 危险因素分析
生存组88例SAP患者,死亡组12例SAP患者,针对以下指标分析:性别,年龄,住院天数,住院费用,Ranson评分,CTSI,胸腔积液,血清白蛋白,胰腺假性囊肿发生率,急性肾功能衰竭,败血症,ARDS。
1.5 统计学方法
本研究采用SPSS 16.0软件分析,计量资料采用成组t检验,One-Way ANOVA,计数资料采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
100例SAP患者,12例死亡,病死率为12%。死亡组SAP患者血清白蛋白水平(24.73±1.39),生存组SAP患者血清白蛋白水平(30.62±0.52),P=0.000,死亡组10例SAP患者血清白蛋白≤30 g/L(10/12),生存组38例SAP患者血清白蛋白≤30 g/L(58/88),两组差异具有统计学意义(P=0.000)。死亡组胸腔积液发病率100%(12/12),生存组胸腔积液发病率(58/88)65.9%,前者明显高于后者,差异具有统计学意义(P=0.033)。死亡组与生存组SAP患者住院费用差异具有统计学意义(P=0.000),死亡组SAP患者败血症发病率41.67%(5/12),生存组SAP患者败血症发病率11.36%(10/88),前者明显高于后者(P=0.000)。死亡组SAP患者急性肾功能衰竭发病率50.00%(6/12),生存组SAP患者急性肾功能衰竭发病率4.54%(4/88),前者明显高于后者(P=0.000)。死亡组SAP患者ARDS发病率66.67%(8/12),生存组SAP患者ARDS发病率4.54%(4/88),前者明显高于后者(P=0.000),见表1。
3 讨论
SAP起病快,发展迅速,早期极易出现多脏器功能衰竭(MODS)并发症,病死率较高,本研究组报道其病死率为12%,与国内外学者报道一致。目前国内学者多采用Ranson评分,APACH-Ⅱ评分、C-反应蛋白(CRP)和CTSI,血钙评估SAP患者预后。胸腔积液,入院24 h血清白蛋白水平预测SAP预后的研究成为国内外学者研究热点。
卢秀英等[6]报道,发生胸腔积液的患者Ranson评分,血淀粉酶水平明显高于无胸腔积液患者,预测胸腔积液为入院48 h内CT检查,能早期反应病情,可作为确定SAP的一个参考因素。项和平等[7]研究报道AP患者入院时胸腔积液的发生可作为一项有用的、经济的、简单的指标,预测病情严重程度及预后。Heller等[8]研究表明,影像学发现胸腔积液对于SAP诊断的敏感性达84.2%,特异性达91.4%。关于胸腔积液与急性胰腺炎严重程度之间的发病机理,目前尚不明确,但胸腔积液的早期出现提示SAP的可能[9]。本组研究表明,死亡组胸腔积液并发症发生率为100%(12/12),生存组则为65.9%(58/88),两组差异具有统计学意义P<0.05),胸腔积液的发生可能与SAP早期炎症介质的释放,导致胸膜微血管通透性增加有关,尚有待进一步临床研究。
炎症介质的大量释放,诱发全身炎症反应综合征(SIRS),ARDS,亦导致蛋白合成受到抑制,住院后24 h低白蛋白血症(白蛋白<30 g/L),患者病死率明显增加,该学者推测低白蛋白血症是住院SAP患者死亡的严重危险因素[10]。炎症介质的“瀑布级联”反应或者SIRS导致内毒素水平的急剧升高,诱发败血症,ARDS,由于机体处于高分解代谢状态,血清白蛋白水平显著较低[11]。关于SAP死亡危险因素研究,血清CRP≥170 mg/L,OR值为7.074;血清白蛋白≤30 g/L,其OR值为7.224,推测低白蛋白血症较CRP水平更能预测住院SAP患者病死率[12]。本研究发现,在CTSI,Ranson评分无统计学差异的条件下,生存组血清白蛋白水平(30.62±0.52),死亡组血清白蛋白水平(24.73±1.39),两组差异具有统计学意义(P<0.05),死亡组10例SAP患者血清白蛋白≤30 g/L(10/12),生存组38例SAP患者血清白蛋白≤30 g/L(38/88),两组差异具有统计学意义(P<0.05)。其中,2例低白蛋白血症SAP患者,入院24 h行胰腺坏死组织清创联合引流急诊手术,术后出现肠瘘,研究表明,低白蛋白血症极易并发术后肠瘘并发症的发生,纠正白蛋白水平至关重要。另外,低白蛋白血症导致血浆渗透压减低,诱发胸腔积液的发生。低白蛋白血症联合胸腔积液成为SAP患者死亡的协同危险因素。
本研究提示看,住院后24 h血清白蛋白测定,胸腔积液的出现预测SAP预后意义重大。若血清白蛋白<30 g/L,CT或胸部正侧位片提示胸腔积液,则患者住院费用、败血症、急性肾功能衰竭、ARDS发生率、住院病死率等均会增加。
参考文献
[1]Bai Y, Liu Y, Jia L, et al. Severe acute pancreatitis in China: etiology and mortality on 1976 patients[J]. Pancreas, 2007, 35(3): 232-237.
[2] 李小彦,王小波,李贺,等. 重症急性胰腺炎患者器官功能衰竭的患病率及其危险因素分析[J]. 中华急诊医学杂志, 2011, 20(2):156-159.
[3] Freeny PC, Hauptmann E, Althaus, SJ, et al. Percutaneous CT-guided catheter drainage of infected acute necrotizing pancreatitis: techniques and results[J]. Am J Roentgenol, 1998, 170(4):969-975.
[4] 中华医学会消化病学分会胰腺病学组. 重症急性胰腺炎内科规范治疗建议[J].中华消化杂志,2009, 29(2):75-78.
[5] 中华医学会外科学分会胰腺外科学组. 重症急性胰腺炎诊治指南[J].中华外科杂志 ,2007,45(11):727-729.
[6] 卢秀英,刘俊,丁霞,等. 急性胰腺炎胸腔积液与病情严重程度关系分析[J].中华胰腺病杂志,2009, 9(5):309-311.
[7] 项和平,李贺,张长乐. C反应蛋白和胸腔积液在急性胰腺炎早期预后评估中的价值[J].中华急诊医学杂志,2011, 20(8):820-823.
[8] Heller SJ, Noordhoek E, Tenner SM, et al. Pleural effusion as a predictor of severity in acute pancreatitis[J]. Pancreas, 1997, 15(3): 222-225.
[9] Maringhini A, Ciambra M, Patti R, et al. Ascites, pleural, and pericardial effusions in acute pancreatitis. A prospective study of incidence, natural history, and prognostic role[J]. Dig Dis Sci, 1996, 41(5): 848-852.
[10]Lee BJ, Kim CD, Jung SW, et al. Analysis of the factors that affect the mortality rate in severe acute pancreatitis[J]. Korean J Gastroenterol, 2008, 51(1): 25-33.
[11] Wang X, Cui Z, Li H, et al. Nosocomial mortality and early prediction of patients with severe acute pancreatitis[J]. J Gastroenterol Hepatol, 2010, 25(8): 1386-1393.
[12] 王心,崔云峰,苗彬,等. 重癥急性胰腺炎患者住院死亡因素的早期评估[J].中华急诊医学杂志,2009, 18(11):1146-1150.
(收稿日期:2012-01-08)
(本文编辑:何小军)
DOI:10.3760/cma.j.issn.1671-0282.2012.08.025
基金项目:国家公益性行业基金(200802112);浙江省自然科学基金项目(Y2080001, Y12H160121),浙江省中医药管理局基金(2007ZA019)
作者单位:,广东省珠海,暨南大学附属珠海医院普外科(梁晖),消化内科(艾新波);浙江大学医学院附属第二医院消化内科(潘文胜)
通信作者:潘文胜,Email:wspan223@yahoo.com
中华急诊医学杂志2012年8月第21卷第8期Chin J Emerg Med,August 2012,Vol.21,No.8
P902-904
