甘肃省马铃薯炭疽病的鉴定及室内药剂筛选
2012-09-28杨成德姜红霞陈秀蓉蒲崇建滕学琴孟向荣
杨成德, 姜红霞, 陈秀蓉*, 薛 莉, 蒲崇建, 滕学琴, 孟向荣
(1.甘肃农业大学草业学院 草业生态系统教育部重点实验室 甘肃省草业工程实验室中-美草地畜牧业可持续发展研究中心,兰州 730070;2.甘肃农业大学农学院,兰州 730070;3.甘肃省植保植检站,兰州 730020)
马铃薯(Solanum tuberosumLinn.)属茄科作物,主要作粮食、蔬菜和饲料。据联合国粮农组织(FAO)统计,全世界所有粮食作物中,马铃薯总产量排名第四。甘肃省87个县(市、区)中有60个县种植马铃薯,甘肃定西有着“马铃薯之乡”之称,马铃薯是当地农民的主要经济来源,也是该地区发展经济的支柱产业之一。马铃薯炭疽病(black dot disease)广泛分布于英国、意大利、加拿大和美国等50多个国家和地区[1],可以发生在马铃薯的各个生长部位,如地下部分(子块茎、匍匐枝、根)、茎基部及叶部[2];该病菌侵染根部能引起根的腐烂,侵染维管束造成萎蔫,严重时引起皱缩和枯萎,与黄萎病(Verticillium dahliae Kleb.)等复合侵染时可引起马铃薯的早 衰 病 (potato early dying,PED)[3];据 Tsror等[4]报道,在1994-1996年所试验的5个马铃薯品种中,该病害使马铃薯减产22%~30%,但不同年份的影响有差异,且接种病原菌后对马铃薯块茎品质的影响也不同。马铃薯炭疽病由半知菌亚门炭疽菌属的球炭疽菌[Colletotrichum coccodes(Wallr.)Hughes]引起[5],该病菌抗逆能力强,存活时间长,能以小菌核的形式在块茎表面和内部长期存活,还可存活于其他营养体上[6]。据2010年和2011年调查,马铃薯炭疽病在甘肃省定西市安定区、渭源县、陇南市武都区和武威市天祝县等地发生较重,重病田病株率在30%以上,导致植株早枯,且贮藏期引起烂窖,严重影响马铃薯的产量和品质,已成为马铃薯的主要病害之一。马铃薯炭疽病在国内以前作为检疫对象,在生长期及贮藏期的研究资料较少。因此,本试验通过在甘肃省不同马铃薯种植区采集标样,进行症状观察和通过形态学特征及ITS序列分析鉴定了病原,并进行了室内毒力测定,以期为该病害的识别和防控提供依据。
1 材料和方法
1.1 供试材料
供试标本:采集于定西市安定区、陇南市武都区和武威市天祝县马铃薯病田及马铃薯贮藏库。
供试仪器:水平凝胶电泳装置(Bioneer公司);MyGenie32Thermal Block PCR热循环仪(Bioneer公司);凝胶成像系统 Uvitec A-6030(Bioneer公司);高速冷冻离心机(Biometra公司)等。
供试生化试剂:蛋白酶K、溶菌酶、DNATaq聚合酶和LD2000Marker购于上海生工生物技术公司;其他试剂均采用国产分析纯。选用通用引物ITS1和ITS4(上海生物工程有限公司合成)为扩增引物,引物序列分别如下,ITS1:TCC GTA GGT GAA CCT GCG C;ITS4:TCC TCC GCT TAT TGA TAT GC。
供试化学农药:70%丙森锌可湿性粉剂(天津市阿格罗帕克农药有限公司);70%代森锰锌可湿性粉剂(天津施普乐农药技术有限公司);68%精甲霜·锰锌水分散粒剂(先正达作物保护有限公司);70%甲基硫菌灵可湿性粉剂(新加坡利农私人有限公司);75%百菌清可湿性粉剂(利民化工有限责任公司);10%苯醚甲环唑水分散粒剂(先正达作物保护有限公司);32.5%苯醚甲环唑·嘧菌酯悬浮剂(先正达作物保护有限公司);30%丙环唑·苯醚甲环唑乳油(先正达作物保护有限公司);1.5%噻霉酮水乳剂(陕西西大华特科技实业有限公司);50%嘧菌酯悬浮剂(英国先正达有限公司);75%肟菌·戊唑醇水分散粒剂(拜耳作物科学公司);50%咪鲜胺锰盐可湿性粉剂(德国先灵农业化学有限公司)。
1.2 试验方法
1.2.1 标本采集和分离
在2009年8月和2010年3月在甘肃省马铃薯主要种植区的马铃薯田间和贮藏库中分别采集不同时期的发病植株和块茎,进行症状描述,后进行常规组织分离培养,将分离获得的真菌镜检,炭疽菌属真菌进行致病性测定。
1.2.2 病原物致病性测定
在健康生长的马铃薯植株茎秆上,用拨针造成微伤,再将菌液喷雾于微伤口处,保湿48h之后置于良好的生长环境中,定期观察接菌马铃薯植株,形成典型症状后进行再分离和鉴定,以接种无菌水为对照。经致病性测定具有致病能力的病原物进行以下试验。
1.2.3 病原菌的鉴定
1.2.3.1 形态学鉴定
将培养10~15d的炭疽病菌或发病部位病原菌制片,光学显微镜(10×40倍)下观察孢子形态、分生孢子盘及刚毛的特征,测定分生孢子、分生孢子盘和刚毛的大小(测定50个),并拍照。根据病原形态特征,参考相关资料[7-8],确定属种。
1.2.3.2 ITS序列鉴定
将病原菌接种于马铃薯葡萄糖液体培养基中,在28℃、150r/min条件下振荡培养5~7d后收集菌丝体,采用上海生物工程有限公司的UNIQ-10柱式真菌基因组DNA抽提试剂盒提取炭疽病菌基因组DNA,取5μL电泳检查提取结果。rDNA-ITS的扩增利用真菌核糖体基因转录间隔区(ITS)通用引物ITS1(TCC GTA GGT GAA CCT GCG C)和ITS4(TCC TCC GCT TAT TGA TAT GC)进行PCR扩增。扩增使用50μL扩增体系,即为:10×PCR Buffer 5.0μL,TaqDNA 聚 合 酶 (2U/μL)1.2μL,ITS1(10mmol/L)2.0μL,ITS4(10mmol/L)2.0μL,dNTP(10mmol/L)3.0μL,DNA 模板(10ng/μL)2.0μL(以加2.0μL ddH2O为阴性对照),ddH2O 34.8μL。扩增程序:94 ℃ 预变性3min,30个循环中,94℃变性30s,52℃退火45s,72℃延伸1min,最后72℃延伸8min。扩增后取5μL扩增产物电泳检查扩增结果,具特异性条带的扩增产物送上海生物工程有限公司测序。所测序列进入 GenBank数据库(www.ncbi.nlm.nih.gov)进行相似性分析,并与GenBank中的相似序列在Clustal(1.81)程序包中进行多重序列匹配排列(multiple alignmemts)分析,形成一个多序列匹配排列阵,其中形成的缺口用横杠“-”填补,用 Mega(4.0)程序包中的Neighbor-Joining法构建系统发育树。
1.2.4 病原菌的室内毒力测定
根据预试验结果,供试杀菌剂的试验浓度分别为肟 菌 · 戊唑醇 90、45、22.5、11.25μg/mL 和5.63μg/mL;噻霉酮24、12、6、3μg/mL和1.5μg/mL;嘧菌酯49.92、24.96、12.48、6.24μg/mL 和3.12μg/mL;丙环唑 · 苯醚甲 环 唑 1.94、1.52、1.164、0.766μg/mL和0.388μg/mL;苯醚甲环唑8、6.4、4.8、3.2μg/mL 和1.6μg/mL;苯醚甲环唑·嘧 菌 酯 4.06、3.25、1.44、1.62μg/mL 和0.81μg/mL;咪鲜胺锰盐8.75、7、5.25、3.5μg/mL和1.75μg/mL;精甲霜·锰锌2 560、1 280、640、320μg/mL和160μg/mL;丙森锌80、56、32、16μg/mL和8μg/mL;代森锰锌80、56、32、16μg/mL和8μg/mL;百菌清80、56、32、16μg/mL和8μg/mL;甲基硫菌灵80、56、32、16μg/mL和8μg/mL。
采用生长速率法测定不同药剂对马铃薯炭疽病菌的抑制率[9]。将供试菌株接种到PDA平板培养基上,置于培养箱内30℃培养5~7d,用打孔器打取直径4mm的菌饼接种于相应浓度的含药PDA平板培养基中央,置于生化培养箱中30℃ 恒温培养,3次重复,以加等量无菌水的平板培养基为对照;4d后每天用十字交叉法测量菌落直径,计算各药剂对马铃薯炭疽病菌的抑制率、毒力回归方程和EC50。

2 结果与分析
2.1 症状描述
马铃薯炭疽病在块茎、茎秆、叶片等部位均可发生。马铃薯根部和匍匐枝上发病时出现大量黑色的斑点状分生孢子盘,且分生孢子盘上褐色刚毛明显(图1a);块茎发病形成近圆形或不规则形大斑,呈褐色或灰色(图1b),后逐渐褐色腐烂,略下陷,病健交界明显,其上有黑色小点,为病原菌形成的分生孢子盘。叶部发病症状多不明显,偶尔早期颜色变淡,在叶柄和小叶上形成褐色至黑褐色病斑;在生长中期可在茎秆上形成褐色条形病斑且不断扩大(图1c),其上也可以形成分生孢子盘,后期茎秆逐渐萎蔫并枯死,在枯死的茎秆外表皮或皮层内部形成大量的黑色颗粒状物,为小菌核(图1d)。
2.2 病原菌的分离与致病性测定
经常规组织分离培养,在显微镜下检查分离物,所有分离物中只有一种炭疽菌属的真菌,在PDA培养基上该菌新鲜菌丝无色,老菌丝呈浅褐色,在培养皿中央形成大量黑色分生孢子盘和小菌核(图2),将该分离物接种于马铃薯进行致病性测定。

在接种后的马铃薯植株茎秆上,约30d后出现马铃薯炭疽病的典型症状(图3)。初期形成褐色斑点,之后茎秆上逐渐形成灰褐色条形斑,且不断扩大,后期茎秆逐渐萎蔫并枯死,并且坏死部分呈灰白色,而在枯死的茎秆表面形成大量的黑色颗粒状物,镜检为病原菌的分生孢子盘,且与所接种的病原菌形态一致,在PDA培养基上再次分离得到了该病原菌。因此,确定该分离物为马铃薯炭疽病的病原物,并对该菌进行了以下试验。
2.3 病原菌的鉴定
2.3.1 病原形态学鉴定
该菌菌丝无色至浅褐色,有隔膜,分生孢子盘黑褐色,长88~120μm(平均109.0μm),常生于寄主表皮下,盘上产生褐色、有分隔、顶部渐尖的刚毛6~7根,长40~90μm(平均61.8μm),分生孢子梗无色,具分隔,紧密排列在分生孢子盘上,单个顶生分生孢子;分生孢子无色,单胞,长椭圆形或杆状,大小为(16~19)μm(17.3μm)× (3.6~4.8)μm(4.3μm)(图4右图中箭头所指)。
根据病原形态特征,参考相关文献[7-8]鉴定该菌为半知菌亚门(Deuteromycotina)腔孢纲(Coelomycetes)黑盘孢目(Melanconiales)炭疽菌属(Colletotrichum)的球炭疽菌[Colletotrichum coccodes(Wallr.)Hughes]。

图4 马铃薯炭疽病病原形态
2.3.2 病原菌的ITS序列鉴定
采用UNIQ-10柱式真菌基因组DNA抽提试剂盒提取炭疽病菌基因组DNA,经电泳检测,有两个重复其特异性、纯度和完整性能满足PCR扩增的要求(图5)。
图5 炭疽病菌基因组DNA电泳
在引物ITS1和ITS4的引导下,PCR扩增30个循环,产物用1.2%琼脂糖凝胶电泳检测,以DNA Marker-DL2 000为对照,在500bp附近有一条明显的特异性扩增条带,即为获得的目的ITS rDNA片段(图6),将该扩增产物送上海生工测序。
图6 炭疽病菌ITS rDNA PCR电泳
将所测定的炭疽病菌的ITS rDNA序列输入GenBank中比对后,与EU400141.1 Colletotrichum coccodes、HM171679.1 Colletotrichum coccodes 和FJ545227.1 Colletotrichum coccodes等7个序列相似性在100%,搜索下载这些相似性最高的序列,并使用Clustal(1.8)进行多重序列比较,再用 Mega 4.0软件以最大简约法(Neighbor-Joining,NJ)构建系统发育树(图7),炭疽病菌在系统发育树中与EU400141.1(570bp)Colletotrichum coccodes聚在一起,其为2008年由加拿大学者上传,说明其亲缘关系最近。该结果从分子水平进一步鉴定该病原菌为Colletotrichum coccodes,该病害为马铃薯炭疽病。

图7 炭疽病菌系统发育树
2.4 马铃薯炭疽病菌的室内药剂筛选
2.4.1 对马铃薯炭疽病菌菌丝的抑制效果
表1表明,75%肟菌·戊唑醇水分散粒剂90μg/mL抑菌率最高,达91.65%,68%精甲霜·锰锌可湿性粉剂抑菌作用较差,2 560μg/mL时抑菌率为84.33%,160μg/mL时仅为16.04%。12种供试药剂在试验浓度下对炭疽病菌菌丝的生长均有不同程度的抑制作用,其抑制率随浓度的增大而增加,不同药剂间抑制率也差异明显。
2.4.2 12种杀菌剂的毒力比较
表2表明,所选的12种化学农药对马铃薯炭疽病菌都有一定的抑制效果,其中70%甲基硫菌灵可湿性粉剂、10%苯醚甲环唑水分散粒剂、30%丙环唑·苯醚甲环唑乳油、32.5%苯醚甲环唑·嘧菌酯悬浮剂、75%肟菌·戊唑醇水分散粒剂、50%咪鲜胺锰盐可湿性粉剂、1.5%噻霉酮水乳剂的EC50(μg/mL)值小于10,说明马铃薯炭疽病菌对这几种药剂非常敏感;50%嘧菌酯悬浮剂、75%百菌清可湿性粉剂、70%丙森锌可湿性粉剂、70%代森锰锌可湿性粉剂的 EC50在10μg/mL到85μg/mL之间,小于100μg/mL,即马铃薯炭疽病菌对这几种药剂较敏感;68%精甲霜·锰锌水分散粒剂的抑制效果较差,其EC50为734.30μg/mL,说明马铃薯炭疽病菌对该药剂敏感性较差。该结果表明70%甲基硫菌灵可湿性粉剂、10%苯醚甲环唑水分散粒剂、30%丙环唑·苯醚甲环唑乳油、32.5%苯醚甲环唑·嘧菌酯悬浮剂、75%肟菌·戊唑醇水分散粒剂、50%咪鲜胺锰盐可湿性粉剂、1.5%噻霉酮水乳剂在理论上为马铃薯炭疽病化学防治中较好的化学农药。12种不同药剂的EC50(μg/mL)值由小到大依次为70%甲基硫菌灵可湿性粉剂<10%苯醚甲环唑水分散粒剂<30%丙环唑·苯醚甲环唑乳油<32.5%苯醚甲环唑·嘧菌酯悬浮剂<75%肟菌·戊唑醇水分散粒剂<50%咪鲜胺锰盐可湿性粉剂<1.5%噻霉酮水乳剂<50%嘧菌酯悬浮剂<75%百菌清可湿性粉剂<70%丙森锌可湿性粉剂<70%代森锰锌可湿性粉剂<68%精甲霜·锰锌水分散粒剂。
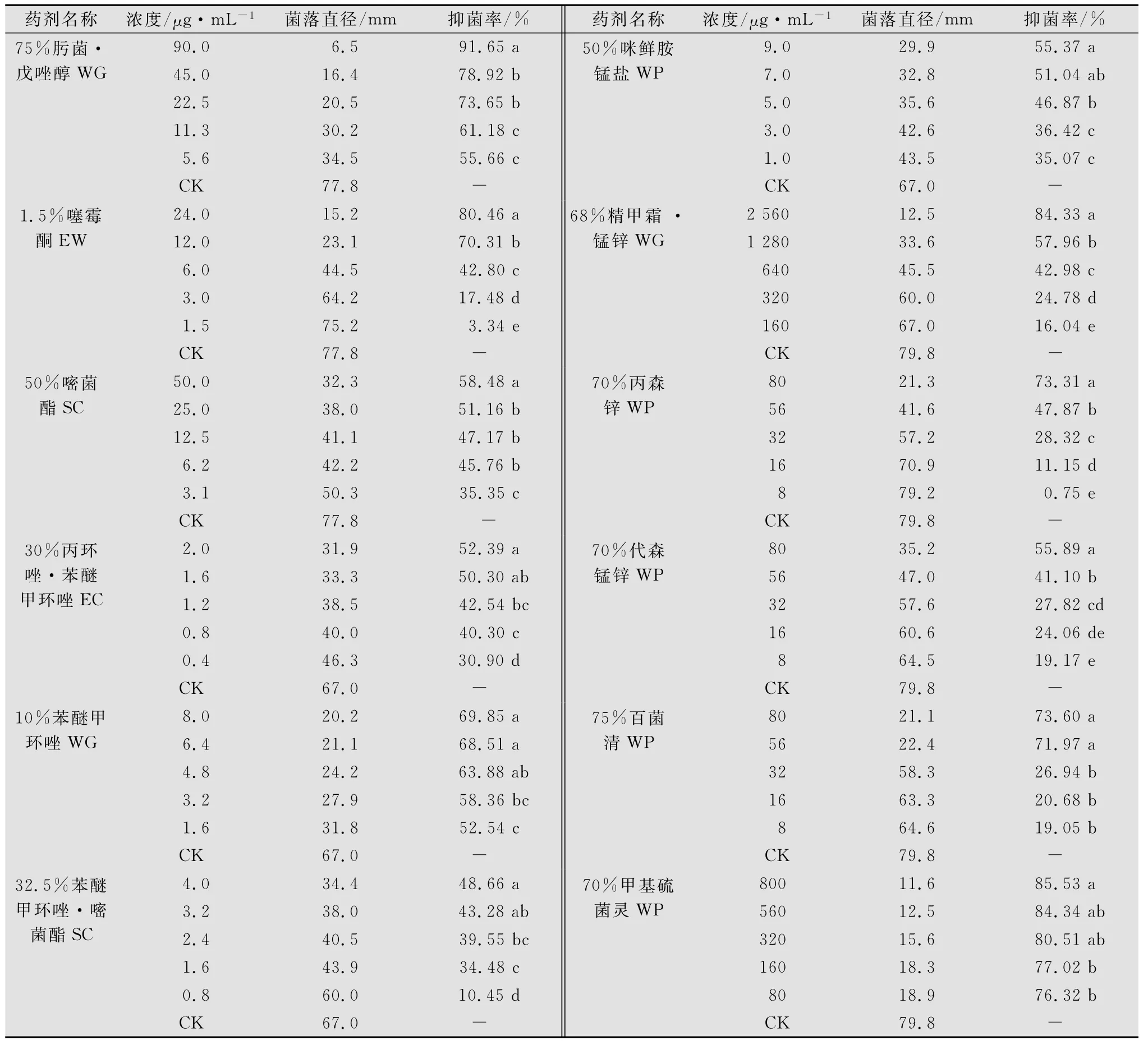
表1 12种杀菌剂对马铃薯炭疽病菌的相对抑制率1)
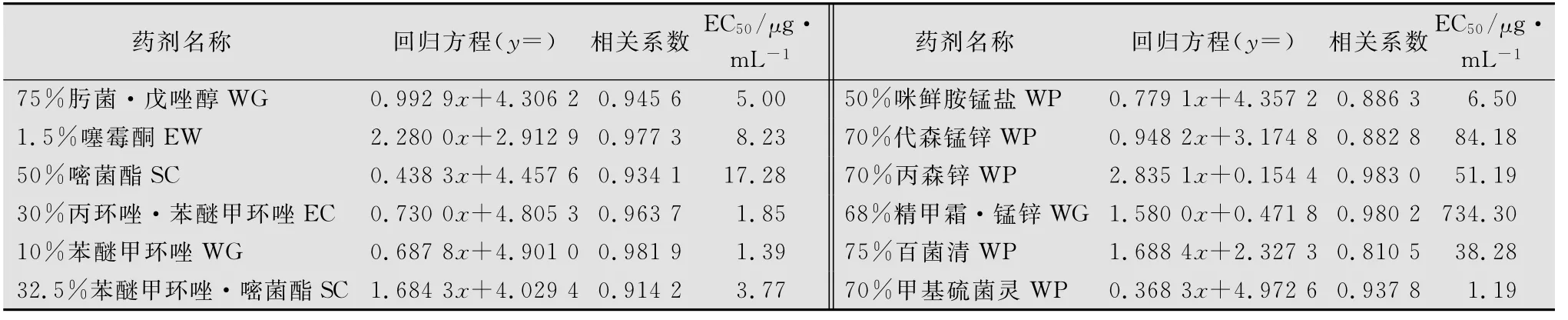
表2 12种杀菌剂对马铃薯炭疽病菌的毒力测定
3 讨论与结论
马铃薯炭疽病除了危害马铃薯外,还可以侵染包括葫芦科、茄科等13个科的35种寄主,在我国仅吉林省和山东省有记录[10]。其病原球炭疽菌(C.coccodes)以小菌核的形式在块茎、作物的碎屑或土壤中存活很长时间,53%的小菌核埋藏在松软的土层2.5cm下,在潮湿的条件下可以存活83周[11];受侵染的块茎种植在田间后,植株表现为生长缓慢,茎部、子块茎都显示病症。Cullen等[6]用PCR技术分别从英国3个地区的5年、8年、13年未种植过马铃薯的土壤中检测到了该病菌的存在,证实了土壤是该病菌一种主要的侵染来源,即土壤带菌就成为一种有效的接种体[12]。据2010年和2011年调查,马铃薯炭疽病在甘肃省多个县(区)马铃薯生长期和贮藏期发生,发病轻的田块生长不良,发病重的田块植株早枯,严重影响马铃薯的产量和品质,同时进入贮藏期造成块茎腐烂,其已成为甘肃省马铃薯生产上的重要病害之一。本试验室内毒力测定中70%甲基硫菌灵可湿性粉剂、10%苯醚甲环唑水分散粒剂、30%丙环唑·苯醚甲环唑乳油、32.5%苯醚甲环唑·嘧菌酯悬浮剂、75%肟菌·戊唑醇水分散粒剂、50%咪鲜胺锰盐可湿性粉剂、1.5%噻霉酮水乳剂对马铃薯炭疽病菌的EC50较小,理论上为防治效果较好的化学农药;50%嘧菌酯悬浮剂、75%百菌清可湿性粉剂、70%丙森锌可湿性粉剂、70%代森锰锌可湿性粉剂对马铃薯炭疽病也有一定的防治效果。该结果为马铃薯炭疽病的化学防治提供了理论依据。
[1] Johnson D A,Miliczky E R.Distribution and development of black dot,Verticilliumwilt,and powdery scab on Russet Burbank potatoes in Washington State[J].Plant Disease,1993,77:74-79.
[2] Pavlista A,Kerr E D.Black dot of potato caused by Colletotrichum coccodes in Nebraska[J].Plant Disease,1992,76:1077.
[3] 刘会梅,王向军,封立平.马铃薯炭疽病研究进展[J].植物检疫,2007,21(1):38-41.
[4] Tsror L,Erlich O,Hazanovsky M.Effect of Colletotrichum coccodes on potato yield,tuber quality,and stem colonization during spring and autumn[J].Plant Disease,1999,83:561-565.
[5] Hooker W J.Compendium of potato diseases[M].Washington:the American Phytopathological Society,2003:26-27.
[6] Cullen D W,LeesA K,Toth I K,et al.Detection of Colletotrichum coccodes from soil and potato tubers by conventional and quantitative real-time PCR[J].Plant Pathology,2002,51,281-292.
[7] 戴芳澜.中国真菌总汇[M].北京:科学出版社,1979.
[8] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[9] Marais L.Efficacy of fungicides against Colletotrichum coccodes on potato tubers[J].Potato Research,1990,33:275-281.
[10] 姚文国,崔茂森.马铃薯有害生物及其检疫[M].北京:中国农业出版社,2001.
[11] Blakeman J P,Hornby D.The persistence of Colletotrichum coccodes and Mycosphaerella ligulicolain soil with special reference to sclerotia and conidia[J].Transactions of the British Mycological Socicty,1966,49:227-240.
[12] Denner F D N,Millard C,Wehner F C.Effect of seed and soilborne inoculum of Colletotrichum coccodes on the incidence of black dot on potatoes[J].Potato Research,1998,41:51-56.
