油棕猝倒病菌实时荧光PCR检测方法
2012-09-28张慧丽王建峰段维军高姗姗陈先锋
张慧丽, 王建峰, 段维军, 徐 瑛, 高姗姗, 陈先锋*
(1.宁波出入境检验检疫局,宁波 315012;2.宁波大学,宁波 315211)
华丽腐霉(Pythium splendens Braun)引起的油棕猝倒病是油棕上的一种重要真菌病害[1],该病菌寄主范围很广,除侵染油棕苗以外,还能危害上百种经济作物,引起寄主幼苗整株失水萎蔫[2]。它主要分布在比利时、法国、德国、意大利、荷兰、日本、坦桑尼亚、刚果和美国的夏威夷、佛罗里达、宾夕法尼亚州,国内台湾、海南曾有报道[2-4],但其他地区未见发生报道。该病菌通过带菌土壤、生长介质和营养繁殖材料传播。在2007年被列入中华人民共和国进境植物检疫性有害生物名录。针对P.splendens的检 测 已 有 特 异 性 引 物[5]、PCR-RFLP[6]、核 糖 体DNA序列分析[4]等方法。随着分子生物学技术的发展,实时荧光PCR以其具有的高特异性、高灵敏度以及快速的优点越来越多地应用于疫病的检测。
真核生物核糖体 DNA(rDNA)由18S、ITS1(internal transcribed space)、5.8S、ITS2 和 28S构成,头尾串联形成重复序列,一个基因组内有60~200个拷贝。ITS1和ITS2常被合称为ITS,并且5.8SrDNA基因也被包括在ITS之内。rDNA上5.8S、18S和28SrDNA基因序列进化缓慢而相对保守,但这三个基因序列之间的ITS序列的进化则相当迅速,因而rDNA序列广泛用于真菌各级水平的系统学研究[7]。本研究通过对病原菌及相关种的rDNA ITS序列进行比较分析,设计了针对P.splendens的引物和探针,建立了P.splendens实时荧光PCR检测方法,为口岸检验检疫提供快速、准确的检测技术。
1 材料和方法
1.1 菌株
供试菌株包括了腐霉属12种、疫霉属2种以及一些常见真菌、细菌共17种21个菌株。菌株编号和来源见表1。
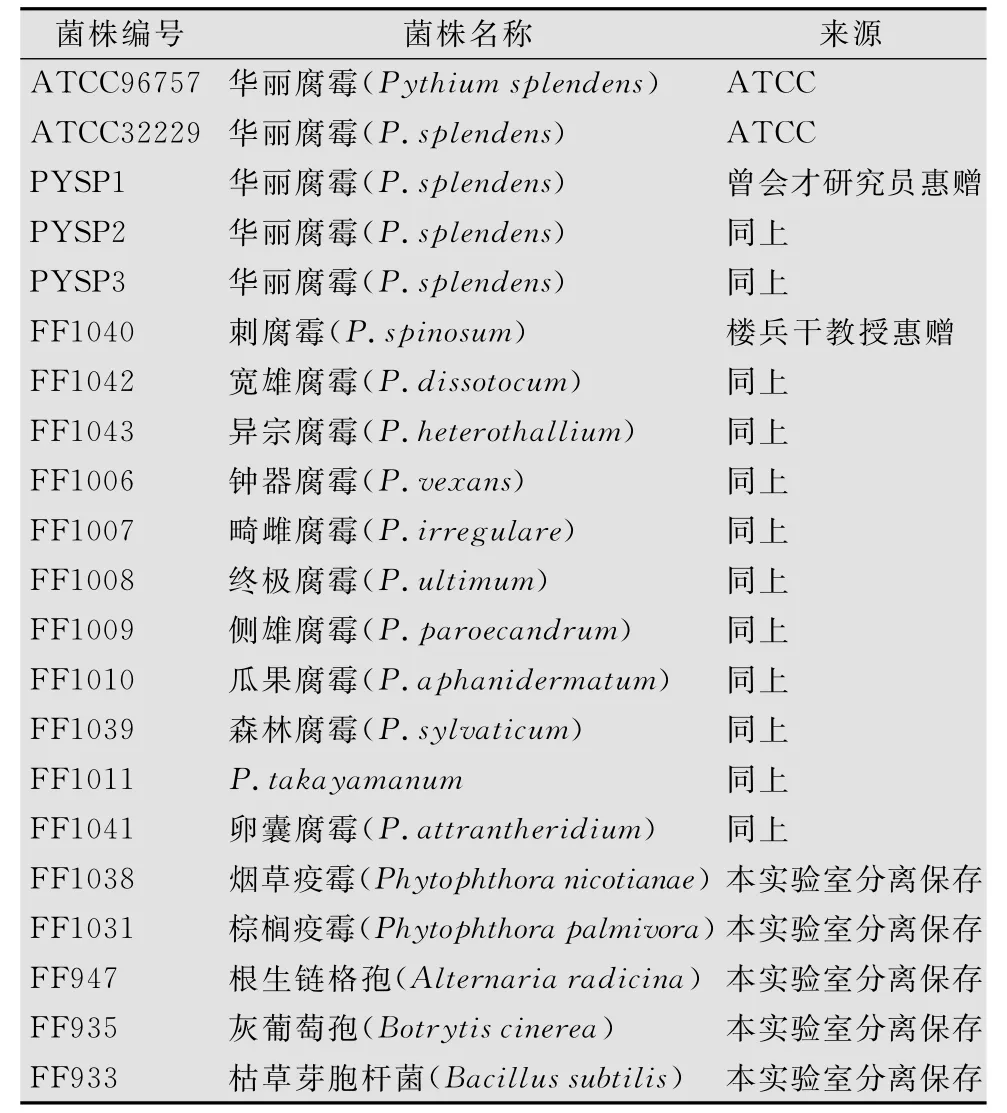
表1 参试菌株及来源
1.2 DNA提取
将供试真菌菌株采用CTAB法提取总DNA[8],细菌菌株采用TaKaRa minibest bacterial genomic DNA extraction kit ver.2.0 试 剂 盒 提 取 DNA,-20℃保存备用。
1.3 PCR检测
1.3.1 引物及探针的设计与合成
使用Bioedit软件对GenBank中的病原菌及相关种的rDNA ITS序列进行比较分析,找出保守序列,应用 Primer Express 5.0设计P.splendens的引物和探针。实时荧光PCR引物pyspF序列为5′-TTAAATGGACAGGGTCTTTCTAT-3′, pyspR序 列 为 5′-TGCCGAAGTCGCCAAAAG-3′,Taqman探针 pyspT 序列为5′-CGAGCACCACACTTCACACAG-3′,探针5′端标记的荧光报告基团为FAM,3′端标记的荧光猝灭基团为TAMRA。荧光探针与引物由宝生物工程(大连)有限公司合成。
1.3.2 实时荧光PCR反应体系和程序
PCR反应总体积为25μL,各成分为:1×Premix Ex TaqTM(大连宝生物),引物0.5μmol/L,探针0.2μmol/L,校正荧光 ROX 0.2μmol/L。在ABI 7900定量PCR仪(美国ABI)上进行PCR反应。反应条件为:50℃预热2min;95℃预变性10min;95℃15s,60℃1min,40个循环。实时荧光PCR利用ABI 7900型荧光定量PCR仪自带软件SDS3.0(版本号)进行结果分析,根据阴性对照结果设定阈值线,扩增曲线及样品Ct值由软件自动生成。
1.3.3 特异性检测
以表1中菌株的基因组DNA为试验材料,用P.splendens的种特异性引物PyspF/PyspR及探针PyspT行实时荧光PCR检测,并设置空白对照。
1.3.4 灵敏度检测
为确定油棕猝倒病菌实时荧光PCR的检测限度,将菌株 ATCC96757 的 DNA 稀 释 成12、1.2、0.12、0.012、0.001 2、0.000 12、0.000 012、0.000 001 2ng/μL 8个不同浓度,分别用引物PyspF/PyspR及探针PyspT进行实时荧光PCR检测。
2 结果与分析
2.1 华丽腐霉的特异性检测
对表1所列供试菌株进行实时荧光PCR检测结果表明,只有P.splendens的5个菌株的模板检测到信号增加,扩增反应呈阳性,而其他参试菌株及空白对照在40个扩增周期内未见信号增长,扩增反应呈阴性(图1)。实时荧光PCR特异性良好。
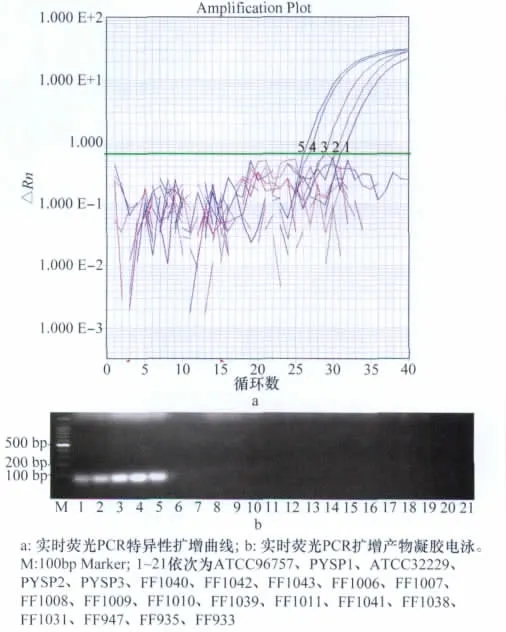
图1 油棕猝倒病菌实时荧光PCR特异性扩增结果
2.2 灵敏度检测试验
对不同稀释度的P.splendens DNA样品,采用实时荧光PCR检测,结果表明,实时荧光PCR方法对低至0.012pg/μL的DNA样品有明显扩增(图2),系列稀释的扩增曲线的Ct值在12~38之间,扩增曲线典型。方法的重复性良好。同时,DNA稀释度与Ct值呈良好的相关性,其相关系数0.999 5,相邻10倍稀释度的Ct值差为3.58左右(图3),结果可靠。

3 讨论
一直以来,形态学分类在腐霉分类中占主要地位,近年来随着分子生物学技术的发展,生物技术已经逐渐成为腐霉属菌物分类的一种重要的辅助工具,应用于P.splendens的分子方法包括特异性引物、PCR-RFLP、核糖体DNA序列分析等。形态学鉴定有经验性强、耗时长等缺点;已有的分子生物学方法中特异性引物的灵敏度不高,在研究过程中我们采用 Wang等[6]设计的特异性引物对DNA浓度为12ng/μL的样品进行检测,结果无扩增。PCRRFLP需要PCR扩增后再进行后续检测,耗时较长;核糖体DNA序列分析,扩增好的PCR产物需要送到专业公司进行测序,虽然获得的信息量大,但是耗时更长。而实时荧光PCR检测方法正好克服了以上的缺点,利用荧光信号的积累实时监测整个PCR过程,具有检测周期短、特异性与灵敏度高以及无需PCR后处理等优点。目前,还未见P.splendens实时荧光检测方法的报道。本研究建立的实时荧光PCR检测方法特异性强、灵敏度高。符合口岸检测快速、准确的要求。
[1] Aderungboye F O,Esuruoso O F.Ecological studies on Pythium splendens Braun in oil palm(Elaeis guineensis Jacq.)plantation soils[J].Plant and Soil,1976,44(2):397-406.
[2] CMI.Descriptions of pathogenic fungi and bacteria[M].Commonwealth Mycological Institute,Kew,United Kingdom,1966,No.120.
[3] Fu C H,Chen C M,Hsieh H J.First report of formosan michelia seedling root rot caused by Pythium splendens in Taiwan[J].Plant Disease,2005,89(12):1361.
[4] 陈秀贤,曾会才,何汉兴,等.海南腐霉新记录种Pythium splendens的鉴定及其对油棕苗的致病性测定[J].云南农业大学学报,2008,23(3):321-324.
[5] Wang P H,Wang Y T,White J G.Species-specific PCR primers for Pythiumdeveloped from ribosomal ITS1region[J].Letters in Applied Microbiology,2003,37(2):127-132.
[6] Wang P H,White J G.Molecular characterization of Pythium species based on RFLP analysis of the internal transcribed spacer region of ribosomal DNA[J].Physiological and Molecular Plant Pathology,1997,51(2):129-143.
[7] 陈剑山,郑服丛.ITS序列分析在真菌分类鉴定中的应用[J].安徽农业科学,2007,35(13):3785-3786.
[8] 易润华,朱西儒,周而勋.简化CTAB法快速微量提取丝状真菌DNA[J].湛江海洋大学学报,2003,23(6):72-73.
