小菜蛾ISSR-PCR反应体系的建立与正交设计优化
2012-09-28杨家强王相晶郭兆将吴青君王少丽徐宝云张友军
杨家强, 王相晶, 郭兆将, 朱 勋, 吴青君*,谢 文, 王少丽, 徐宝云, 张友军
(1.东北农业大学生命科学学院,哈尔滨 150030;2.中国农业科学院蔬菜花卉研究所,北京 100081)
简单重复序列间区(inter simple sequence repeat,ISSR)是由 Zietkiewicz等人[1]开发的一种基于SSR的分子标记。这种新型方法用锚定的微卫星DNA为引物,即在SSR序列的3′端或5′端加上2~4个随机核苷酸,扩增反向排列的间隔不太长的2个SSR之间的序列,可以通过PCR技术揭示基因组中微卫星序列的变异。与微卫星及其他分子标记相比,ISSR标记具有操作简单,DNA用量少,可重复性好,成本低,呈孟德尔遗传,无须预知研究对象的基因组序列等特点,其所揭示的多态性比RFLP、RAPD和SSR更高,具有广泛的应用前景。这种方法常被应用于亲缘关系鉴定[2-4]、种质资源和遗传多样性研究[5-7],并被作为构建遗传图谱的工具[8]。
虽然ISSR-PCR具有重复性好的特点,但是IS-SR-PCR是基于PCR反应的分子标记方法,Mg2+浓度、dNTPs浓度、引物浓度以及Taq酶和模板DNA用量都会影响ISSR-PCR反应扩增效果[9],而且ISSR-PCR最佳反应体系在不同的物种中各不相同[10]。小菜蛾(Plutella xylostella)是影响十字花科蔬菜产量和质量最重要的害虫,因其繁殖率高、世代重叠严重、易产生抗药性,因此防治困难。Saw等利用mtCOI基因标记研究了澳大利亚小菜蛾,发现澳大利亚不同地理种群小菜蛾的mtDNA分化程度较低[11]。Endersby等通过对澳大利亚、新西兰等17个地区的小菜蛾进行SSR标记研究,发现澳大利亚小菜蛾种群与韩国、马来西亚种群存在较大的遗传分化[12]。由于ISSR-PCR各因素之间相互影响,为了保证ISSR-PCR结果的重复性和可靠性,必须搞清楚各因素之间的相互作用,所以非常有必要对小菜蛾ISSR-PCR反应体系进行优化,建立最佳反应体系。本文采用正交设计的方法,选用L16(45)正交表,从Mg2+浓度、dNTPs浓度、引物浓度以及Taq酶和模板DNA用量5种因素4个水平对小菜蛾ISSR-PCR反应体系进行优化,在此基础上对退火温度及反应循环次数进行比较分析,建立了适用于小菜蛾的ISSR-PCR最佳反应体系,为小菜蛾的多态性分析和分子生态学研究提供试验支持,为利用分子标记技术进行抗药性及种群遗传关系的研究奠定基础。
1 材料和方法
1.1 供试材料
小菜蛾种群:在本实验室养虫室内用无虫甘蓝苗进行继代饲养,具体方法参见杨峰山等[13],稍做改动。
1.2 基因组DNA的提取
采集小菜蛾成虫每3头为一管进行基因组DNA提取,提取方法按照TIANamp Genomic DNA Kit(TIANGEN BIOTECH CO.,LTD.)说明书进行。用琼脂糖凝胶电泳进行检测,Nanodrop 2000c分光光度计(Thermo Scientific公司)测定其浓度和纯度,并将DNA样品稀释至40ng/μL,用于ISSRPCR反应条件的优化试验。
1.3 优化ISSR-PCR反应体系的正交设计
为确定小菜蛾ISSR-PCR反应的最佳扩增条件,经初步筛选,引物886作为此次正交试验的引物,分别对 Mg2+浓度、Taq DNA 聚合酶用量、dNTPs浓度、模板DNA和引物浓度用量5个主要影响因素各4个水平作正交试验。选用L16(45)正交表,设计PCR扩增体系各成分的因素-水平正交设计试验(表1,表2)。反应体系均为20.0μL,每管各加2.0μL 10×PCR Buffer(不含 Mg2+),然后按照各组分母液浓度计算各因素用量,不足体积用无菌双蒸水补充,PCR产物用2.0%的琼脂糖电泳检测。结果依据琼脂糖电泳条带的强弱和杂带的多少做直观分析。
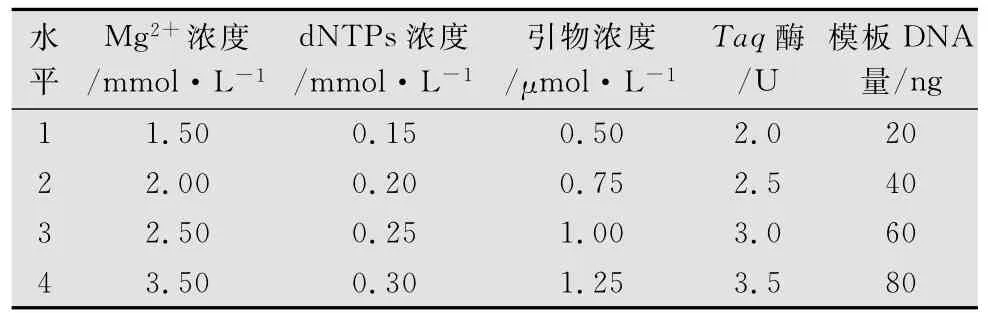
表1 ISSR-PCR反应体系的因素与水平

表2 ISSR-PCR正交试验设计[L16(45)]1)
1.4 ISSR-PCR的扩增反应
用于ISSR-PCR反应的 Mg2+、dNTPs、ES Taq酶购自康为世纪公司,标准分子量(marker)200bp Ladder购自天根生物技术有限公司,引物参照加拿大British Columbia大学提供的ISSR引物序列[14],Invitrogen公司合成。PCR反应在S1000型PCR循环仪(BIO-RAD公司)上进行。扩增程序:94℃预变性5min;94℃变性45s,X℃(不同引物退火温度各异)退火1.0min,72℃延伸1.5min,35个循环;72℃延伸10.0min;10℃保存。反应结束后,扩增产物在质量浓度2.0%的琼脂糖凝胶上电泳分离,电压150V。在ChemiDocTMXRS+凝胶成像系统(BIO-RAD公司)上观察并照相记录。利用Quantity one分析条带数目及明亮程度。
1.5 退火温度梯度筛选
利用以上正交试验建立的小菜蛾ISSR-PCR反应的最佳体系,从100个ISSR引物中根据Tm值上下浮动8.0℃设定退火温度范围,PCR仪自动生成温度梯度进行筛选,筛选出扩增稳定、重复性好的引物。对反应程序的循环次数进行优化。
2 结果与分析
2.1 直观分析法评分
小菜蛾正交ISSR-PCR产物电泳结果见图1,利用直观分析法[15]对16个处理从高到低依次打分,条带数量丰富、清晰度高、背景低的最佳产物记为25,与此相反,最差的记为1。从左至右依次的计分为:21、24、22、23、3、15、20、20、12、18、4、5、4、6、17、10;重复电泳的结果与第1个结果有较大的一致性,评分结果:22、24、23、22、4、13、21、21、11、17、3、5、3、5、15、9。
2.2 各因素影响ISSR-PCR反应的差异分析
采用DPS软件对结果进行方差分析,由F值可知Mg2+对PCR反应影响最大,Taq酶最小。各因素水平变化对PCR反应影响从大到小依次为:Mg2+、模板 DNA、dNTPs、引物、Taq酶,由于各因素水平间的差异均达到显著水平,需进一步做因素内多重比较。
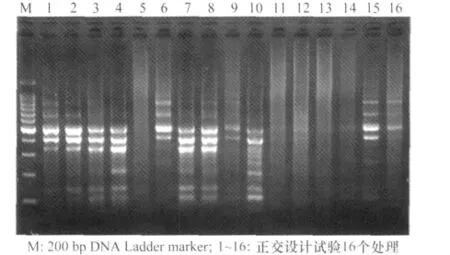
图1 ISSR-PCR反应正交试验电泳结果
2.2.1 Mg2+对小菜蛾ISSR-PCR体系的影响
对Mg2+各水平间进行比较分析结果表明,Mg2+浓度从1.5~3.0mmol/L扩增结果均值呈下降趋势,当 Mg2+浓度为1.5mmol/L时均值最高,且与其他3个水平达到极显著差异水平,1.5mmol/L为Mg2+最佳反应水平(图2)。
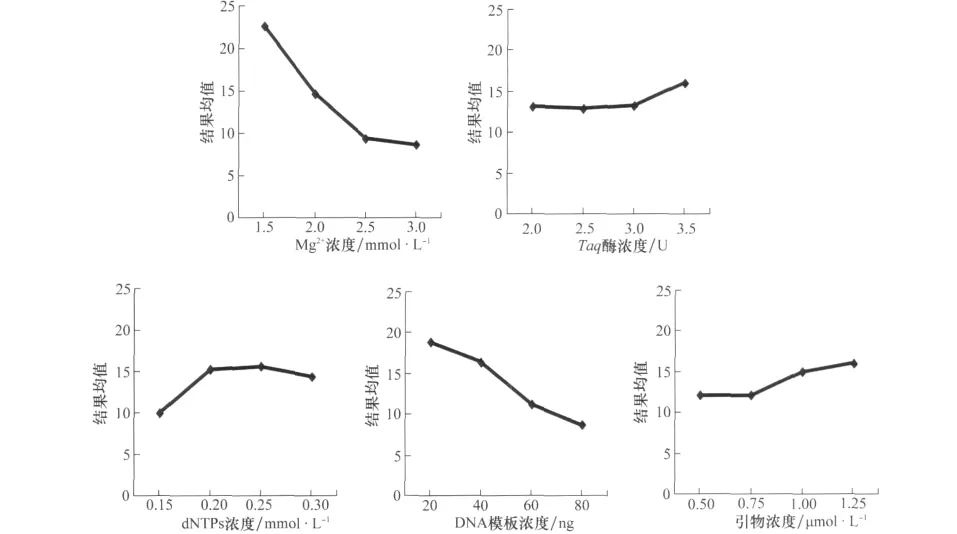
图2 不同因素与结果均值的关系
2.2.2 Taq酶对小菜蛾ISSR-PCR体系的影响
从方差分析可知,Taq酶对PCR扩增影响最小。对酶各水平比较分析表明,随着酶量的上升结果均值呈上升趋势,当酶量为3.5U时与其他3水平间的差异达到极显著水平,但酶量过高背景加深,且其他3个水平未达到显著差异(图2),综合考虑以2.5U水平为最佳反应水平。
2.2.3 dNTPs对小菜蛾ISSR-PCR体系的影响
dNTPs水平间比较的结果表明,随着dNTPs浓度从0.15~0.25mmol/L扩增结果均值增大,增加到0.30mmol/L时反而下降,浓度0.20mmol/L和0.25mmol/L未达到显著水平,但与其他两个水平差异显著(图2),综合考虑以0.20mmol/L水平为最佳反应水平。
2.2.4 模板DNA对小菜蛾ISSR-PCR体系的影响
从方差分析可知,模板DNA对PCR扩增影响很大。随着模板DNA浓度升高,扩增结果均值呈下降趋势,浓度为20ng时扩增结果均值最大且与其他水平的差异达到极显著水平,选择20ng为最佳水平(图2)。
2.2.5 引物对小菜蛾ISSR-PCR体系的影响
由方差分析可知,在0.50~1.25μmol/L内随着浓度的增加而升高,在1.25μmol/L时达到峰值(图2),与其他3个水平差异显著,因此选择峰值1.25μmol/L为最佳水平。
2.3 循环次数对小菜蛾ISSR-PCR体系的影响
循环次数对扩增产物的量具有重要的影响,循环次数不足,扩增产物量不足,部分谱带不能检测;反应到达平台期后,循环次数增多不会使产物明显增加,反而引起非特异性扩增,发生错配的比例比较高,引起弥散现象。该试验通过对3个(35、40、45)循环数的筛选,以40个循环数的扩增产物丰富、亮度高、清晰度好(图3)。
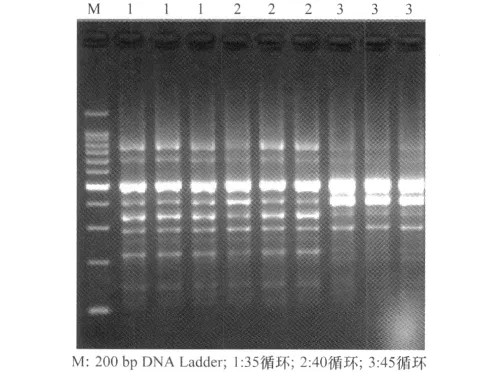
图3 不同循环次数的电泳结果
2.4 退火温度对小菜蛾ISSR-PCR体系的影响
PCR反应中,退火温度对扩增产物的影响较大,较低的退火温度允许适当错配,扩大了引物在基因组中配对的随机性,而较高的退火温度虽可提高配对专一性,却影响引物与模板的结合程度(图4)。
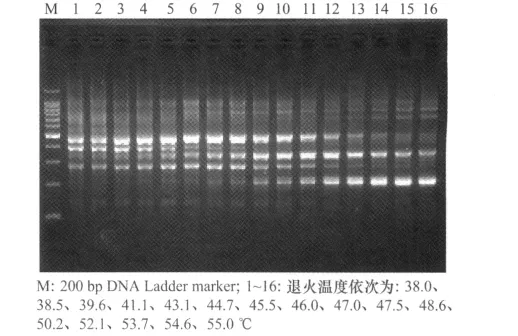
图4 温度梯度PCR结果
根据正交试验结果结合Tm值进行温度梯度PCR,从100个ISSR引物中进行引物筛选,试验所确定的17条引物的最适退火温度见表3。
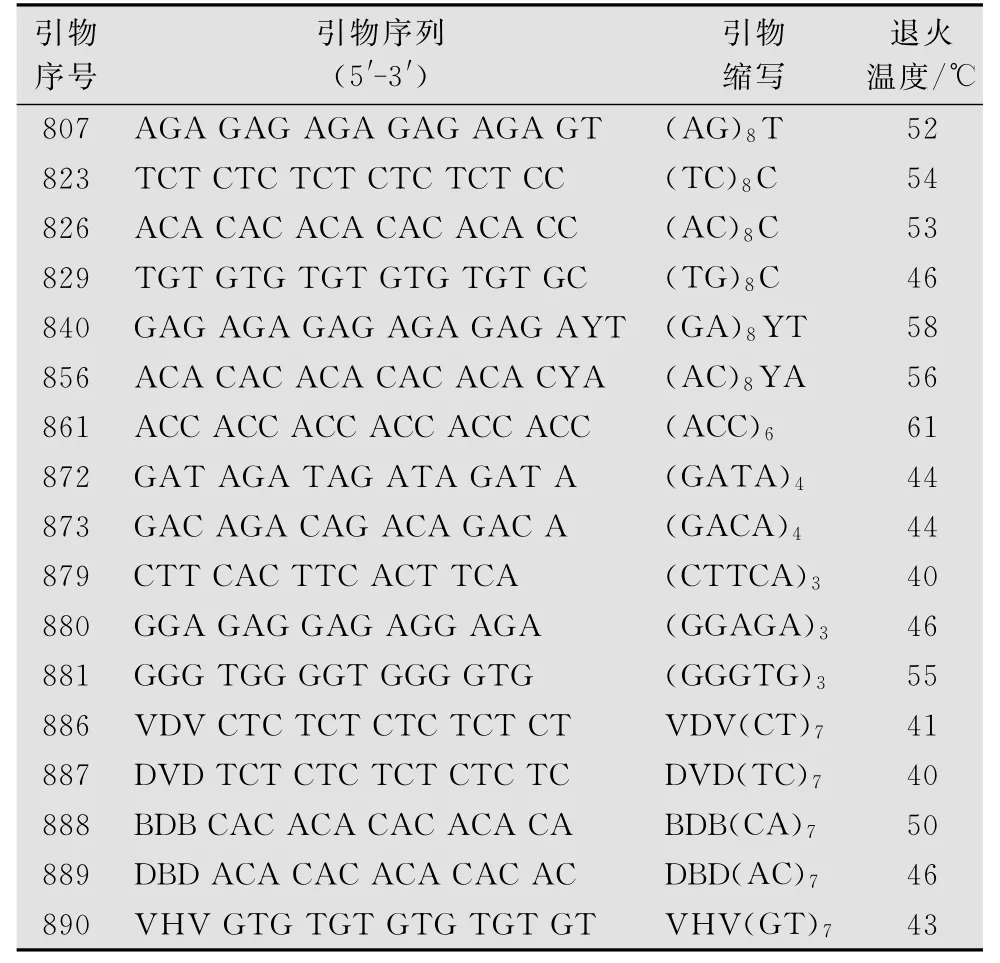
表3 引物序列及最适退火温度1)
3 小结与讨论
本研究发现 Mg2+浓度、模板DNA用量以及dNTPs浓度对小菜蛾ISSR-PCR扩增效果有显著影响。Mg2+是Taq酶的激活剂,其浓度影响Taq酶的活性并且影响引物与模板的结合效率。低浓度Mg2+使Taq酶活性降低,扩增效率低甚至无扩增产物[16]。而高浓度 Mg2+容易发生PCR错配产生非特异性扩增,造成背景弥散,试验确定Mg2+的最优浓度为1.5mmol/L。模板DNA用量影响引物与模板的结合几率,直接影响扩增产量,试验确定最优模板DNA用量为20ng。本研究发现,模板DNA浓度是影响小菜蛾ISSR-PCR反应的关键因素之一,其纯度也很重要,当模板DNA中含有少量RNA对ISSR扩增无明显影响,但是当模板DNA中残留较多的蛋白质,异丙醇,乙醇等杂质时往往会产生弥散,影响扩增效果,这与贺佳等[17]的研究结果一致。在反应体系中,dNTPs分子的磷酸基团能定量的与Mg2+结合,高浓度的dNTPs会造成Mg2+的拮抗作用,使实际反应中的Mg2+浓度下降[18],经过优化得到dNTPs最适浓度为0.2mmol/L。
此外,ISSR-PCR还受到退火温度,循环次数的影响。退火温度过低,扩增特异性差,杂带较多,背景深,不利于统计结果;随温度升高,特异性增强,但退火温度过高影响引物与模板DNA的结合,电泳条带弱,甚至没有扩增[19]。本研究根据引物Tm 值,进行Tm±8℃温度梯度筛选,确定了17条引物的退火温度(见表3)。试验表明:不同引物的最适退火温度不同,不能以单一的退火温度进行所有引物的试验[20],同一引物对于不同的物种,退火温度可能不同。循环次数决定扩增程度,循环次数过多增加非特异性扩增产物的数量和复杂性[21],通过不同循环次数的对比,确定小菜蛾ISSR-PCR反应以40个循环最佳。
本文采用正交试验设计方法,以小菜蛾基因组DNA为模板DNA,筛选出小菜蛾ISSR-PCR的最优反应体系(20μL)为:Mg2+浓度1.5mmol/L、Taq DNA聚合酶2.5U、dNTPs浓度0.2mmol/L、引物浓度1.25μmol/L、模板DNA量20ng。与单、双因素设计相比,兼顾了各因素之间的互作,减少了处理组合,大大节约了时间,降低了试验成本。为小菜蛾遗传多样性分析等提供了重要支持。
[1] Zietkiewicz E,Rafalske A,Labuda D.Genome fingerprinting by simple sequence repeats (SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20:176-183.
[2] Liu Guifeng,Dong Jingxiang,Jiang Ying.Analysis of genetic relationship in 12species of Section Strobus with ISSR markers[J].Journal of Forestry Research,2005,16(3):213-215.
[3] 贺学勤,刘庆昌,翟红,等.用RAPD、ISSR和AFLP标记分析系谱关系明确的甘薯品种的亲缘关系[J].作物学报,2005,31(10):1300-1304.
[4] Ammiraju J S S,Dholakia B B,Santra D K,et al.Identification of inter simple sequence repeat(ISSR)markers associated with seed size in wheat[J].Theoretical and Applied Genetics,2001,102:726-732.
[5] 侯永翠,颜泽洪,兰秀锦,等.利用RAMP和ISSR标记分析大麦种质资源的遗传多样性[J].中国农业科学,2005,38(12):2555-2565.
[6] 彭云滔,唐绍清,李伯林,等.野生罗汉果遗传多样性的ISSR分析[J].生物多样性,2005,13(1):36-42.
[7] 钱韦,葛颂,洪德元.采用RAPD和ISSR标记探讨中国疣粒野生稻的遗传多样性[J].植物学报,2000,42(7):741-750.
[8] Kojma T,Nagaoka T,Noda K.Genetic linkage map of ISSR and RAPD markers in Einkom wheat in relation to that of RFLP markers[J].Theoretical and Applied Genetics,1998,96:37-45.
[9] 吴根土,师桂英,徐秉良,等.裸仁美洲南瓜ISSR-PCR反应体系的正交优化[J].西北农业学报,2010,19(4):155-159.
[10] 刘欢,慕平,赵桂琴,等.燕麦ISSR反应体系的建立与优化[J].中国草地学报,2010,32(4):80-84.
[11] Saw J,Endersby N M,Mckechnie S W.Low mtDNA diversity among widespread Australian diamondback moth Plutella xylostella (L.)suggests isolation and a founder effect[J].Insect Science,2006,13:365-373.
[12] Endersby N M,Mckechnie S W,Ridland P M,et al.Microsatellites reveal a lack of structure in Australian populations of the diamondback moth,Plutella xylostella (L.)[J].Molecular Ecology,2006,15:107-118.
[13] 杨峰山,吴青君,徐宝云,等.小菜蛾对Bt毒素Cry1Ac和Bt制剂抗性的选育及其抗性种群的生物学适应性[J].昆虫学报,2006,49(1):64-69.
[14] 张青林,罗正荣.ISSR及其在果树上的应用[J].果树学报,2004,21(1):54-58.
[15] 何正文.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4):403-404.
[16] 李长春,阳天泉,戴余军,等.正交设计优化莲藕ISSR-PCR反应体系研究[J].北方园艺,2011(1):121-123.
[17] 贺佳,丁小余,褚必海,等.泽泻ISSR反应体系的建立与优化[J].南京师范大学学报(自然科学版),2006,29(3):86-90.
[18] 梁任繁,王益奎,李文嘉,等.茄子ISSR-PCR反应体系优化及验证[J].中国蔬菜,2010(24):48-52.
[19] 王佳,胡永红,张启翔.牡丹ISSR-PCR反应体系正交优化设计[J].安徽农业科学,2006,34(24):6465-6466.
[20] 姜静,杨传平,刘桂丰,等.桦树ISSR-PCR反应体系的优化[J].生态学杂志,2003,22(3):91-93.
[21] 杨浩,陈宏喜,陈欣,等.黄鳝ISSR-PCR反应体系的建立及条件优化[J].生物技术通报,2009(7):113-116.
