防治人参土传病害生防菌株X1和B59培养基筛选及发酵条件的优化研究1)
2012-09-27姜竹张云湖孟利强曹旭李晶
姜竹,张云湖,孟利强,曹旭,李晶*
(1.黑龙江护理高等专科学校,哈尔滨150086;2.黑龙江省生物工程重点实验室,黑龙江科学院微生物研究所,哈尔滨150010)
人参为五加科名贵中药材。土传病害是制约人参产量和质量的主要因素之一,在我国每年由于土传病害所造成的产量损失可达20%~50%,并且严重地削弱了我国人参产品在国际市场上的竞争能力。利用生防菌防治人参土传病害是一种高效、安全的植保新途径。近年对人参土传病害的生防研究主要集中在木霉菌的筛选和利用[1-4]。笔者从患病人参根际土中筛选获得两株对人参土传病菌具较强拮抗作用的生防菌株B59和X1[5],通过对两菌株的发酵培养基、最佳发酵条件的研究,为其开发利用奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株。生防菌株X1和B59由黑龙江省生物工程重点实验室分离、鉴定并保存。
1.2 方法
1.2.1 种子液制备 。将保存于-70℃的细菌菌株转接到装有5mL NYD培养基的试管中,37℃,150r/min振荡培养18h。将培养好的菌株划线到NYDA平板上,37℃培养箱中过夜培养18h。挑取单菌落再次接种到装有5mL NYD试管培养基中,37℃,150r/min振荡培养18h。
1.2.2 培养基成分的优化
(1)不同种类碳源对X1和B59菌株生长的影响。分别用1%葡萄糖、可溶性淀粉、玉米淀粉和蔗糖等量替代基础发酵培养基中的葡萄糖制成培养基。每种培养基中接种量为1%,37℃、160r/min摇床培养18h,采用可见分光光度计测定发酵液OD600值,用无菌相应的培养液稀释3倍,以相应的无菌培养基为空白对照,重复3次。
(2)不同种类的氮源对X1和B59菌体生长的影响。分别用1%酵母浸出物、胰蛋白胨、牛肉膏、牛肉膏+酵母膏(1∶1)等量替代基础发酵培养基中的氮源制成培养基。每种培养基中接种量为1%,37℃、160r/min摇床培养18h,采用可见分光光度计测定发酵液OD600值,用无菌相应的培养液稀释3倍,以相应的无菌培养基为空白对照,重复3次。
(3)不同种类的无机盐对X1和B59菌体生长的影响。分别用0.5%硫酸锰,硫酸镁,磷酸二氢钠+磷酸二氢钠(1∶1),氯化钾,氯化钙,及不加无机盐的空白培养基。每种培养基中接种量为1%,37℃、160r/min摇床培养18h,采用可见分光光度计测定发酵液OD600值,用无菌相应的培养液稀释3倍,以相应的无菌培养基为空白对照,重复3次。
(4)培养基营养成分的正交试验。根据以上单因素发酵培养基成分的试验结果,选定发酵培养基各营养成分,每种成分设计3个浓度水平,采用正交试验方案。选用正交表L9(33)进行正交设计(表1),按照表内方案配制培养基,并按上面培养条件筛选的结果,进行培养。采用可见分光光度计测定,根据发酵液OD600值对培养基中各种成分的含量进行调整。

表1 X1和B59菌株碳源、氮源、无机盐L9(33)正交设计试验的因素和水平表 g·L-1
1.2.3 培养条件的优化
(1)初始pH值的确定。将优化后的液体培养基的pH值分别调节为5.0、6.0、7.0、7.5、8.0、9.0、10.0,接种0.5%的种子培养液,37℃、160r/min摇床培养18h,采用可见分光光度计测定发酵液OD600值,用无菌NYD培养液稀释3倍,以无菌NYD培养基为空白对照,重复3次。
(2)需氧量的确定。在优化后的液体培养基的基础上,向250mL摇瓶中加入25、50、75、100、125mL的优化后液体培养基,接种0.5%的种子培养液,37℃、160r/min摇床培养18h,采用可见分光光度计测定发酵液OD600值,用无菌NYD培养液稀释3倍,以无菌NYD培养基为空白对照,重复3次。
(3)接种量的确定。向优化后的液体培养基中分别接种0.5%、1%、1.5%、2%、2.5%的种子培养液,37℃160r/min摇床培养18h,采用可见分光光度计测定发酵液OD600值,用无菌NYD培养液稀释3倍,以无菌NYD培养基为空白对照,重复3次。
(4)培养温度的确定。向优化后的液体培养基中接种0.5%的种子培养液,分别于20、25、30、35、40℃下培养,160r/min摇床培养18h,采用可见分光光度计测定发酵液OD600值,用无菌NYD培养液稀释3倍,以无菌NYD培养基为空白对照,重复3次。
(5)摇床转速的确定。向优化后的液体培养基中接种0.5%的种子培养液,分别于40、80、120、160、200r/min 37℃摇床培养18h,采用可见分光光度计测定发酵液OD600值,用无菌NYD培养液稀释3倍,以无菌NYD培养基为空白对照,重复3次。
2 结果与讨论
2.1 培养基优化
2.1.1 不同种类碳源对菌株生长的影响
枯草芽孢杆菌X1和B59菌株在利用可溶性淀粉作为碳源时,产生了白色浑浊物,影响吸光值OD600。即含有可溶性淀粉的培养液中吸光值OD600较含有葡萄糖的细菌培养液的吸光值OD600高,但菌浓度低。葡萄糖、蔗糖和玉米淀粉作为碳源时未出现混浊物。所以,枯草芽孢杆菌X1和B59的最佳碳源为葡萄糖。结果见图1。
2.1.2 不同种类氮源对菌株生长的影响
分别以牛肉膏、酵母膏、牛肉膏+酵母膏(1∶1)、胰蛋白胨作为氮源,研究不同氮源对菌种生长的影响,结果表明(见图1):用牛肉膏+酵母膏作为氮源时,枯草芽孢杆菌X1和B59菌株的生长明显优于单独加入牛肉膏、酵母膏和胰蛋白胨。枯草芽孢杆菌B1和B59菌株生长的最佳氮源是牛肉膏+酵母膏、其次是牛肉膏。如图2。
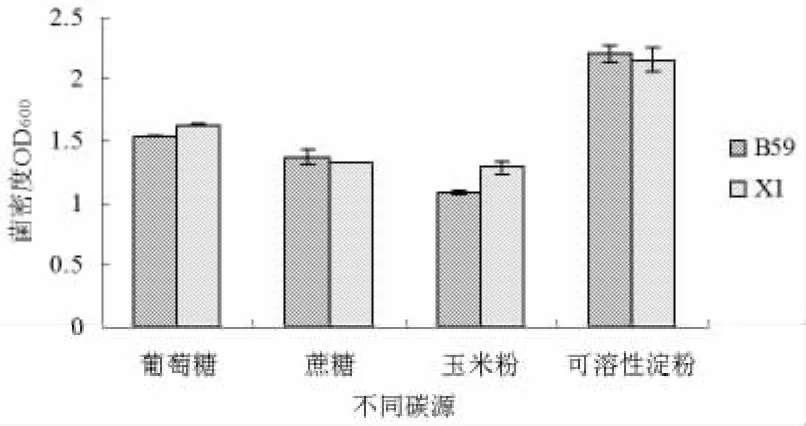
图1 不同碳源对菌种B59和X1菌株生长的影响

图2 不同种类的氮源对X1菌株和B59菌株生长的影响
2.1.3 不同种类无机盐对菌株生长的影响
以 KCl、MgSO4、CaCl2、MnSO4、空白、NaH2PO4+Na2HPO4作为无机盐因子,研究不同无机盐对X1和B59菌株生长的影响,结果表明(见图3),NaH2PO4+Na2HPO4作为无机盐时枯草芽孢杆菌B59和X1的生长明显优于其它无机盐。枯草芽孢杆菌X1和B59菌株生长的最佳无机盐是NaH2PO4+Na2HPO4。
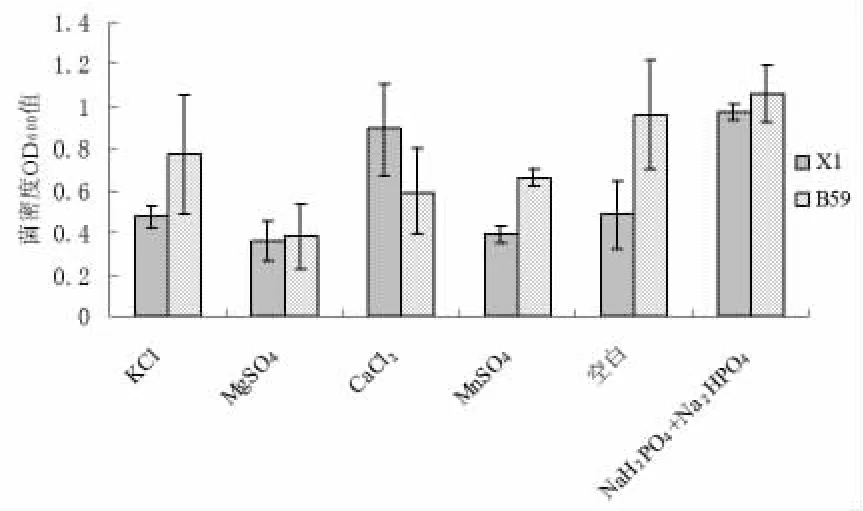
图3 不同种类无机盐对X1菌株和B59菌株生长的影响
2.1.4 正交试验
通过单因素试验初步确定,B59菌株的最佳碳源、氮源和无机盐分别为葡萄糖、牛肉膏和NaH2PO4+Na2HPO4。X1菌株的最佳碳源、氮源和无机盐分别为葡萄糖、牛肉膏+酵母膏(1∶1)和NaH2PO4+Na2HPO4。
通过三因素二水平进行正交实验。X1菌株碳源、氮源、无机盐L9(33)正交设计试验的因素和水平见表1,试验处理组合及X1菌株OD600值和各列水平平均数和极差(Rj)见表2。
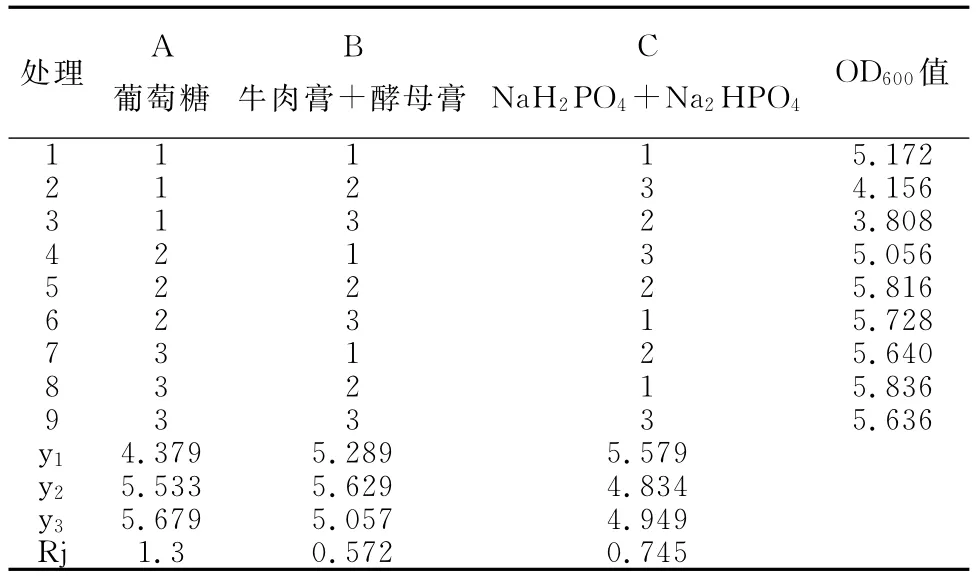
表2 X1菌株碳源、氮源、无机盐L9(33)正交设计试验的结果及分析
B59菌株碳源、氮源、无机盐L9(33)正交设计试验的因素和水平见表1,试验处理组合及B59菌株OD600值和各列水平平均数和极差(Rj)见表3。
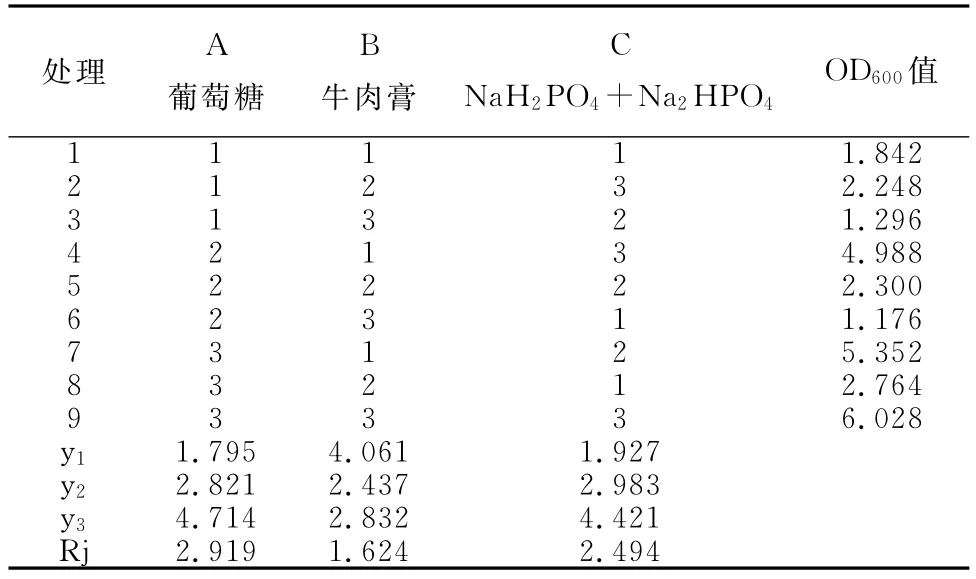
表3 B59菌株碳源、氮源、无机盐L9(33))正交设计试验的结果及分析
枯草芽孢杆菌X1和B59菌株培养基正交设计各处理Rj绝对值大小代表不同因素对发酵液菌数的影响程度,其值越大,影响程度越大;反之,其值越小,影响程度越小。因此可以看出三种因素对枯草芽孢杆菌X1菌株发酵液单位的影响大小依次为:葡萄糖>NaH2PO4+Na2HPO4>牛肉膏+酵母膏;B59菌株发酵液单位的影响大小依次为:葡萄糖>NaH2PO4+Na2HPO4>牛肉膏。
枯草芽孢杆菌X1和B59菌株培养基正交设计各处理Rj绝对值大小代表不同因素对发酵液菌数的影响程度,其值越大,影响程度越大;反之,其值越小,影响程度越小。因此可以看出三种因素对枯草芽孢杆菌X1菌株发酵液单位的影响大小依次为:葡萄糖>NaH2PO4+Na2HPO4>牛肉膏+酵母膏;B59菌株发酵液单位的影响大小依次为:葡萄糖>NaH2PO4+Na2HPO4>牛肉膏。
分析原因为:葡萄糖可以迅速的被菌体吸收利用,转变为能量,碳源对发酵结果的影响与无机盐和氮源相比效果最大。选择较大的yi值所对应的水平作为该因素的最佳水平,即如果某因素y1>y2,则选择1水平作为该因素的最佳水平;如果某因素y2>y1,则选择2水平作为该因素的最佳水平。因此,得出枯草芽孢杆菌X1菌株发酵培养基中最佳组合为:A3,B2,C1;最佳培养基成分组成为:葡萄糖15g/L,牛肉膏+酵母膏(1∶1)10.0g/L,NaH2PO4+Na2HPO42.5g/L。枯草芽孢杆菌B59菌株发酵培养基中最佳组合为:A3,B1,C2;最佳培养基成分组成为:葡萄糖15g/L,牛肉膏5.0g/L,NaH2PO4+Na2HPO45g/L。
2.2 培养条件的优化
2.2.1 枯草芽孢杆菌X1和B59菌株培养基初始pH值的确定
在培养条件不变,只改变培养基初始pH值,研究初始pH值对枯草芽孢杆菌X1和B59生长的影响。结果表明,在初始pH值为5.0~10之间时,发酵液中枯草芽孢杆菌X1和B59的生长大体趋势呈现出先升高再降低的趋势。当pH值为8.0时,X1和B59菌株生长最好(见图4)。因此,在培养枯草芽孢杆菌X1和B59过程中的初始pH值宜选择8.0。
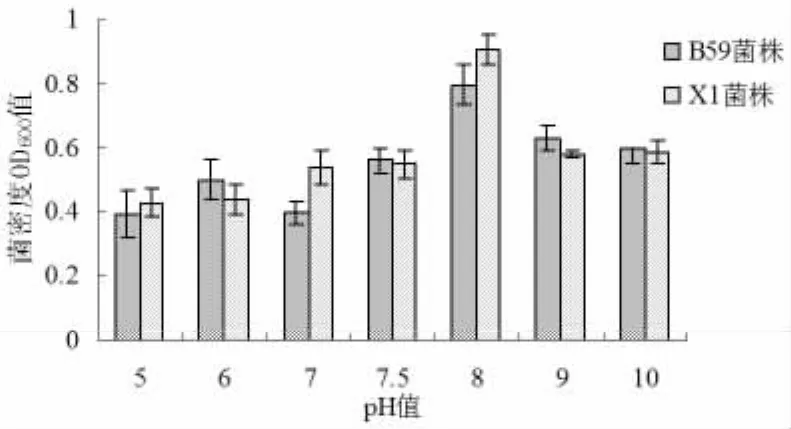
图4 初始pH值对枯草芽孢杆菌X1和B59菌株生长的影响
2.2.2 枯草芽孢杆菌X1和B59菌株需氧量的确定
在采用优化培养基的基础上,其它培养条件不变,只改变装液量,研究需氧量对枯草芽孢杆菌X1和B59菌株生长的影响(见图5)。当用250mL摇瓶装入培养液体积为25~125mL时,随着装液量的增加,发酵液的OD600随着减少。当装液量为25mL时,菌密度OD600最大,当装液量为125mL时,菌密度OD600最小。因此,在培养枯草芽孢杆菌X1和B59过程中的装液量宜选择250mL三角瓶装入25mL优化培养液。
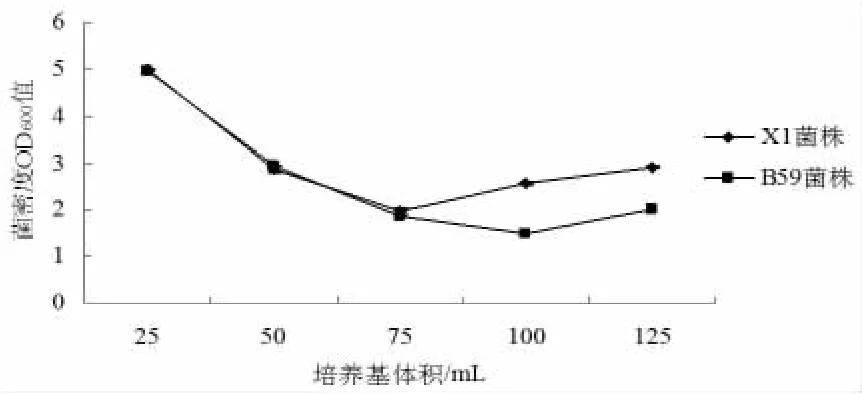
图5 需氧量对枯草芽孢杆菌X1和B59菌株生长的影响
2.2.3 枯草芽孢杆菌B59和X1菌株接种量的确定
2.2.3.1 枯草芽孢杆菌B59菌株接种量的确定。在采用基本培养基的基础上,其它培养条件不变,只改变接种量,研究接种量对枯草芽孢杆菌B59菌株生长的影响(见图6)。接种量为0.5%~2.5%之间时,随着接种量的增加,发酵液的OD600先增加再减少,且较为明显。当接种量为1.5%时,枯草芽孢杆菌B59菌株的菌密度OD600最大;当接种量为0.5%时,OD600最小。因此,在培养枯草芽孢杆菌B59过程中的接种量宜选择1.5%。
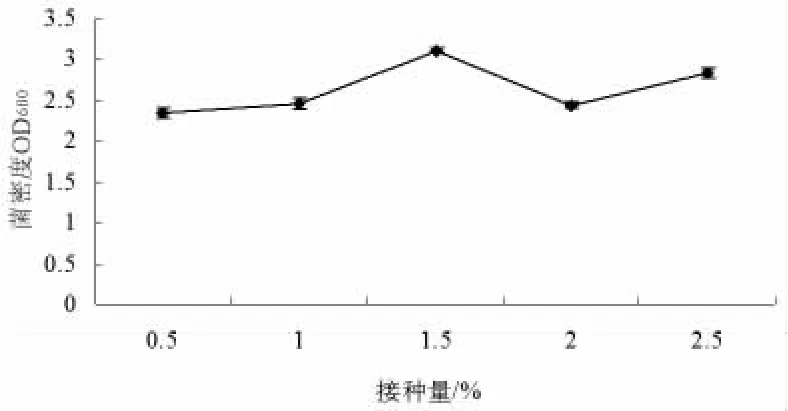
图6 不同接种量对枯草芽孢杆菌B59菌株生长的影响
2.2.3.2 枯草芽孢杆菌X1菌株接种量的确定。在采用优化培养基的基础上,其它培养条件不变,只改变接种量,来研究接种量对枯草芽孢杆菌X1菌株生长的影响(见图7)。接种量为0.5%~2.5%之间时,随着接种量的增加,发酵液的OD600先增加再减少。当接种量为1%时,枯草芽孢杆菌X1菌株的菌密度OD600最大;当接种量为2.5%时,OD600最小。因此,在培养枯草芽孢杆菌X1过程中的接种量宜选择1%。
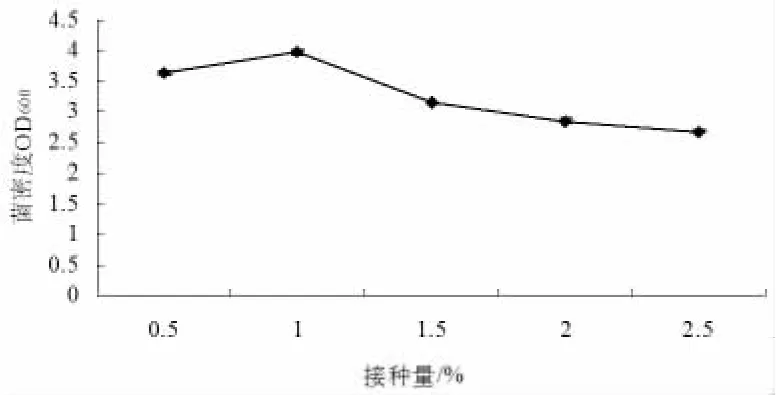
图7 不同接种量对枯草芽孢杆菌X1菌株生长的影响
2.2.4 枯草芽孢杆菌B59和X1菌株培养温度的确定
在采用优化培养基的基础上,其它培养条件不变,只改变培养温度,来研究温度对枯草芽孢杆菌X1菌株、B59菌株生长的影响(见图8)。温度为20~40℃之间时,随着接种量的增加,枯草芽孢杆菌X1菌株发酵液的OD600先增加再减少。当温度为25℃时,OD600最大;当温度为40℃时,OD600最小。因此,在培养枯草芽孢杆菌X1过程中的生长温度宜选择为25℃;当温度为30℃时,枯草芽孢杆菌B59菌株OD600最大;当温度为40℃时,OD600最小。因此,在培养枯草芽孢杆菌B59过程中的生长温度宜选择为30℃。
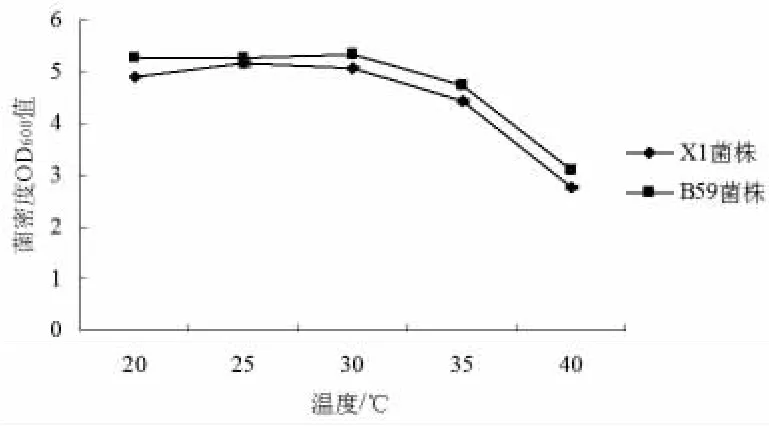
图8 不同培养温度对枯草芽孢杆菌和B59菌株生长的影响
2.2.5 枯草芽孢杆菌X1和B59菌株摇床转速的确定
采用优化培养基的基础上,其它培养条件不变,只改变摇床转速,研究摇床转速对枯草芽孢杆菌X1和B59菌株生长的影响(见图9)。转速为40~200r/min之间时,随着转速的增加,枯草芽孢杆菌X1和B59菌株发酵液的OD600也随着增加。当转速为160 r/min时,OD600最大;当温度为40r/min时,OD600最小。因此,在培养枯草芽孢杆菌X1和B59菌株过程中的转速宜选择为160r/min。

图9 不同摇床转速对枯草芽孢杆菌X1和B59菌株生长的影响
2.3 枯草芽孢杆菌X1和B59菌株的培养优化结果
枯草芽孢杆菌X1菌株的最佳培养基成分和培养条件为:葡萄糖15g/L,牛肉膏+酵母膏(1∶1)10.0g/L,NaH2PO4+Na2HPO42.5g/L,pH为8,250mL三角瓶中装入25mL培养基,接种量为1%,25℃,160r/min培养。
枯草芽孢杆菌B59菌株的最佳培养基成分和培养条件为:葡萄糖15g/L,牛肉膏5.0g/L,NaH2PO4+Na2HPO45g/L,pH为8,250mL三角瓶中装入25mL培养基,接种量为1.5%,30℃,160r/min培养。
用优化后的培养条件和培养基成分对菌株进行发酵培养,培养18h后,用平板对峙法做对人参腐皮镰孢菌(F.solani)抑菌试验,5d后观察、测量抑菌率;并与原始的NYD发酵培养基,以1%接菌量,250mL三角瓶装液50mL,160r/min,37℃培养18h,比较活菌数。试验结果表明,利用优化后的培养基和培养条件培养B59和X1菌株的活菌数明显高于利用NYD培养基培养的活菌数。优化培养的枯草芽孢杆菌X1和B59菌株对人参腐皮镰孢菌抑菌能力显著提高(图10)。菌株X1抑菌率由85.2%提高到93.4%。

图10 菌株X1优化前后抑菌活性的比较
[1] 任守让,王瑞霞.人参锈腐病菌的拮抗真菌及其防病效果 [J].吉林农业大学学报,1998,20(S1):120.
[2] Kim S L.Suppressive mechanism of soil-borne disease development and its practical application.Isolation and identification of species of Trichoderma antagonistic to soil diseases and its activities in the rhizosphere[J].Korean J.of Mycology,1992,20(4):334.
[3] 滕艳萍,梁宗锁,陈蓉.木霉防治黄芪根腐病初步研究[J].西北农业学报,2006,15(2):69-71.
[4] 丁万隆,程惠珍,陈君.应用木霉制剂防治几种药用植物病害的研究 中国中药杂志,2003,28(1):24-27.
[4] 姜竹,李晶,王玉霞,等.两株人参土传病害生防芽孢杆菌的筛选及抑菌活性研究[J].安徽农业科学,2011,39(11):6464-6466.
