牛流行热病毒山东流行株G 基因的克隆及序列分析
2012-09-26侯佩莉杨宏军王洪梅刘文浩何洪彬
侯佩莉,杨宏军,王洪梅,刘文浩,何洪彬
(山东省农业科学院奶牛研究中心,山东济南250100)
牛流行热又称三日热,是由牛流行热病毒(Bovine ephemeral fever virus,BEFV)引起的奶牛、黄牛、水牛的急性热性传染病,以3岁~5岁壮年牛最易感。临床表现为突然发热、呼吸急促、消化道机能障碍、全身虚弱、役用牛跛行和肢体僵直,可导致奶牛产奶量降低,乳品质下降,部分怀孕母牛流产等[1-3]。该病是一种周期性、短暂性的非接触性传染病,是由蚊、库蠓等带毒的吸血昆虫乘风传播而成为感染源[4-5]。该病流行与气候因素有相关性,多发生于高温多雨的月份,传播迅速,流行面广,一般3年~5年流行一次。中国台湾曾于1967、1983、1989、1996、1999、2001、2002、2004年发生过8次牛流行热大流行,而且疫情暴发间隔渐渐缩短,每次疫情发病期也逐渐延长,临床表现也较过去严重,对奶牛场和肉牛场的经济效益产生巨大的影响[6-8]。中国大陆在1949年前就有本病在部分地区发生流行的记载,随后在25个省市均多次暴发流行,给养牛业造成了严重的经济损失。
BEFV属于弹状病毒科(Rhabdoviridae)流行热病毒属(Ephemerovirus),目前只有一种血清型。该病毒核酸是一条单股负链、不分节段RNA,基因组大小为14 900 bp,共编码5个结构蛋白和6个非结构蛋白[9]。其中囊膜糖蛋白G是最主要的免疫原性蛋白,能够诱导牛体产生有效的中和抗体,使牛抵抗强毒的攻击,因此该病的一些诊断及治疗方法是基于G基因而建立的,如ELISA、RNAi技术等[10],G 蛋白基因也常用于制备基因工程疫苗[11]。本研究采用RT-PCR的方法从病料中对山东流行株G基因编码区进行了克隆及测序,最大限度地保证了获得序列的真实性及完整性,将本流行毒株G基因编码区与国内外参考毒株G基因编码区进行序列比较和遗传进化分析,初步阐明该流行毒株的基本分子生物学特点以及在系统发生树中所处的位置,为分子流行病学研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 病料采集 从山东某奶牛场临床表现有急性发热、呼吸道和消化道机能障碍等症状的疑似牛流行热病例中,选4头高热期病牛,分别采其血液样本。
1.1.2 菌种与载体 E.coli DH 5α由山东省农科院奶牛研究中心实验室保存;p EASY-T3 vector购自北京全式金生物技术公司。
1.1.3 主要试剂 Mini BEST Viral RNA/DNA Extraction Kit,Ta KaRa pime ScriptTMRT-PCR Kit,LA Taq酶,宝生物工程(大连)有限公司产品;其他试剂均为分析纯试剂。
1.2 方法
1.2.1 BEFV G基因的扩增 根据GenBank上发表的牛流行热病毒G基因编码区设计一对引物,由上海生物工程有限公司合成。上游引物:ATG TTC AAG GTC CTC ATA ATT AC;下游引物:TTA ATG ATC AAA GAA CCT ATC ATC AC。
取200μL临床高热期血液样本作为病毒RNA提取样品,按 MiniBEST Viral RNA/DNA Extraction Kit说明书进行操作。按照 Ta KaRa pime-ScriptTMRT-PCR Kit说明书进行 RT-PCR反应。
1.2.2 病毒G基因的克隆与鉴定 以上述反转录产物cDNA为模板,以合成的G编码区特异性引物扩增G基因编码区。PCR反应体系为:LA Taq 1μL,10×buffer 5μL,上游引物1μL(20μmol),下游引物1μL(20μmol),DNA 模板4μL,d NTP6μL(2.5 mmol/L),无菌双蒸水32μL,总体积为50μL。反应条件为:94℃4 min;94℃30 s,52℃50 s,72℃2 min,31个循环;72℃10 min。PCR结束后,扩增的特异性片段经10 g/L琼脂糖凝胶电泳分离,用 AXYGEN Gel Extraction Kit回收纯化后,将扩增的片段与pEASY-T3载体连接,转化感受态细胞DH5α,涂布LB/Amp+/IPTG/X-gal平板,蓝白斑筛选后提取重组质粒DNA。经PCR、NotⅠ/Eco RⅠ双酶切鉴定,挑菌落PCR鉴定,得到含目的片段的阳性重组质粒用于测序分析。
1.2.3 基因序列测定和分析 将阳性克隆送上海生工生物工程技术服务有限公司测序,测定结果与Gen Bank数据库中登录的牛流行热病毒基因进行同源性分析,用DNA Star软件获得片段对核苷酸和氨基酸序列的同源性进行比较。用Clustal X 1.8和 MEGA 4.0等软件进行进化树分析。
2 结果
2.1 牛流行热病毒G基因的扩增、克隆与鉴定
从采集样本的抗凝血中分别提取病毒RNA,经RT-PCR,用特异性引物进行扩增,经10 g/L琼脂糖凝胶电泳检测。结果表明,不同发病牛血液样本病毒cDNA经特异引物扩增均可获得预期1 872 bp大小的片段(图1)。将PCR产物送测序公司进行序列测定分析表明,不同发病牛血液样本扩增获得的片段相同。为了获得完整的BEFV的G基因核苷酸序列,将PCR产物连接p EASY-T3,阳性重组质粒经NocⅠ和SalⅠ双酶切鉴定,可见目的条带(图2)。经过序列测定分析,获得BEFV的G基因核苷酸序列,该片段的核苷酸序列和氨基酸序列与BEFV的同源性与中国台湾株1996/TW/TN1 glycoprotein G的相似度为97%。

2.2 牛流行热病毒G基因序列测定及分析
G蛋白基因编码区全长约1 872 bp,该基因编码含623个氨基酸、分子质量为81 ku的糖蛋白。应用DNAStar6.0生物软件对预测的G氨基酸序列进行分析(图3),结果柔韧性区分布相对较均匀,提示该蛋白肽段柔韧性较大,形成抗原表位的可能性较大,容易与抗体进行嵌合。在该基因N端是典型的真核膜蛋白信号肽序列区,包括N末端负电荷区和与肽酶切位点相近的多极化区域。
2.3 流行毒株G基因同源性比较和进化树分析
将扩增的G蛋白基因命名为2011-Shandong,利用DNA Star对其与GenBank中公布的部分流行毒株的核苷酸及推导氨基酸进行同源性比较,结果表明,核苷酸序列同源性为97.8%~99.8%,氨基酸的同源性为96.3%~100%,具有较高的保守性。
应用 MEGA5.1软件(Neighbor-joining)方法,根据流行毒株G基因的核苷酸序列和GenBank中登录的欧美、亚洲主要流行毒株G基因的核苷酸序列绘制系统发育进化树(图4)。进化树显示2011/Shandong流行株G基因与中国台湾流行株的亲缘关系较近。
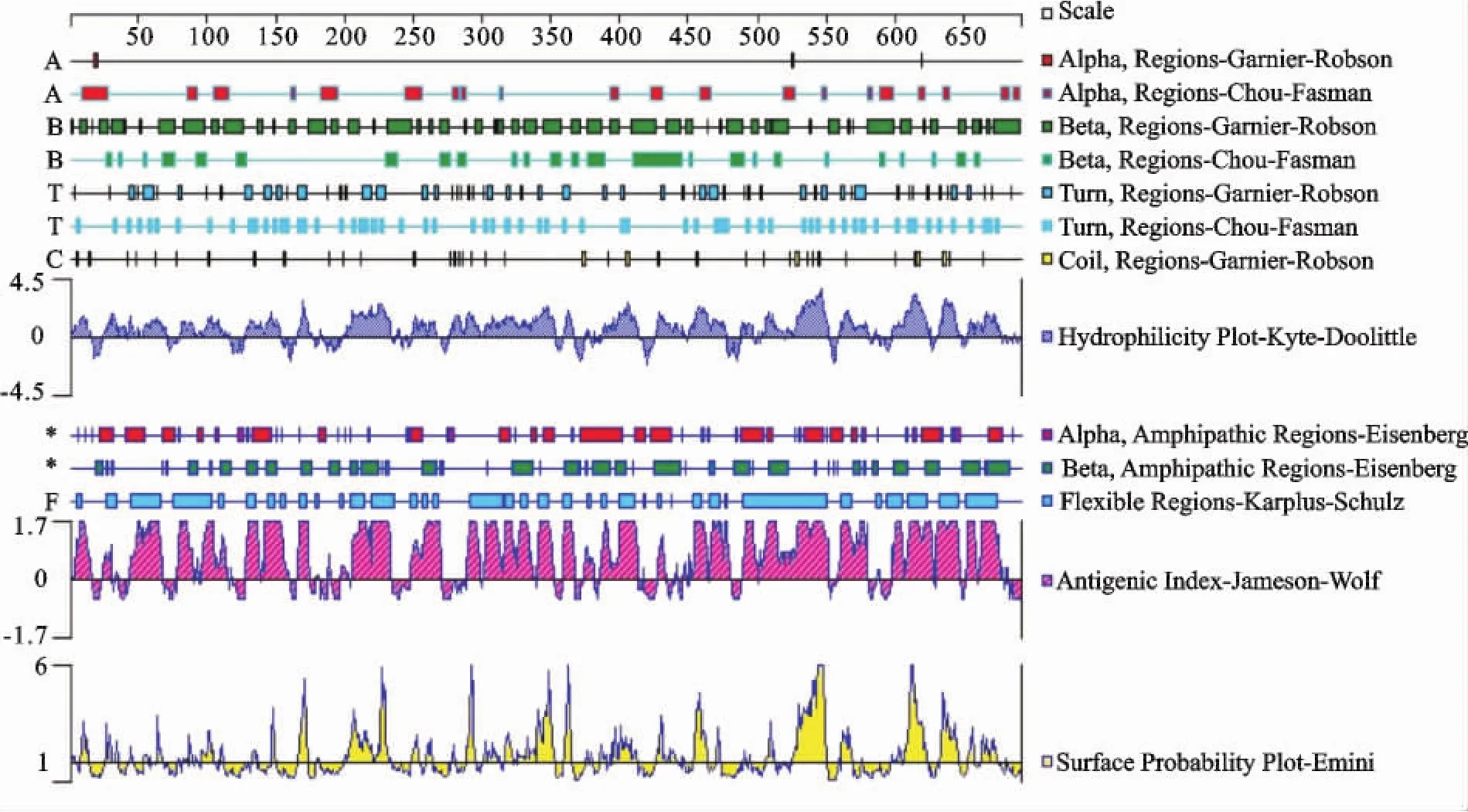
图3 BEFV山东流行株G基因分析Fig.3 The G gene sequence analysis of BEFV in Shandong
3 讨论
牛流行热是一种由节肢动物为媒介所引起的病毒性疾病,本病传播迅速,流行面广,发病率高。牛流行热疫情仍在世界各地持续暴发,间歇期渐渐缩短,每次疫情的发病期逐渐延长,临床症状也较过去严重,其危害越来越大[12]。然而,对牛流热及其病原的基础性研究不够深入,尚未建立起可用于生产实践的标准化诊断技术,无法做到牛流行热的早期发现、实时监测及其流行病学调查等。BEFV宿主范围不断趋于扩大,临床上也在山羊、绵羊及鹿检测到本病的抗体,并且在鹿有类似牛流行热的临床病例。在抗体检测方面,非洲也曾在水牛、大羚羊、非洲羚羊及南非大羚羊检测出本病毒的抗体[13]。
牛流行热病毒山东流行株G基因序列分析结果表明,G蛋白保守性很高,通过比较BEFV山东流行株G基因和NCBI/GenBank中的其他数据,核苷酸序列和预测的氨基酸序列的同源性大于90%。将山东流行毒株G基因编码区与国内外参考毒株G基因编码区进行序列比较和遗传进化分析,表明山东流行株BEFV与中国台湾流行株具有较高同源性和较近的亲缘关系,初步阐明了该毒株的基本分子生物学特点以及在系统发生树中所处的位置。
用单克隆抗体技术分析,G蛋白表面存在5个抗原位点(G1、G2、G3a、G3b、G4),其中G1和G4为非构象化位点,G1为BEFV所特有,只与牛流行热阳性血清发生反应,可以特异性检测血清抗体,而其他位点与同科的相关病毒则存在交叉反应[14]。与Gen Bank中具有代表性的BEFV G蛋白进行相似性比较,结果显示,山东流行株BEFV G蛋白的氨基酸突变主要集中在G1区域,共有11处突变,分别为第400位 V-I、420位 G-R、436位 N-T、437位R-K、460位 L-I、466位 D-E、477E-D、481位 V-I、487位R-K、499位 N-S、518位 K-R,这些突变很可能会影响G1蛋白的生物学功能,尤其是否影响血清型的变化,有待进一步的研究。对G基因的分析,为探讨BEFV的G基因功能、研究BEFV的致病机理、血清型分型、分子变异发生机制以及研发新型安全有效的基因疫苗等奠定了基础。

[1]Walker P J.Bovine ephemeral fever in Australia and the world[J].Curr Top Microbiol Immunol,2005,292:57-80.
[2]Yeruham I,Gur Y,Braverman Y.Retrospective epidemiological investigation of an outbreak of bovine ephemeral fever in 1991 affecting dairy cattle herds on the Mediterranean coastal plain[J].Vet J,2007,173(1):190-193.
[3]Zheng F Y,Lin G Z,Qiu C Q,et al.Isolation and characterization of a field strain of bovine ephemeral fever virus in China[J].J Anim Vet Adv,2009,8:1478-1483.
[4]Kedmi M,Herziger Y,Galon N,et al.The association of winds with the spread of EHDV in dairy cattle in Israel during an outbreak in 2006[J].Prev Vet Med,2010,96(3-4):152-160.
[5]Finlaison D S,Read A J,Kirkland P D.An epizootic of bovine ephemeral fever in New South Wales in 2008 associated with long-distance dispersal of vectors[J].Aust Vet J,2010,88(8):301-306.
[6]Wang F I,Hsu A M,Huang K J.Bovine ephemeral fever in Taiwan[J].J Vet Diagn Invest,2001,13(6):462-467.
[7]Hsieh Y C,Cheng S H,Chou C C,et al.Bovine ephemeral fever virus infection in Taiwan (2001–2002)[J].J Vet Med Sci,2005,67(4):411-416.
[8]Kato T,Aizawa M,Takayoshi K,et al.Phylogenetic relationships of the G gene sequence of bovine ephemeral fever virus isolated in Japan,Taiwan and Australia[J].J Vet Microbiol,2009,137(3-4):217-223.
[9]Knipe D M,Howley P M.Fields Virology[M].5th Edition.Lippincott Williams & Wilkins,USA,2007:1649-1724.
[10]Chuang S T,Ji W T,Chen Y T,et al.Suppression of bovine ephemeral fever virus by RNA interference[J].J Virol Meth,2007,145(1):84-87.
[11]Hsieh Y C,Wang S Y,Lee Y F,et al.DNA sequence analysis of glycoprotein G gene of bovine ephemeral fever virus and development of a double oil emulsion vaccine against bovine ephemeral fever[J].J Vet Med Sci,2006,68(6):543-548.
[12]Zhao J K,Zhang H Y,Yie X Y.Epidemiology and prevention of bo-vine ephemeral fever[J].Pro Vet Med,2008,29:116-117.
[13]陈世辉.牛流行热病毒之抗原性分析、疫情监控、快速诊断方法与新型双价疫苗之研究[D].中国台湾:国立成功大学,2006:4-27.
[14]Zheng F Y,Lin G Z,Qiu C Q,et al.Serological detection of bovine ephemeral fever virus using an indirect ELISA based on antigenic site G1 expressed in Pichia pastoris[J].Vet J,2010,185(2):211-215.
