不同电融合参数及融合液对昆明小鼠2-细胞胚胎融合及囊胚率的影响
2012-09-26赵云程黄俊成
周 川,赵云程,黄俊成*
(1.新疆动物生物技术重点开放实验室,农业部草食家畜繁育生物技术重点开放实验室,新疆乌鲁木齐830000;2.新疆农业大学农学院,新疆乌鲁木齐830052)
细胞融合技术在研究哺乳动物配子发生、发育、核质关系、四倍体的发生、遗传、免疫机制等方面有重要的价值[1],也有助于获得全部来自胚胎干细胞和多功能诱导干细胞的小鼠[2-3]。制作四倍体胚胎具有3种方法,即药物处理,使DNA加倍;采用显微注射技术将一个二倍体胚胎的细胞核注射到另一个二倍体胚胎中;卵裂球融合法,如电融合法[4-6]、仙台病毒法[7]、化学药物法[1,8]等,其中电融合法最为常用。电融合的原理是在2-细胞胚胎的卵裂球结合面上施加直流电脉冲,使细胞膜造成穿孔而发生融合。
1 材料与方法
1.1 材料
1.1.1 小鼠、试剂和仪器 昆明小鼠和ICR小鼠购于新疆实验动物研究中心、甘露醇 M1902-500G、蔗糖S1888-500G、胚胎移植水 W1503、NaCl S5836、Na2HPO4S5136、KH2PO4P5655、KCl P5405、M16 M7292均为Sigma公司产品。电融合仪为FHK Fujihira industry 产品,体视镜 SMZ645、倒置镜TE2000-U为 Nikon产品、胎牛血清16000-044为GIBCO公司产品,捡胚和冲胚针自制,培养箱371为Thermo公司产品,PMSG为宁波市激素制品有限公司产品,HCG为宁波第二激素厂产品、35 mm培养皿430165为Corning公司产品。
1.1.2 配液 PBS:NaCl为4 g,KCl为 0.1 g,KH2PO4为0.1 g,Na2HPO4为0.572 16 g;移植液、冲胚液:PBS∶胎牛血清=9∶1;0.3 mol/L甘露醇融合液:0.273 g甘露醇溶于5 mL胚胎移植水,0.3 mol/L蔗糖融合液:0.513 g蔗糖溶于5 mL胚胎移植水。
1.2 方法
1.2.1 供体及受体超排 新购小鼠进入光周期,9:00~21:00为光照期,其余时间为黑夜。雌鼠育饲至25 g左右控制食量使其体重保持在25 g左右,昆明白雌鼠做供体,ICR雌鼠做受体。供体每天19:00每只雌鼠注射5 IU PMSG,46 h~48 h每只雌鼠注射5 IU HCG,并与雄鼠合笼,受体与结扎雄鼠合笼。受体的超排和合笼均比供体晚24 h。合笼的第2天早晨查栓,见栓的供体从输卵管冲2-细胞胚胎,见栓的受体做代孕雌鼠。雌雄小鼠均为8周龄~12周龄。
1.2.2 2 -细胞胚胎的获取 见栓的供体在注射HCG后43 h~50 h内颈椎脱臼处死,打开腹腔将输卵管和卵巢一起剪下,放入盛有冲胚液的35 mm培养皿中,将输卵管从卵巢上剥离。将冲胚针吸入一定量的冲胚液,针口插入输卵管伞部冲出2-细胞胚胎,并用捡胚针收集2-细胞胚胎,过M16液滴3次后放入M16液滴,放入培养箱待用。
1.2.3 2 -细胞融合及观察 收集的胚胎过3次融合液滴后置于充满融合液的电极槽内,并手动拨动胚胎使胚胎的方向与两电极垂直[9]。融合液采用0.3 mol/L甘露醇,电融合参数为AC 120 V/mm 20 μs×2、AC 100 V/mm 40μs×2、AC 80 V/mm 80 μs×2。融合后的胚胎过M16液滴3次并放入M16液滴,放入培养箱培养。
1.2.4 移植 将发育至囊胚的四倍体胚胎移植入同期代孕雌鼠子宫。将代孕雌鼠麻醉,背部开口取出子宫的一角,用1 mL注射器针头在子宫上打孔。用捡胚针捡取囊胚过移植液滴3次后通过子宫上的孔将囊胚移入代孕雌鼠子宫内。将代孕雌鼠缝合,给足鼠料和水,置于温暖处。
2 结果
每30 min在体视镜下观察一次融合后的胚胎(图1A),将融合的胚胎挑出并计数,连续观察数天,将发育至囊胚的胚胎挑出并计数((图1B~E)。
2.1 电融合液为0.3 mol/L蔗糖溶液的电融合及发育结果
本组试验采用120 V/mm,20μs×2;100 V/mm,40μs×2;80 V/mm,80μs×2三种电融合参数。在120 V/mm,20μs×2电融合参数下共处理12枚2-细胞胚胎,仅得到1枚融合胚,融合率为8.3%,此融合胚没有继续发育。在100 V/mm,40 μs×2电融合参数下共处理25枚2-细胞胚胎,其中13枚融合,融合率为52%,5枚卵裂,卵裂率为38.5%,仅2枚发育至囊胚,囊胚率为40%。在80 V/mm,80μs×2电融合参数下共处理22枚2-细胞胚胎,其中17枚融合,融合率为77.3%,有11枚融合胚卵裂,卵裂率为64.7%,7枚发育至囊胚,囊胚率为63.6%(表1)。
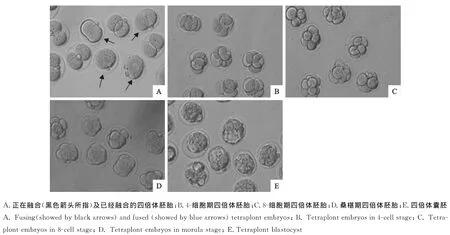
图1 不同时期四倍体胚胎Fig.1 Tetraplont embryos in different stages

表1 融合液为0.3 mol/L蔗糖溶液Table1 The electrofusion solution is 0.3 mol/L sucrose solution
2.2 电融合液为0.3 mol/L甘露醇溶液的电融合及发育结果
本组试验采用120 V/mm,20μs×2;100 V/mm,40μs×2;80 V/mm,80μs×2三种电融合参数。在120 V/mm,20μs×2电融合参数下共处理26枚2-细胞胚胎,得到18枚融合胚,融合率为69.2%,得到的18枚融合胚全部卵裂,卵裂率为100%,其中2枚发育至囊胚,囊胚率为11.1%。在100 V/mm,40μs×2电融合参数下共处理24枚2-细胞胚胎,其中23枚融合,融合率为95.8%,19枚卵裂,卵裂率为82.6%,12枚发育至囊胚,囊胚率为63.2%。在80 V/mm,80μs×2电融合参数下共处理320枚2-细胞胚胎,其中296枚融合,融合率为92.5%,有288枚融合胚卵裂,卵裂率为97.3%,261枚发育至囊胚,囊胚率为90.6%(表2)。
2.3 四倍体囊胚在体内发育
共为4只代孕雌鼠移植55枚四倍体胚胎,超过预产期均未产下幼仔。断颈处死4只代孕母鼠解剖后仅得到1只死亡的畸形胎儿。

表2 融合液为0.3 mol/L甘露醇溶液Table2 The electrofusion solution is 0.3 mol/L mannitol solution
3 讨论
在三种电融合参数下,采用甘露醇溶液做融合液所获得的融合率、卵裂率、囊胚率均高于相同电融合参数下采用蔗糖溶液做融合液所获得的融合率、卵裂率、囊胚率,说明甘露醇溶液能在电融合过程中更好地保护胚胎。
采用相同的融合液,在不同的电融合参数下融合率、卵裂率、囊胚率都有所不同。在两种融合液下,随着脉冲电压的降低和脉冲宽度的提升,融合率、卵裂率、囊胚率都显著提升,即在较高脉冲电压下(120 V/mm),即使脉冲宽度很短(20μs)也不会获得很好的融合率和发育率,而在较低脉冲电压下(80 V/mm),即使延长脉冲宽度(80μs)也能获得高的融合率和发育率。
电压强度是影响融合率的重要因素[10]。在电融合过程中,2-细胞胚胎的两个卵裂球之间的细胞膜在电场作用下破裂并相互融合[11],电压过高会造成胚胎的死亡[12],而电压过低则不能使细胞膜破裂,2-细胞胚胎不能融合。
小鼠四倍体胚胎在囊胚之前的发育速度与二倍体胚胎相似,但所包含的细胞数量少于二倍体胚胎[13],在之后的发育中,四倍体胚胎发育的速度要慢于二倍体胚胎的发育速度。Lu T等[14]将小鼠四倍体胚胎与二倍体胚胎嵌合,嵌合体幼仔具备四倍体细胞,但在发育过程中四倍体细胞逐渐消失,其原因可能是四倍体细胞的细胞周期比二倍体细胞的细胞周期要长,分裂速度比二倍体细胞慢,在发育过程中逐渐被二倍体细胞替代。四倍体胚胎在发育过程中逐渐死亡,其原因可能是其分裂速度慢,没有足够数量的细胞支持发育的整个过程。Kato Y等[15]将两个小鼠四倍体胚胎整合,使四倍体胚胎的数目达到二倍体胚胎的水平,但四倍体胚胎仍不能完全发育,推测其失败原始可能是四倍体细胞有较长的细胞周期。
[1]Snow M H.Tetraploid mouse embryos produced by cytochalasin B during cleavage[J].Nature,1973,244(5417):513-515.
[2]Ishiguro N,Kano K,Yamamoto Y,et al.Tetraploid cells of enhanced green fluorescent protein transgenic mice in tetraploid/diploid-chimeric embryos[J].J Reprod Dev,2005,51(5):567-72.
[3]Zhao X Y,Li W,Lv Z,et al.iPS cells produce viable mice through tetraploid complementation[J].Nature,2009,461(7260):86-90.
[4]Kubiak J Z,Tarkowskia K.Electrofusion of mouse blastomeres[J].Exp Cell Res,1985,157(2):561-566.
[5]Kaufman M H,Webb S.Postimplantation development of tetraploid mouse embryos produced by electrofusion[J].Development,1990,110(4):1121-1132.
[6]Wilmut I,Schnieke A E,Mcwhir J,et al.Viable offspring derived from fetal and adult mammalian cells[J].Nature,1997,385(27):810-813.
[7]O'Neill G T,Speirs S,Kaufman M H.Sex-chromosome constitution of postimplantation tetraploid mouse embryos[J].Cytogenet Cell Genet,1990,53(4):191-195.
[8]Edwards R G.Colchicine-induced heteroploidy in the mouse.II.The inducetion of tetraploidy and other types of heteroploidy[J].J Exp Zool,1958,137(2):349-362.
[9]Tan J H,Zhou Q,Zhang Q M,et al.Factors affecting electrofusion of 2-cell mouse embryos[J].Thcriogenology,1994,55(4):173-181.
[10]Suo L,Wang F,Zhou G B,et al.Optimal concentration of calcium and electric field levels improve tetraploid embryo production by electrofusion in mice[J].J Reprod Dev,2009(4):383-385.
[11]Mc Laughlin K J.Production of tetraploid embryos by electrofusion[J].Methods Enzymology,1993,225:919-929.
[12]Cheong H T.Effect of various electric field on the fusion and in vitro development of mouse two cell embryos[J].Theriogenology,1991,36(5):875-885.
[13]Eglitis M,Wiley L M.Teraploidy and early development:effects on developmental timing and embryonic metabolism[J].J Embryol exp Morph,1981,66:91-108.
[14]Lu T,Markert C L.Manufacture of diploid/tetraploid chime-ric mice[J].Proc Natl Acad Sci USA,1980,77:6012-6015.
[15]Kato Y,Ohguro T,Tsunoda Y,The viability of mouse tetraploid mebryos produced by electron fusion at 2-cell stage[J].Anim Sci Technol(Jpn),1992,63:157-161.
