猪链球菌2型溶血素基因缺失株构建及其生物学特性分析
2012-09-26张晓燕唐宇龙方丽华方维焕
吴 炜,张晓燕,唐宇龙,方丽华,方维焕
(浙江大学动物预防医学研究所,浙江省动物预防医学重点实验室,浙江杭州310058)
猪链球菌2型(Streptococcus suis 2,SS2)是猪链球菌各个血清型中毒力最强、流行最广泛的血清型,是重要的人兽共患病病原[1]。猪链球菌溶血素(suilysin,SLY)是较早确定的猪链球菌毒力因子之一,属巯基活化的溶细胞素家族(thiol activated cytolysin group,TACY)溶血素,序列分析表明SLY具有该家族的同源保守序列,且此序列与细菌的溶血活性有重要关系。Staats J J等[2]报道19株链球菌2型菌株中有5株SLY为阳性,而这5株菌都是高毒力株,而其他SLY为阴性的菌株都是低毒力或无毒力株。研究表明,溶血素可以增强SS2对上皮细胞的侵袭和裂解能力[3];溶血素阳性菌株的黏附和细胞毒性在脑膜炎过程中起作用[2]。对溶血素基因分析表明,强毒力菌株大多携带sly基因,而低致病力菌株不溶血,且其5′端多有突变或缺失[4]。
本研究利用pSET4S温敏性自杀质粒,通过同源重组方法构建sly基因缺失株,分析突变株的生物学特性,为进一步研究SLY介导SS2的感染生物学机制奠定基础。
1 材料与方法
1.1 材料
猪链球菌2型分离株1105为浙江省动物预防医学重点实验室于2008年分离自病猪肺脏的强毒株;E.coli DH5α由浙江省动物预防医学重点实验室保存;pSET4S质粒由日本国家动物健康研究所(National institute of animal health,Japan)Daisuke Takamatsu博士惠赠;脑微血管内皮细胞Bend3和小鼠单核巨噬Raw246.7为浙江省动物预防医学重点实验室保存;脑心浸出液培养基(Brain heart infusion,BHI),Tryptone和 Yeast extraction为OXOID公司产品;氯霉素和大观霉素为上海生工生物工程技术服务有限公司产品;引物由上海Invitrogen生物技术有限公司合成;DNA割胶回收和纯化试剂盒为Axygen公司产品;质粒抽提试剂盒为北京全式金生物技术有限公司产品;T4连接酶和DNA限制性内切酶均为Takara公司产品;雌性Balb/c小鼠购自浙江省中医院动物试验中心。
1.2 方法
1.2.1 同源重组质粒的构建
1.2.1.1 自杀载体元件的PCR扩增 构建重组质粒pSET4S::cat-ΔSly:根据 NCBI上猪链球菌2型P1/7标准株的基因(NC-012925.1)中的 Sly序列(1258902-1262814)设计引物(表1)。PCR反应条件及体系:10×buffer 3μL,10 mmol/L d NTP 1.0 μL,上游引物 1.0μL,下游引物1.0μL,template 2.5μL,super Tag 0.5μL,dd H2O 21μL。PCR反应程序为:94℃3 min;94℃30 s,54℃40 s,68℃90 s,30个循环;68℃继续延伸10 min。PCR产物用10 g/L琼脂糖凝胶电泳检测。
1.2.1.2 自杀载体元件的酶切和连接 用引物Sly-1/Sly-2和Sly-3/Sly-4分别扩增Sly-5′和Sly-3′片段,PCR扩增产物割胶回收纯化后,分别用引物Sly-1/4进行融合PCR扩增。割胶产物片段用Eco RⅠ和SphⅠ双酶切3 h,再回收纯化,得到的片段和经过相对应双酶切处理的pSET4S用T4连接酶过夜连接,构建自杀质粒pSET4S-ΔSly。用引物CH1/CH2从p MD18T-cat中PCR扩增cat基因,Eco T22I酶切处理pSET4S-ΔSly与cat基因PCR产物,用T4连接酶过夜连接,构建得到带cat基因的pSET4S:cat-ΔSly(图1)。

表1 构建重组自杀载体所用PCR引物Table1 Primers used for construction recombinant suicide vector

图1 pSET4S:cat-Δsly质粒构建示意图Fig.1 Schematic representation of the procedures for construction of pSET4S:cat-Δsly
1.2.1.3 自杀质粒的鉴定和测序 将pSET4S:cat-ΔSly转化至E.coli DH5α感受态细胞,选择含抗性Spc 50μg/mL,Cm 8μg/mL的LB固体培养基筛选阳性克隆,并送上海Invitrogen生物技术有限公司测序。
1.2.2 猪链球菌2型菌株感受态的制备与电转参考 Takamatsu D等[5]SS2感受态的制备方法,电转条件为2 500 V、25 m A和200Ω。将pSET4S:cat-ΔSly电转至SS2-1105菌株内,利用含抗性Spc 100μg/mL和Cm 4μg/mL的BHI平板筛选阳性菌株,进行PCR扩增,鉴定并比较同源臂片段大小。
1.2.3 插入cat抗性基因法同源重组筛选sly基因缺失株 将鉴定电转成功的SS2菌株,先于含Spc和Cm抗性BHI培养基中28℃培养16 h至对数生长期中期,然后1∶1 000转接至新鲜的只含Cm抗性BHI培养基中,28℃培养6 h至对数生长期早期,将细菌从28℃培养箱移至37℃培养箱继续培养,4 h后取100μL涂板(只含Cm抗性BHI平板),37℃培养过夜,24 h后挑斑PCR鉴定(鉴定Spc抗性基因是否消除和比较同源臂片段大小),构建得到以SS2-1105为亲本株的sly基因缺失株,即SS2-1105-Δsly。插入cat的sly基因片段临近区域再经PCR鉴定和测序验证(鉴定引物P1:AGCTTGA CTTACGAGCCACAAG AG;P2:CCACCATTCCCAAGCTAAT CCTGT,可以扩增亲本菌株完整的sly-ORF)。
1.2.4 体外溶血试验 根据 Ono T等[6]建立的方法加以改进,测定突变株与亲本株在全血中的溶血活性。方法如下:①从绵羊血中分离红细胞,配成50 mL/L的 RBC-1640悬液;②取5 mL 37 ℃过夜培养物5 000 r/min离心6 min收集菌体,用灭菌10 mmol/L PBS洗两遍,用适量PBS重悬细菌,调整菌株浓度至109cfu/mL;③取10μL细菌悬液(即实际细菌量在107cfu左右)与500μL浓度为50 mL/L RBC-1640悬液加入 EP管中,2000 r/min离心2 min后,37℃静置培养。每个菌株设3个平行,每1 h为一组,共设6组(包括0 h组),每组设阴性与阳性对照各3管(用PBS代替细菌悬液)。每隔1 h取出一组,在阳性对照中加入Triton X-100至终浓度2 mL/L,剧烈震荡后12 000 r/min离心1 min,取上清200μL测定OD570 nm值;其余处理管温和颠倒混匀后12 000 r/min离心1 min,取上清200μL测定OD 570 nm值。样品与相应时间点阴性OD 570 nm值分别取平均值后的差值作图。
1.2.5 对Bend3脑血管内皮细胞毒性试验Bend3细胞为鼠源的脑血管内皮细胞,培养于含100 mL/L胎牛血清的1640培养基,铺于96孔细胞培养板中,4×104/孔~6×104/孔。亲本株及缺失株复苏后,1∶100转接至新鲜BHI培养基中,培养3 h~4 h至对数生长期中期,用灭菌的10 mmol/L PBS洗两遍,调节 OD 600nm值至0.5左右,10倍稀释于1640基础培养液中,每孔加入100 μL含细菌的培养液(加入菌液前,细胞先弃上清,后用用温浴灭菌的10 mmol/L PBS清洗细胞3遍),使细菌与细胞的MOI为1∶1 000。37℃体积分数为5%的CO2培养,设立自身释放LDH的阴性对照与裂解细胞的阳性孔,每加样孔3个平行。在1 h和2 h培养后,吸取50μL细胞上清液至96孔微量反应板,加入底物显色液50μL,黑暗反应30 min,再加入50μL反应终止液,490 nm酶标仪进行检测读数。细胞毒性的计算方法:(试验孔值-细胞LDH自身释放值)/(细胞完全裂解释放LDH阳性值-细胞LDH自身释放值)×100%。
1.2.6 在Raw246.7巨噬细胞中存活力 用含100 mL/L胎牛血清的1640培养基培养Raw246.7细胞,铺于24孔培养板中,2×105个/孔~4×105个/孔。亲本株及突变株复苏后,按上述方法培养和洗涤,调节OD 600 nm至0.5左右,10倍稀释至含100 mL/L胎牛血清的1640细胞培养液中,每孔加入500μL含细菌的培养液,使细菌与细胞的MOI为1∶100。在37℃、体积分数为CO2培养箱中培养45 min后弃去细胞孔中液体,用温浴灭菌的10 mmol/L PBS清洗细胞3遍,加入终浓度为100μg/mL庆大霉素的1640培养基,在37℃、体积分数为5%的CO2培养箱中培养1 h后,弃去上清,用温浴灭菌的10 mmol/L PBS清洗细胞3遍,加入含100 mL/L的胎牛血清的1640细胞培养,在37℃、体积分数为5%的CO2细胞培养箱内继续放置1、2、3 h。处理完的孔先用PBS洗细胞3遍,后用100μL胰酶处理10 min,再用冰浴的灭菌蒸馏水使细胞裂解,裂解液10倍连续稀释后,去适当稀释度的菌液进行平板计数。
2 结果
2.1 同源重组质粒和sly基因缺失突变SS2菌株的鉴定
用于同源重组的自杀质粒pSET4S:cat-Δsly,用PCR扩增同源臂片段(引物Sly-1/4)进行鉴定,大小为3 523 bp,比SS2基因组的同源片段短约390 bp(图2)。重组质粒转化到E.coli DH5α中,提取质粒对目的片段进行测序,与参考菌株菌株P1/7的基因序列(NC-012925.1)同源性98.5%以上,表明目的片段已经成功克隆于载体。
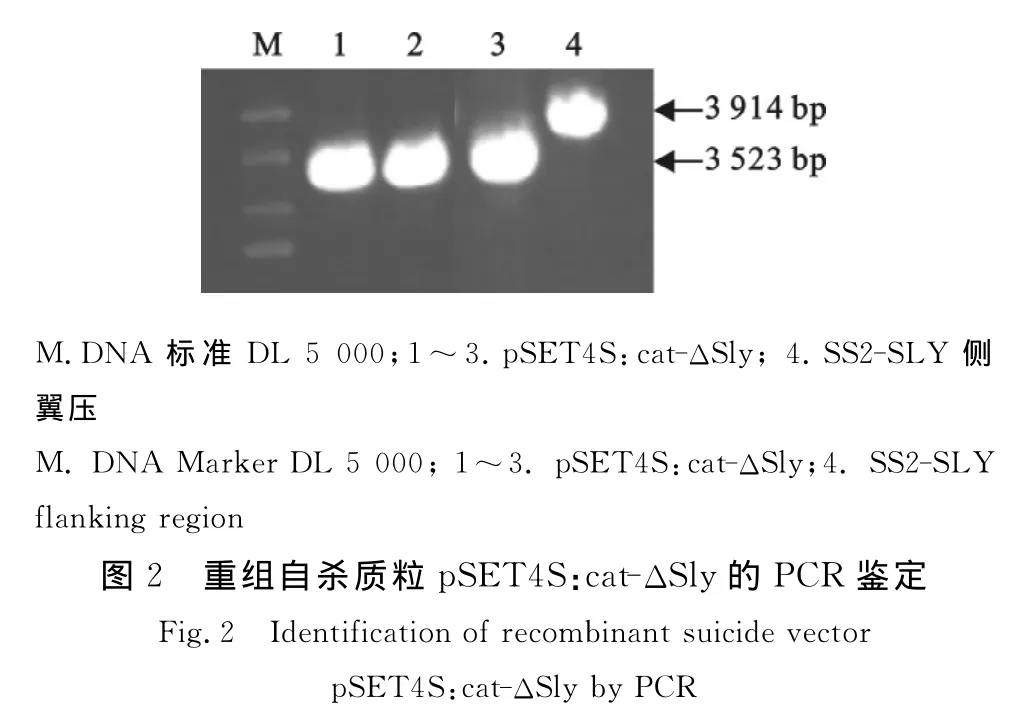
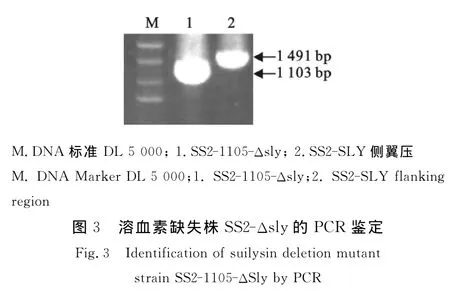
通过28℃和37℃细菌传代后质粒凋亡,同源重组完成,突变株通过PCR扩增鉴定(图3)。用sly两侧特异引物扩增亲本菌株的ORF片段为1 491 bp,而SS2-Δsly突变株扩增携带有cat基因和部分sly基因片段为1 103 bp(图4),经序列测定和分析,扩增片段内含cat基因。
2.2 缺失突变株SS2-1105-ΔSly体外溶血活性消失、细胞毒性显著降低
图4表明,亲本株的溶血活性从0 h时刻到2 h时持续升高,而sly基因缺失株的溶血消失。突变株SS2-1105-ΔSly对小鼠脑微血管内皮细胞的细胞毒性显著低于亲本株(图4),说明溶血素是SS2对Bend3细胞产生损伤的主要毒力因子。
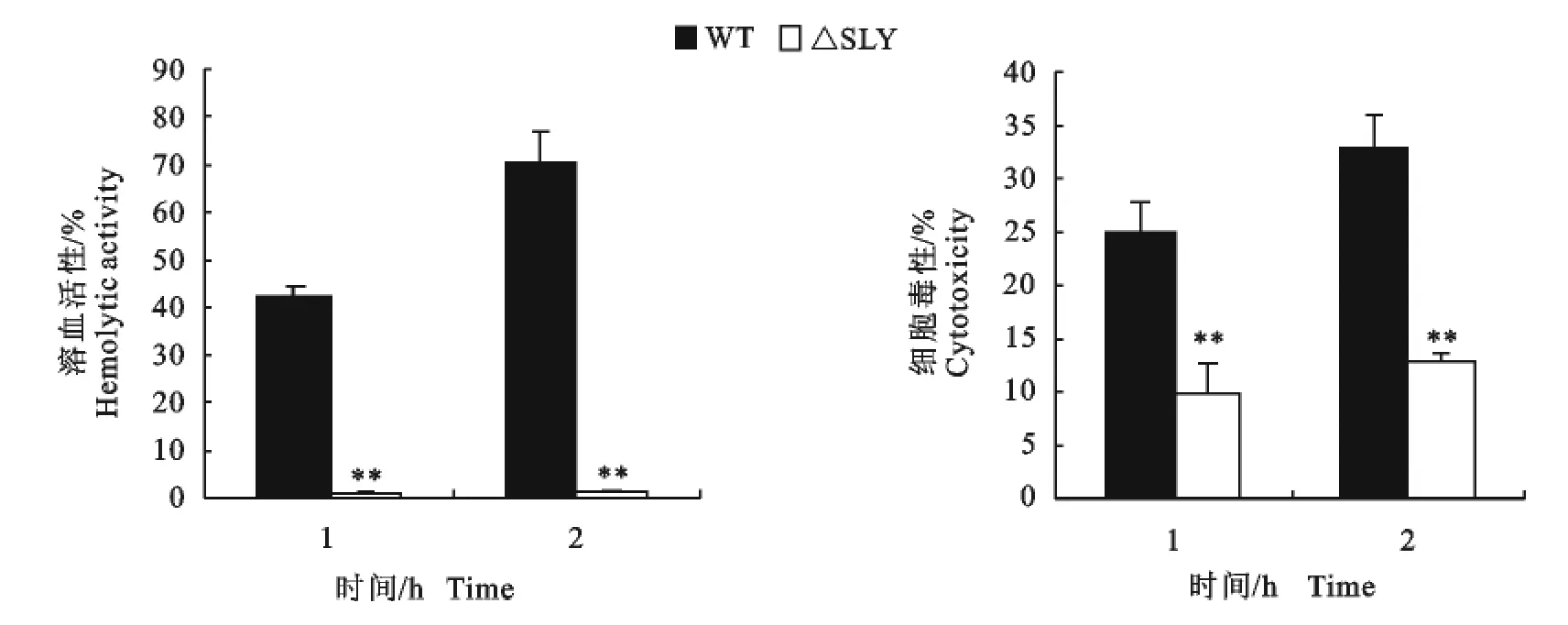
图4 溶血素缺失株SS2-ΔSly与亲本株体外溶血活性(左)和细胞毒性(右)比较Fig.4 Comparison between sly deletion mutant and its wild-type strain in hemolytic activity(left)and cytotoxicity(right)
2.3 缺失株SS2-1105-ΔSly在 Raw246.7细胞中的存活力
将各时间点的细菌数除以相对应菌株0时刻(庆大霉素处理1 h)的起始细菌总数,得到对应的细菌在巨噬细胞内的存活率。SS2亲本菌株在Raw246.7细胞中的存活率随共培养时间的增加逐渐降低,溶血素基因缺失株在细胞中的存活能力并没明显变化(图5),初步表明溶血素不影响对SS2在巨噬细胞中的存活。
3 讨论
猪链球菌2型是重要的人兽共患致病菌,但其致病机制还不完全清楚[7],研究表明猪溶血素SLY在其致病过程中起重要作用,是一种重要的毒力因子[8]。SLY对不同的上皮细胞系,脑微血管内皮细胞和巨噬细胞等有细胞毒性。SLY可能在猪链球菌致脑膜炎过程中起作用,但具体的作用机制还不清楚[9]。

图5 溶血素缺失株SS2-ΔSly与亲本株在RAW264.7巨噬细胞内存活力比较Fig.5 Comparison between sly deletion mutant and its wild-type strain in survival within macrophage cell line RAW264.7
猪溶血素还是良好的保护性抗原[10]。Jacobs A A等[11]将猪链球菌2型的SLY提纯后免疫Balb/c小鼠,小鼠得到了完全的免疫保护,证明SLY具有重要的免疫保护作用,并推测猪链球菌2型的溶血素同时对其他类型的猪链球菌有交叉保护作用。Jacobs A A等[12]进一步将SLY与猪链球菌2型的其他细胞外抗原(extracellular antigens)对猪的免疫保护作用进行了对比,证实SLY的免疫保护作用要明显优于不含溶血素的其他细胞外抗原。Institut M等[13]利用天然缺失猪溶血素的2型和9型猪链球菌进行活苗的保护力试验,但结果并没有产生抗体和免疫力。Lun S等[14]研究认为,猪链球菌2型的溶血素可能并不介导细菌对呼吸系统的感染,但在刺激细胞因子释放和先天免疫过程中具有一定作用。然而,SLY在脑内感染中是否起作用,如何起作用还未见相关研究报道。
本研究利用p EST4S温敏性自杀质粒,通过同源重组和抗性基因置换构建sly基因缺失突变株,通过温度和抗性基因两个选择压力,提高了获得阳性突变株的概率,为在细胞和分子水平深入研究SLY在SS2致病中的作用奠定了基础。
[1]闽成军,刘亚彬.猪链球菌的致病性[J].动物医学进展,2010,31(2):257-259.
[2]Staats J J,Plattner B L,Nietfeld J,et a1.Use of ribotyping and haemolysin activity to identify highly virulent Streptococcus suis type 2 isolates[J].Clin Microbiol,1998,36:15-19.
[3]Lalonde M,Segura M,Lacouture S,et al.Interactions between Streptococcus suis serotype 2 and diferent epithelial celllines[J].Microbiololgy,2000,146:1913-1921.
[4]Staats J J,Plattner B L,Stewart G C.Presence of the Streptococcus suis suilysin gene and expression of MRP and EF correlates with high viulence in Streptococcus suis type 2 isolates[J].Vet Microbiol,1999,70:201-211.
[5]Takamatsu D,Osaki M,Sekizaki T.Thermosensitive suicide vectors for gene replacement in Streptococcus suis [J].Plasmid,2001,5(46):140-148.
[6]Ono T,Park K S,Ueta M,et al.Identification of proteins secreted via Vibrio parahaemolyticus typeⅢsecretion system 1[J].Infect Immun,2006,74(2):1032-1042.
[7]Poyart C,Pellegrini E,Gaillot O,Contribution of Mn-cofactored superoxide dismutase (Sod A)to the virulence of Streptococcus agalactiae[J].Infect Immun,2001,3(69):5098-5106.
[8]Fittipaldi N,Fuller T E,Teel J F,et al.Serotype distribution and production of uramidase-released protein,extracellular factor and suilysin by field strains of Streptococcus suis isolated in the United States[J].Vet Microbiol,2009,11(139):310-317.
[9]Gottschalk M,Segura M.The pathogenesis of the meningitis caused by Streptococcus suis:the unresolved questions [J].Vet Microbiol,2000,10(76):259-272.
[10]Lv Q Y,Hao H J,Bi L L,et al.Purification and biological activities analysis of Streptococcus suis serotype 2 suilysin[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2011,27,(4):374-376.
[11]Jacobs A A,Loeffen P L,van den Berg A J,et al.Identification,purification,and characterization of a thiol-activated hemolysin(suilysin)of Streptococcus suis [J].Infect Immun,1994,62(5):1742-1748.
[12]Jacobs A A,van den Berg A J,Loeffen P L.Protection of experimentally infected pigs by suilysin,the thiol-activated haemolysin of Streptococcus suis [J].Vet Rec,1996,139(10):225-228.
[13]Insitiut M,Zentum I,BIischofsholer D,et al.Intranasal immunization with a live Streptococcus suis isogenic of mutant elicited suilysin-neutralization titers but failed to induce opsonizing antibodies and protection[J].Vet Immunol Immunopathol,2009,15(132):135-145.
[14]Lun S,PereZ-Casal J,Connor W,et al.Role of suilysin in pathogenesis of Streptococcus suis capsular serotype 2 [J].Microb pathog,2003,34(1):27-37.
