小鼠生后不同发育阶段附睾组织中Crb3的表达
2012-09-26袁苏娅徐金霞卿素珠
李 静,夏 羽,袁苏娅,徐金霞,卿素珠
(西北农林科技大学动物医学院,陕西杨凌712100)
附睾作为雄性动物生殖器官的一个重要部分,是精子成熟、运输和储存的重要部位。附睾上皮细胞的吸收、分泌等功能使精子发生了一系列结构、生化和功能的改变,从而使精子成熟,获得受精和运动能力。研究表明,附睾上皮细胞间的紧密连接形成了精子成熟所必须的附睾腔微环境,是构成血-附睾屏障的结构基础[1-3]。血-睾屏障的存在限制了血液和附睾腔之间的分子运动,维持了腔内环境的稳定,以利于精子的成熟和储存。而上皮细胞的极性对于其上皮屏障功能和紧密连接形成等进程是必须的,上皮细胞的极性建立和维持主要受3种蛋白复合体的调控,即Par(Par3-Par6-aPKC)复合物、Crb(Crb-Pals-PATJ)复合物和Scribble(Lgl-Dlg-Scrib)复合物,Par-aPKC和Crumbs(Crb)复合物负责上皮细胞顶端区域形成,Scribble复合物负责基底部区域的形成,三者共同配合发挥功能[4-6]。在果蝇中只有一种Crb基因,而在人和小鼠中已确定存在Crb1、Crb2和Crb3 3个基因[7]。Crb1主要在人和小鼠的视网膜及大脑的部分区域表达;Crb2在肾和视网膜高水平表达,而在心脏、肺、胎盘中呈低水平表达;Crb3在视网膜和上皮组织中表达,并在骨骼肌和大脑有微弱的存在[7-8]。Crb3是一种小的跨膜蛋白,由120个氨基酸构成[9],较多的研究结果显示Crb3是一种重要的顶端决定因子[10-11],而且Crb3与鸟苷酸激酶Palsl、Patj相互作用,共同存在于紧密连接中,起到调节细胞紧密连接和维持上皮极性的作用[12-13]。在对斑马鱼ome及相关Crb基因和 MDCK细胞培养[14-15]研究下发现敲除Crb3将导致多核表型、纺锤体、纤毛及中心体异常,说明Crb3对细胞游离面的纤毛形成也起着重要作用。
目前,有关哺乳动物附睾的形态学研究已有资料报道[16-18],但有关附睾组织发育进程中Crb3的定位及分布规律尚未见研究报道,因此本研究对Crb3在小鼠生后不同发育阶段附睾组织中的分布定位进行研究,明确其在附睾管道上皮发育过程中的表达规律,为进一步了解Crb3在附睾生殖生理中的功能意义提供形态学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 3周龄、7周龄昆白系健康雄性小鼠购于第四军医大学实验动物中心。在室温22℃、控光条件下(14 h光照,10 h黑暗)按常规方式单笼饲养,购买后至少在实验室适应环境1周后用于试验。分别选取4周龄、8周龄、12周龄、16周龄小鼠用于试验。每周龄4只,3周至5周小鼠的体重在15 g~20 g,8周至16周小鼠体重在25 g~35 g。
1.1.2 主要仪器设备和试剂 DMIRB型荧光相差倒置显微镜,Leica RM2235型石蜡切片机,徕卡仪器设备公司产品;Motic数码显微镜,厦门麦克奥迪实业公司产品;GTK-2002自动恒温摊烤烘片机。主要试剂包括羊抗鼠Crb3(1∶100),Santa Cruz公司产品;Dy Light 488兔抗羊IgG(1∶250),EarthOx公司产品;柠檬酸盐抗原修复液和免疫荧光封闭液,福州迈新生物技术开发有限公司产品;DAPI染色剂,Sigma公司产品。
1.2 方法
1.2.1 样本采集、石蜡切片制备及染色 脱颈处死不同周龄的小鼠,取出附睾组织,固定于40 mL/L多聚甲醛。按照常规方法对固定好的附睾组织进行脱水、透明、浸蜡和包埋处理,连续切片,片厚5μm,裱片于多聚赖氨酸处理的载玻片上,共制得3套切片,其中1套按常规HE染色,以确定附睾发育的组织学特点和阳性产物反应定位;1套切片行Crb3免疫荧光组织化学染色;1套用于阴性对照,以确定本试验免疫反应的特异性。
1.2.2 免疫荧光组织化学染色程序 切片经脱蜡至水,蒸馏水浸泡2 min,PBS 5 min×3;柠檬酸抗原缓冲液微波修复、冷却至室温,PBS 5 min×3;室温封闭2 h,PBS洗5 min×3;一抗1∶100(羊抗鼠Crb3)4℃过夜孵育,PBS洗5 min×5,二抗1∶250(Dy Light 488兔抗羊IgG)室温避光孵育2 h,PBS洗5 min×5;DAPI避光染核约3 min~5 min,PBS洗5 min×5;抗荧光淬灭封片剂封片;DMIRB型荧光相差倒置显微镜下观察并照相。
2 结果
2.1 小鼠附睾发育的组织学特点
光镜下可见各周龄小鼠附睾外包结缔组织被膜,可见多个发育状态不同的附睾管,管壁外可见肌样上皮,具体结构如下:
生后4周,附睾管壁较厚,上皮为2层~3层的假复层纤毛柱状细胞,可见柱状细胞顶端明显的细长纤毛,管腔小而规则(图1A);6周龄附睾管管壁上皮细胞层数减少至1层~2层,上皮细胞嗜酸性增强,顶端纤毛细长;管腔明显增大,腔内可见少量的精子;管壁外层可见薄层平滑肌环绕,管之间有密集的结缔组织分布;8周龄附睾管上皮厚度增至最大,上皮细胞呈单层高柱状,管腔进一步扩大,腔内精子数量增多(图1B);12周龄附睾管上皮开始变薄,呈单层柱状,管腔继续增大,内含数量较多精子,管之间结缔组织变得致密(图1C);16周龄附睾上皮继续变薄,顶部纤毛清晰,管腔变得更大、内含大量附睾分泌物及精子,管之间间隙增大、结缔组织稀疏(图1D)。
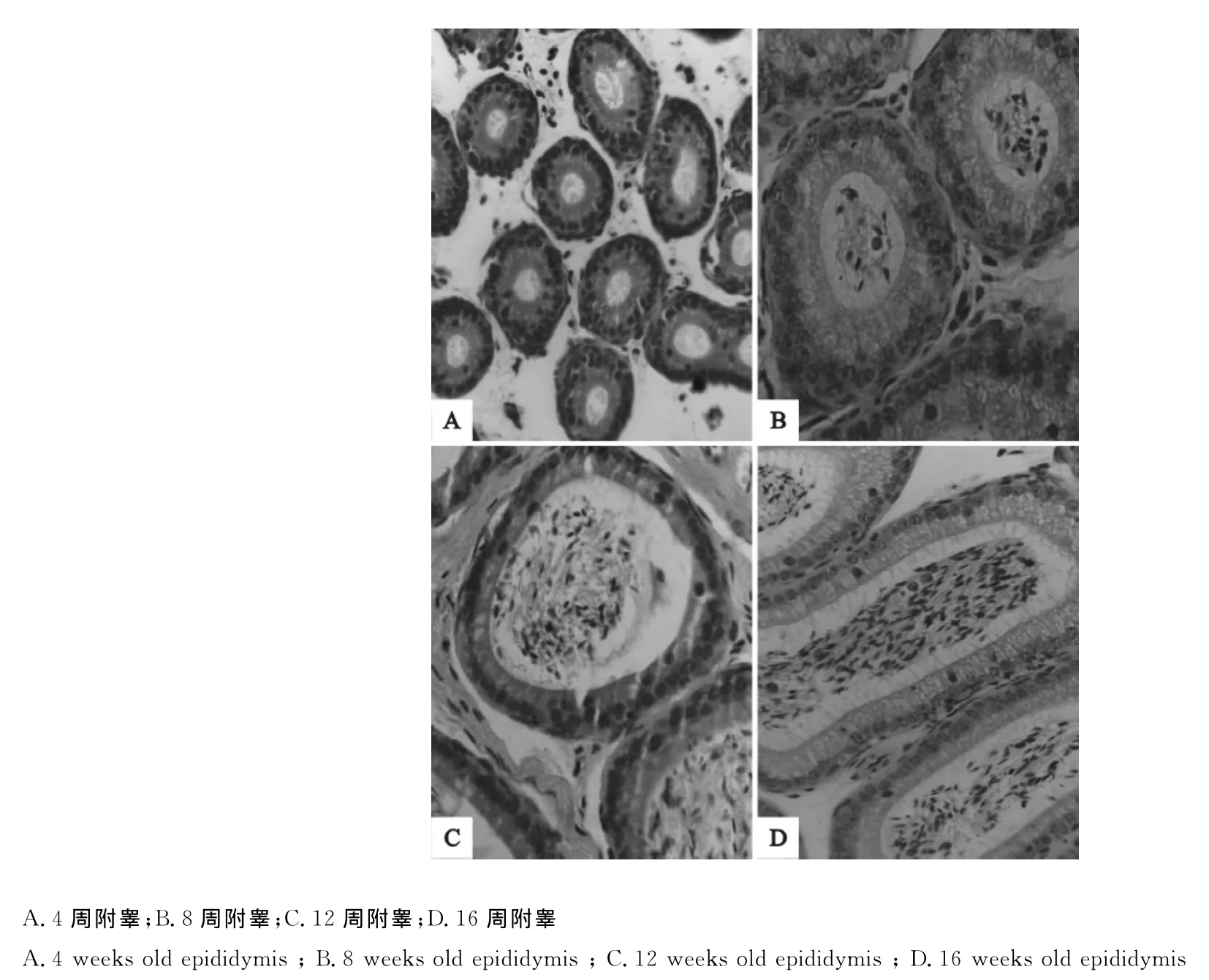
图1 不同周龄小鼠附睾的组织学结构(400×)Fig.1 Histological structure of mouse epididymis at different weeks of age(400×)
2.2 小鼠附睾组织发育过程中Crb3的表达规律
经免疫荧光染色后,Crb3阳性反应呈绿色荧光,细胞核被DAPI染为蓝色。在检测的各周龄小鼠附睾管上皮细胞胞膜上均可检测到阳性信号,阳性产物主要围绕各细胞的胞膜分布形成明显的环状,阳性产物分布随附睾发育进程呈现低-高-低-高的趋势:第4周出现Crb3的较弱表达,第6周阳性产物分布有所增强,至第8周分布达到最强;而后又开始减弱至16周又逐渐增强;另外,在12周和16周的附睾管腔中的精子尾部断面也可检测到微弱的阳性信号。
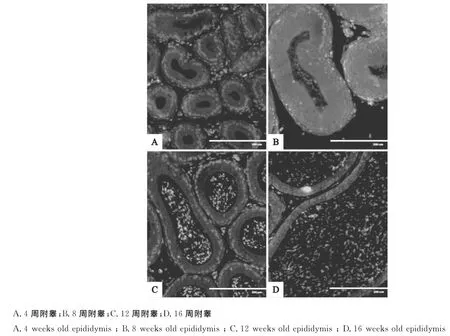
图2 Crb3在不同发育时期小鼠附睾的表达(400×)Fig.2 The expression of Crb3 in different stages of mouse epididymis(400×)
3 讨论
王建礼等[16]的研究表明,出生1 d的棕色田鼠可见管腔较大、管壁很薄的附睾管;随着发育,管腔由小增大,管壁则先增厚、然后逐级变薄。徐邦生则认为出生1 d的小鼠附睾中无明显的附睾管;随着发育,附睾管直径不断增大,上皮由厚变薄[17]。本实验结果表明,4周龄时,附睾管柱状细胞游离面的纤毛已明显可见,8周龄时附睾管腔内已有少量的精子,12周龄后附睾腔里的精子明显增多;上皮在4周龄时为假复层纤毛柱状,8周后又演变为单层柱状。已经证实,纤毛可与覆盖其上的带有负电荷的糖蛋白构成一道免疫屏障[18],可以阻止精子抗原的通过,并且可清除精子细胞脱落的胞浆,小滴或衰老、发育不良的精子,还可增加管腔内附睾上皮细胞的面积,有利于精子在附睾内环境中进行物质和液体的交换,结合本研究结果提示小鼠附睾从4周龄时开始进入青春期,8周龄时已具备成年小鼠的基本特征;随着小鼠的生长发育,附睾管的直径不断增加,管腔也在逐渐增大,并且腔内附睾分泌物与精子密度也是越来越大,而附睾上皮的厚度在8周龄时达到最厚,12周后逐渐变薄,这与徐邦生等的研究结果基本一致。
本研究在各周龄小鼠附睾管上皮细胞胞膜均检测到Crb3的阳性信号,阳性产物围绕各细胞的胞膜分布形成明显的环状,这一结果更加验证了Crb3主要存在于顶膜部位,是一种重要的顶端决定因子,主要在具有上皮源性的组织和细胞中表达,对上皮细胞的极性建立和维持发挥重要作用。并且,Crb3在第8周时附睾管上皮细胞的阳性信号最强,这可能与附睾管腔在此时较小、上皮厚度较厚,承受的压力较大,因而上皮需要大量的紧密连接有关[1]。资料显示[3],附睾上皮主细胞间的紧密连接构成了血-附睾屏障,它能有效组织大分子物质如精子抗原物质、血清蛋白等的交流,为精子成熟、获能所依赖的附睾腔提供了稳定的环境;各周龄小鼠附睾管上皮细胞胞膜呈Crb3阳性表达,说明Crb3可能参与血附睾屏障的形成。此外,在附睾发育后期的精子尾部也检测到Crb3的微弱阳性信号,精子尾部主要有鞭毛组成,其与纤毛的结构相同,而研究已经表明Crb3对纤毛的形成起着重要作用[14-15];结合本研究观察到的精子鞭毛有Crb3的表达,提示其对精子活力有一定影响。但有关Crb3是如何调控附睾管上皮细胞极性建立和维持、参与血-附睾屏障形成以及怎样影响精子成熟,尚需进一步研究。
[1]Daniel G.附睾内细胞间的相互作用:结构完整与精子成熟的重要决定因素[J].中华男科学,2001,7(6):351-357.
[2]李 琳,周利华,任冬仁,等.附睾功能及其对精子成熟的影响[J].中国畜牧兽医,2007,34(1):79-81.
[3]张宗梁.附睾的免疫学研究[J].科学通报,2005,50(19):1935-1941.
[4]Johnston D,Ahringer J.Cell polarity in eggs and epithelia:parallels and diversity[J].Cell,2010,141(5):757-744.
[5]胡轶红,徐永华.细胞极性的形成[J].细胞生物学杂志,2004,26(4):372-376.
[6]曹景利,朱学良.上皮细胞极性的建立和维持[J].中国细胞生物学学报,2010,32(2):163-168.
[7]Medina E,Lemmers C,Lane-Guermonprez L,et al.Role of the Crumbs complex in the regulation of junction formation in Drosophila and mammalian epithelial cells[J].Biol.Cell ,2002,94:305-313.
[8]Lemmers C,Michel D,Lane-Guermonprez L,et al.CRB3 binds directly to par6 and regulates the morphogenesis of the tight junctions in mammalian epithelial cells[J].Mol Biol Cell,2004,15(3):1324-1333.
[9]Laprise P.Emerging role for epithelial polarity proteins of the crumbs family as potential tumor suppressors[J].Biom Biotechnol,2011,Article ID 868217,9 pages,doi:10.1155/2011/868217.
[10]Roh M H,Fan S,Liu C J,et al.The Crumbs3-Pals1 complex participates in the establishment of polarity in mammalian epithelial cells[J].Cell Sci,2003,116(14):2895-2906.
[11]Vanessa C,Liu C J ,Margolis B.Multiple regions of Crumbs3 are required for tight junction formation in MCF10A cells[J].Cell Sci,2005,118:2859-2869.
[12]Bazellieres E,Assemat E,Arsanto J P,et al.Crumbs proteins in epithelial morphogenesis[J].Frontiers in Bioscience,2009,14:2149-2169.
[13]Makarova O,Roh M H,Liu C J,et al.Mammalian Crumbs3 is a small transmembrane protein linked to protein associated with Lin-7(Pals1)[J].Gene,2003,302,:21-29.
[14]Omori Y,Malicki J.Oko meduzy and related crumbs genes are determinants of apical cell features in the vertebrate embryo[J].Current biology,2006,16(10):945-957
[15]Fan S,Hurd T W,Liu C J,et al.Polarity proteins control ciliogenesis via kinesinmotor interactions[J].Current biology,2004,14(16):1451-1461
[16]王建礼,王慧春,邰发道.棕色田鼠睾丸及附睾胚后发育的形态学变化[J].四川动物,2010,29(2):272-276.
[17]徐邦生,蔡云平.小鼠睾丸、附睾发育过程中的形态学研究[J].交通医学,2001,15(1):14-15.
[18]徐 涛,魏 然,闵志康,等.人附睾组织形态定量测定[J].泰山医学院学报,1999,20(3):214-218.
