牛轮状病毒RT-LAMP检测方法的建立
2012-09-26袁万哲孙继国
李 巍,李 宁,袁万哲,孙继国
(河北农业大学动物科技学院,河北保定071000)
牛轮状病毒(Bovine rotavirus,BRV)属于呼肠病毒科(Reoviridae)轮状病毒属(Rotavirus)成员,该病毒由美国 Mebus C A等[1]首次分离鉴定,并证明了其对犊牛的致病性。已知牛轮状病毒是犊牛非细菌性腹泻的主要病原之一[2],可引起1日龄~7日龄犊牛的精神沉郁、食欲废绝、水样腹泻、严重脱水和酸中毒等临床症状,感染犊牛常常发生死亡,病死率高达50%。据报道加拿大魁北克地区腹泻犊牛中轮状病毒的检出率高达74.3%[3],英国犊牛轮状病毒腹泻的发病率为60%~80%,病死率为0%~50%[4],我国也有犊牛感染轮状病毒的报道。该病自报道以来,已在全世界主要养牛国家和地区普遍发生和流行,给养牛业造成相当严重的经济损失。
环介导等温扩增(loop-mediated isothermal amplification,LAMP)是由 Notomi T等[5]建立的一种新型核酸扩增技术,其原理是针对靶基因的6个区域设计4条特异性引物,利用链置换DNA聚合酶,在等温条件下进行自动循环的链置换核酸扩增反应,其产物鉴定可直接通过白色沉淀或荧光来进行判断[6]。该技术具有特异性高、操作简便、反应迅速、成本低廉等优点,目前在一些病原微生物的检测中开始被广泛应用[7-8]。本研究根据LAMP反应原理,优化相关反应条件,建立了牛轮状病毒的反转录-环介导等温扩增(RT-LAMP)快速检测方法,为牛轮状病毒的基层检测和该病防控奠定一定的基础。
1 材料与方法
1.1 材料
1.1.1 毒株、病料与细胞 牛轮状病毒(BRV)、沙门菌、猪圆环病毒2型(PCV-2)、猪繁殖与呼吸综合征病毒(PRRSV)均河北农业大学动物科技学院传染病实验室分离保存,牛病毒性腹泻病毒(BVDV)为中国兽监察所保存;腹泻犊牛粪便采集于当地牛场。Marc-145细胞由河北农业大学动物科技学院传染病实验室保存。
1.1.2 主要试剂 SYBR GreenⅠ为Solarbio公司产品;d NTPs、Taq DNA聚合酶为天根生化科技(北京)有限公司生产;MgCl2为上海生工生物工程技术服务有限公司产品;Bst DNA聚合酶为NEB公司产品;RNA酶抑制剂、反转录酶、TransZol均为北京全式金生物科技公司产品,DMEM为Gibcobrl公司产品。
1.1.3 引物的设计与合成 根据登录于GenBank的BRV VP7基因序列(GU984762.1),应用 DNA Star进行序列比对后利用Primer premier 5进行普通PCR扩增引物设计,由上海生工生物工程技术服务有限公司合成。引物序列为:
VP7S:5′-GTATGGTATTGAATATACCAC-3′;VP7A:5′-GATCCTGTTGGCCATCC-3′。
根据登录于GenBank的BRV VP7基因序列,应用DNA Star进行序列比对后利用Primer ex-plorer V4进行外引物和内引物的设计,由上海生工生物工程技术服务有限公司合成。引物序列为:
F3:5′-GCACCATACGCAACTGTA-3′;B3:5′-TGATTGACGTAATCCACTACC-3′;FIP(F1c+F2):5′-GTCTAAAACATTTGCGCCGC-AAGTTAGGACCAAGGGAGA-3′;BIP(B1c+B2):5′-TCACAGCTGATCCAACAACTACACGT GTAAAACACTTGCCACC-3′。其中 F3、B3为外引物,FIP、BIP为内引物。
1.2 方法
1.2.1 病料的处理及接种 将犊牛腹泻粪便样品用p H7.4的 PBS稀释成200 g/L 的悬液,3 000 r/min离心 20 min,取上清,加入双抗 (10 000 U/mL),将病料与50μg/mL的胰酶按1∶1混合,37℃处理1 h,接种于生长良好的Marc145单层细胞,37℃吸附1 h,其间每15 min摇匀1次,加入维持液,在37℃、体积分数为5%的CO2条件下培养观察,48 h~72 h为一个传代周期。传代前培养物冻融3次,与50μg/mL胰酶按1∶1混合,进行盲传,待细胞出现 病变(CPE)达70%收毒。
1.2.2 BRV核酸的提取 按Trizol法提取病毒RNA。取病毒液250μL,加入750μL TransZol,剧烈震荡,室温放置5 min;加入250μL氯仿,剧烈震荡后室温放置10 min,4℃下12 000 r/min离心15 min;取上清550μL转入到另一1.5 mL离心管中,加入等体积异丙醇颠倒混匀,室温沉淀15 min,4℃下12 000 r/min离心20 min;弃上清液,用750 mL/L的乙醇溶液800μL洗涤沉淀,干燥10 min~20 min后用10μL溶解液溶解RNA沉淀,溶解后于-20℃保存备用。
1.2.3 RT-LAMP反应体系的优化
1.2.3.1 RT-LAMP反应组分的优化 根据反应体系优化的策略[9],对反应组分中 Mg2+浓度、d NTPs浓度、Bst DNA聚合酶浓度、引物浓度进行优化。其他成分:反转录酶1.0μL,RNA酶抑制剂0.5μL,模板2.0μL最后用水补至25μL。
试验中将 MgCl2(25 mmol/L)的量以0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0μL依次递增;将d NTPs(2.5 mmol/L)的量以1.0、1.5、2.0、2.5、3.0、3.5、4.0 μL依次递增;将Bst DNA聚合酶 (8 U/μL)以0.5、1.0、1.5、2.0、2.5、3.0μL依次递增;在引物初浓度均为10μmol/L条件下,研究了RT-LAMP反应的引物间比例,依次按照以下比例加入外引物与内引物:0∶1,1∶0,1∶4,1∶5,1∶6,1∶7,1∶8,选择最佳浓度比。从多次重复试验中确定各组分最佳用量。
1.2.3.2 RT-LAMP的可视性观察 将反应产物中加入1μL SYBR GreenⅠ,1 min~5 min后观察结果,阳性呈绿色,阴性保持原有颜色。
1.2.3.3 RT-LAMP反应体系中反应温度的优化因为本研究所涉及的序列AT含量较为丰富,所以根据引物Tm值的变化范围,将温度按58、59、60、61、62、63、64℃依次递增,从多次重复试验中确定最佳反应温度。分别取其4μL反应产物上样于20 g/L琼脂糖凝胶电泳,观察结果。
1.2.3.4 RT-LAMP反应体系中反应时间的优化为了检测反应时间对RT-LAMP试验的影响,将反应时间依次按照10、20、30、40、50、60 min进行扩增,分别取其4μL反应产物上样于20 g/L琼脂糖凝胶电泳,选择可完成RT-LAMP反应的最佳时间。
1.2.4 RT-LAMP的特异性检测 在优化后的条件下,分别以沙门菌、牛病毒性腹泻病毒(BVDV)、猪圆环病毒2型(PCV-2)、猪繁殖与呼吸综合征病毒(PRRSV)为模板,以细胞营养液为阴性对照,同时进行RT-LAMP反应,分别取4μL反应产物用20 g/L琼脂糖凝胶进行电泳分析,观察结果。
1.2.5 RT-LAMP与 RT-PCR灵敏度的对比检测测得体外转录的RNA浓度为6.52 mg/L,将其进行倍比稀释,其浓度依次为6.52×10-1mg/L~6.52×10-16mg/L。用所建立的RT-LAMP检测方法分别对其进行扩增,同时用RT-PCR方法进行扩增,取4μL反应产物上样于20 g/L琼脂糖凝胶电泳,观察结果。
1.2.6 阳性样品的检测 将6个阳性粪样,1个阴性粪样样品和1个标准阳性样品(BRV的细胞培养液)分别经过处理提取核酸后作为模板,用优化条件后的RT-LAMP进行检测,反应产物用20 g/L琼脂糖凝胶进行电泳分析,观察结果。
2 结果
2.1 RT-LAMP反应体系的优化
2.1.1 RT-LAMP反应组分的优化 优化后的反应组分体系见表1,优化后反应结果的琼脂糖凝胶电泳见图1,可视化结果见图2。
2.1.2 RT-LAMP反应体系中温度的优化 通过对温度的优化,发现此方法进行RT-LAMP扩增反应的最适温度为62℃。在此温度下,电泳条带清晰明亮(图3)。
2.1.3 RT-LAMP反应体系中时间的优化 通过对时间的优化,发现此体系只需要20 min就能得到较淡的条带,50 min可以得到十分清晰的反应条带(图4)。

表1 RT-LAMP优化后的反应体系Table1 Reaction system of RT-LAMP after optimization




2.2 RT-LAMP的特异性试验
本研究用沙门菌、牛病毒性腹泻病毒(BVDV)、猪圆环病毒2型(PCV-2)、猪繁殖与呼吸综合征病毒(PRRSV)为对照,以细胞营养液为阴性对照,在相同的优化条件下同时进行RT-LAMP扩增,经琼脂糖凝胶电泳检测表明,只有以BRV为模板才能扩增出清晰的梯形条带,说明该方法特异性较好(图5)。
2.3 RT-LAMP与RT-PCR的灵敏性试验
从细胞培养液中提取的RNA进行连续10倍稀释,分别用RT-PCR和RT-LAMP进行灵敏性试验。细胞培养液中提出的总DNA质量浓度为6.52 mg/L,随着RNA浓度的降低,目的条带亮度逐渐变淡(图6~图),RT-LAMP能检测出的最低RNA浓度为6.52×10-8mg/L,RT-PCR能检测到6.52×10-6mg/L。结果表明,RT-LAMP 比 RT-PCR的灵敏度高100倍。



2.4 阳性样品的检测
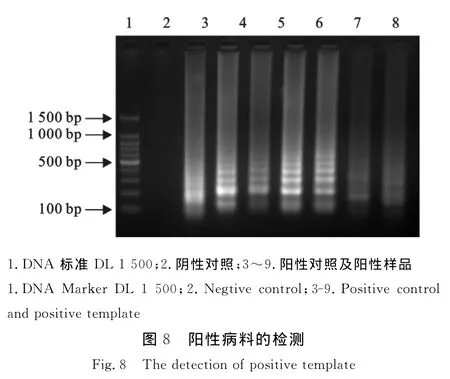
使用已建立的方法,对PCR检测呈阳性的6个阳性样品进行扩增,结果都可扩增出清晰的梯形条带。表明建立的RT-LAMP方法可以用于对BRV病料的检测(图8)。
3 讨论
轮状病毒是导致人和各种幼畜病毒性腹泻的重要病原体[10]。犊牛的轮状病毒感染十分普遍,给养殖业造成了巨大的经济损失。同时,该病又与其他细菌和病毒引起的腹泻性疾病在临床上难以鉴别,所以准确的诊断对科学防控本病具有重要意义。目前实验室检测BRV的方法有血清学抗体检测、电镜观察、ELISA、核酸探针、RT-PCR等。但是电镜观察、核酸探针的成本较高而且需要昂贵的仪器,因此不适合大规模使用;血清学抗体检测、ELISA常常受到交叉反应的影响而呈现假阳性结果;RT-PCR很有效但是耗时较长,无法做到简便快捷;Real-time PCR从灵敏度、特异性与速度上都具有一定优势,但是检测成本较高。
LAMP是日本的Notomi T等在2000年创建的检测核酸新的技术。其原理是分别针对靶序列中6个基因区段设计2对特异引物,在反转录酶和Bst DNA聚合酶的作用下对靶序列进行等温核酸扩增反应,一步完成RNA的检测。该技术因其特异性强,扩增效率高,反应灵敏,操作简单,结果肉眼可见而被国内外学者应用到多种细菌及病毒的基因检测中,如马轮状病毒(ERV)、丙型肝炎病毒(HCV)、禽流感病毒(AIV)等。但目前很少见到使用该技术检测BRV的报道。本研究所建立的RT-LAMP方法检测临床样本中BRV的结果表明,该方法具有灵敏度高,特异性强,检测程序简单快捷,不需要特殊仪器等优点,有望成为适合临床应用的新方法。
本研究选取BRV VP7的保守序列,应用Primer explorer V4设计了针对该序列保守区域的外引物和内引物,通过对反应体系、反应时间、灵敏度、特异性的优化,建立了一种针对BRV的RT-LAMP快速检测方法。该方法能特异的检测BRV,并且表现较高的灵敏度,是常规RT-PCR的100倍。其灵敏度与Imai M等[11]建立的针对H5亚型的高致病性 AIV的 RT-LAMP检测方法和 Chen H T等[12]针对PRRSV建立的RT-LAMP检测方法的灵敏度相当。而且整个反应只需要在水浴锅中50 min即可完成,真正实现了无需贵重仪器的检测。并且,通过加入荧光染料SYBR Green I,实现了 RT-LAMP技术的可视性。同时,本研究过程表明,RT-LAMP检测技术无需单独的逆转录,只需一步即可完成对靶序列的扩增,没有核酸的变性复性过程;在等温条件下进行扩增,不仅节省时间和成本,更重要的是减少了RNA酶和扩增核酸的污染机会。如果将该方法进一步优化和完善,实现多重检测,将会在犊牛腹泻的早期诊断及预防控制方面发挥重要作用。
[1]Mebus C A,Underdahl N R,Rhodes M B,et al.Calf diarrhea reproduced with a virus from a field outbreak[M].Bulletin:University of Nebraska Agricultural Experiment Station Research,1969:233.
[2]Hardy M E,Woode G N,Xu Z,et al.Comparative amino acid sequence analysis of VP4 for VP7 serotype 6 bovine rotavirus strains NCDV,B641,and UK[J].J Virol,1991,65(10):5535-5538.
[3]Hussein A H,Cornaglia E,Saber M S,et al.Prevalence of serotypes G6 and G10 group A rotaviruses in dairy calves in Quebec[J].Can J Vet Res,1995,59(3):235-237.
[4]殷 震,刘景华.动物病毒学[M].北京:科学出版社,1997:456-466.
[5]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):E63.
[6]Mori Y,Nagamine K,Tomita,et al.Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J].Biochem Biophys Res Commun,2001,289:150-154.
[7]汪一帆,郭潮潭.环介导等温扩增技术及在感染病诊断中的应用[J].中国卫生检验杂志,2008,18(9):1933-1935.
[8]Manabu N,Hiroshi I,Koji T,et al.Detection of equine rotavirus by reverse transcription loop-mediated isothermal amplification(RT-LAMP)[J].Virology,2010,72(6):823–826.
[9]夏永恒.鸡贫血病毒感染性克隆的构建及LAMP快速检测方法的建立[D].河北保定:河北农业大学,2009.
[10]何孔旺,林继煌,江杰元,等.牛轮状病毒性腹泻的研究[J].中国兽医学报,1998,18(2):224-227.
[11]Imai M,Ninomiya A,Minekawa H,et a1.Development of H5 RT-LAMP(1oop-mediated isothermal amplification)system for rapid diagnosis of H5 avain influenza virus infection[J].Vaccine,2006,146:6679-6682.
[12]Chen H T,Zhang J,Sun D H,et al.Short communication reverse transcription loop-mediated isothermal amplification for the detection of highly pathogenic porcine reproductive and respiratory syndrome virus[J].Virol Meth,2008,153(2):266-268.
