大通牦牛骨骼肌微血管密度增龄性变化特点
2012-09-26张勤文俞红贤荆海霞牛海林
张勤文,俞红贤,荆海霞,李 莉,魏 青,牛海林,薛 乾,梁 林
(青海大学农牧学院动物医学系,青海西宁810016)
骨骼肌有氧呼吸获能的水平高低,不仅与动物心血管系统的结构特征有关,而且与骨骼肌本身的微血管密度、肌细胞中肌红蛋白的含量有关,微血管密度高,可以缩短氧从毛细血管向组织弥散的距离,改善组织供氧量,是组织、细胞对低氧环境的一种适应性反应。齐新章等[1]在对高原鼢鼠和高原鼠兔的微血管密度研究后发现,尽管同为高原动物,二者的心肌微血管密度差异显著(P<0.05),这是由于二者不同生活方式造成的,高原鼢鼠骨骼肌主要以红肌纤维为主,挖掘、取食时主要依靠有氧呼吸,而不像鼠兔在躲避天敌时急速奔跑,以无氧呼吸为主,故而需要更多的氧气,而高微血管密度则为高原鼢鼠的氧气供应提高了巨大的支持。
牦牛耐劳,善走陡坡险路、雪山沼泽,有“高原之舟”之称,在高原低氧环境中运动能力极强,既有快速奔跑能力,又有持续运动能力,深入研究牦牛骨骼肌的肌纤维类型和微血管密度,将会揭示牦牛适应高原低氧环境的组织形态学特点。
1 材料与方法
1.1 材料
本研究所用试验动物分别来自于青海大通种牛场(海拔3 200 m)含四分之一野血大通牦牛(以下简称大通牦牛)和山东省莱芜地区(海拔500 m以下)平原黄牛(以下简称平原黄牛),大通牦牛和平原黄牛均选取四个年龄段(1日龄、30日龄、180日龄和成年),每个年龄段各5头,临床健康,不计性别。
1.2 方法
1.2.1 取材及样品处理 试验动物现场屠宰后立即取材。每头牛取股四头肌一块,所有试验动物取材部位相同。采取的组织40 g/L多聚甲醛固定,常规石蜡包埋,4μm间隔连续切片,明胶片贴片。
1.2.2 心肌微血管密度测定 切片常规脱蜡至水,蒸馏水冲洗3 min×3,0.01 mol/L 的 PBS冲洗3 min×3,将切片放入柠檬酸盐缓冲液中修复抗原,冷却至室温,PBS冲洗3 min×3,滴加30 mL/L H2O2室温孵育,以消除内源性过氧化物酶活性,PBS冲洗3 min×3,滴加50 mL/L的封闭液,不洗,滴加兔抗牛CD34多克隆抗体,4℃过夜。PBS冲洗3 min×3,滴加生物素化山羊抗兔工作液(1∶200)稀释,PBS冲洗3 min×3,滴加试剂SABC,室温孵育10 min。PBS冲洗3 min×3,DAB显色剂显色,在显微镜下观察显色情况,待有阳性细胞出现,且背景淡时即可用蒸馏水终止反应,酒精脱水,二甲苯透明,中性树胶封片。
切片按 Weidner N等[2]方法,每张选取热点区拍照。Olympus DP70图像采集系统(日本)取图,采用Image-Pro Plus 6.0 图像分析系统(德国)分析。
所测数据要经过校准才可进行对比,即骨骼肌微血管密度/骨骼肌表面积密度,所得比值来衡量单位肌纤维中所含微血管数的多少。
2 结果
2.1 不同发育阶段骨骼肌微血管密度的变化
现有研究中,在进行骨骼肌微血管密度的比较时,绝大多数学者均是进行动物间的横向比较,而对骨骼肌微血管密度的发育学变化较少研究。因此,为了能够准确的体现出大通牦牛和平原黄牛骨骼肌微血管密度,将单位面积内测得的微血管数与肌纤维表面积密度的比值作为衡量微血管密度的指标,相对合理和科学。
2.1.1 不同发育阶段大通牦牛骨骼肌微血管密度的变化 免疫组织化学染色切片结果见图1~图8。由表1可知,大通牦牛骨骼肌微血管密度占单位数量骨骼肌纤维的比值,随着年龄的增长,总体表现为上升的趋势,但在30日龄先降到一个相对低点,即0.819±0.045,然后逐渐升高,到成年时达到最高,即1.383±0.061。各年龄段的微血管密度与单位数量骨骼肌纤维的比值,两两相比差异极显著(P<0.01)。
2.1.2 不同发育阶段平原黄牛骨骼肌微血管密度的变化 由表1可知,平原黄牛骨骼肌微血管密度占单位数量骨骼肌纤维的比值,随着年龄的增长,总体表现为上升的趋势,但在30日龄先降到一个相对低点,即0.750±0.039,然后逐渐升高,到成年时达到最高,即1.304±0.074。各年龄段的微血管密度与单位数量骨骼肌纤维的比值,除1日龄和30日龄相比差异不显著外(P>0.05),其余各组两两相比差异极显著(P<0.01)。
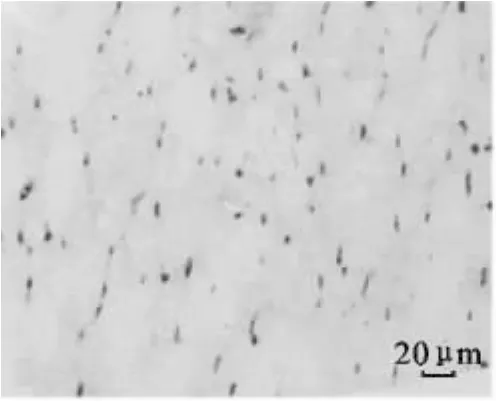
图2 30日龄大通牦牛骨骼肌CD34免疫组化染色(400×)Fig.2 Immunohistochemical staining of CD34 in skeletal muscle of Datong yak at 30 d age(400×)

图3 180日龄大通牦牛骨骼肌CD34免疫组化染色(400×)Fig.3 Immunohistochemical staining of CD34 in skeletal muscle of Datong yak at 180 d age(400×)

图4 成年大通牦牛骨骼肌CD34免疫组化染色(400×)Fig.4 Immunohistochemical staining of CD34 in skeletal muscle of Datong yak at adult(400×)
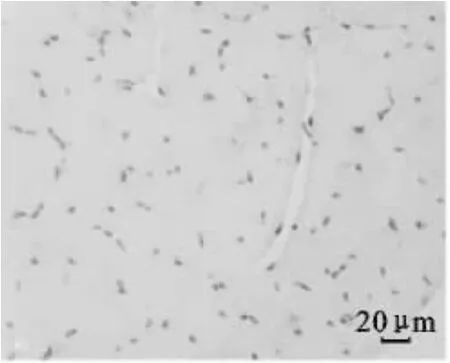
图5 1日龄平原黄牛骨骼肌CD34免疫组化染色(400×)Fig.5 Immunohistochemical staining of CD34 in skeletal muscle of plain cattle at 1 d age(400×)

图6 30日龄平原黄牛骨骼肌CD34免疫组化染色(400×)Fig.6 Immunohistochemical staining of CD34 in skeletal muscle of plain cattle at 30 d age(400×)
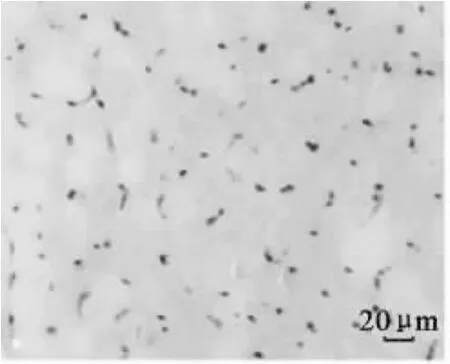
图7 180日龄平原黄牛骨骼肌CD34免疫组化染色(400×)Fig.7 Immunohistochemical staining of CD34 in skeletal muscle of plain cattle at 180 d age(400×)

图8 成年平原黄牛骨骼肌CD34免疫组化染色(400×)Fig.8 Immunohistochemical staining of CD34 in skeletal muscle of plain cattle at adult(400×)

表1 大通牦牛和平原黄牛骨骼肌微血管密度Table1 The microvessel densities in skeletal muscle of yak and cattle
2.2 同一发育阶段大通牦牛与平原黄牛骨骼肌微血管密度的比较
由表1可以看出,同一年龄阶段大通牦牛与平原黄牛骨骼肌肌纤维微血管密度两两相比时,差异极显著(P<0.01)。且均表现为随着年龄的增长,骨骼肌微血管密度总体呈现上升的趋势。
3 讨论
有学者对缺氧时骨骼肌毛细血管增生存在争议。Snyder G K 等[3]研 究 发 现,SD 大 鼠 在350 mm Hg环境生活1月后,骨骼肌微血管密度无明显变化。而 Sillau A H 等[4-5]研究后认为,慢性缺氧时,骨骼肌纤维萎缩、变细造成了微血管密度增加。黄庆愿[6]在对大鼠进行常氧对照组、单纯缺氧组和缺氧运动组的研究后指出,动物在缺氧环境下运动,使骨骼肌氧供需严重失衡,可能是引起骨骼肌微血管增生的基础。而动物单纯缺氧时,由于红细胞数的增加及肌纤维萎缩使氧的供应相对增多,而动物在缺氧环境中的活动量减少,使骨骼肌对氧的需求相对减少,这样氧的供需失衡现象不严重,因此微血管不出现增生。
本研究中,大通牦牛骨骼肌微血管密度,随着年龄的增长整体表现为上升的趋势,说明在大通牦牛发育过程中,随着骨骼肌的生长,不断增粗,运动能力的增强,骨骼肌的需氧量逐渐增大,机体通过增加骨骼肌微血管密度来增强氧的运送和利用能力。这种变化,是机体对高原低氧环境的一种适应性变化。毛细血管增生,可以缩短氧从毛细血管向组织弥散的距离,改善组织供氧量,是组织、细胞对低氧环境的一种适应性反应。组织代谢的需要与组织微血管的分布存在因果关系,组织代谢的需要决定组织微血管的密度与分布。黄庆愿[6]的研究发现,缺氧运动组骨骼肌微血管增加的同时,血管内皮生长因子的量也显著增加;单纯缺氧组骨骼肌微血管并没有显著增生,VEGF的量也未见明显变化。因此,在缺氧环境中运动,可促进微血管的增生。
在缺氧过程中,组织的需要是微血管密度增加的基础。黄庆愿报道[6],大鼠在模拟5 000 m高原4周,可见毛细血管密度增加或毛细血管与肌纤维的比值增加,出生并生长于3 500 m的大鼠心肌毛细血管与肌纤维比值可从平原的1.01增加到1.72,表明慢性缺氧条件下的运动可引起心肌毛细血管增生。本研究中,大通牦牛骨骼肌微血管密度,均比相同发育阶段黄牛高,且差异极显著(P<0.01)。主要原因是大通牦牛生活在高海拔低氧地区,为了得到充足的食物,保证自身生存的需要,在一年中随着季节的变化,逐水草而居,运动性能良好,骨骼肌在运动过程中需要大量氧气供应以满足机体需要,大通牦牛通过增加骨骼肌微血管密度来增加肌肉对氧的摄取和利用,提高适应高原低氧环境的能力。在长期对低氧环境的良好适应后,微血管密度高的特点作为生物学性状固定下来,并且通过遗传传递给下一代。
[1]齐新章,王晓君,朱世海,等.高原鼢鼠和高原鼠兔心脏对低氧环境的适应[J].生理学报,2008,60(3):348-354.
[2]Weidner N,Semple J P,Welch W R,et al.Tumor angiogenesis and metastasis-correlation in invasive breast carcinoma[J].N Engl J Med,1991,324:1-8.
[3]Snyder G K,Wilcox E E,Burnham E W.Effects of hypoxia on muscle capillarity in rats[J].Respir Physiol,1985,62:135-140.
[4]Sillau A H,Aquin L,Bui M V,et al.Chronic hypoxia does not affect guines pig skeletal muscle capillarity[J].Pflueger Arch,1980,386(1):39-45.
[5]Hoppeller H,Kleiner T E,Schlegel C,et al.Morphological adaptations of human skeletal mscle to chronic hypoxia[J].Int J Sports Med,1990,11(suppl 1):S3-9.
[6]黄庆愿.低氧习服大鼠骨骼肌毛细血管密度和血流供应的变化特点[J].中国应用生理学杂志,2001,17(3):220-223.
