手性Salen-Co(Ⅱ)络合物催化芳香酮的不对称还原反应
——推荐一个综合化学实验
2012-09-25张道牛国兴高翔
张道 牛国兴 高翔
(复旦大学化学系 上海 200433)
1 实验目的
(1) 掌握有关手性及手性化合物的相关基础知识;(2) 了解手性金属配合物在催化不对称有机反应中的应用;(3)熟悉芳香酮不对称还原反应的催化原理;(4) 掌握手性化合物的分离、分析方法。
2 实验原理
在立体化学中,手性化合物分子存在着互为镜像关系且不能完全重合的对映异构体,手性化合物的非对称性会导致偏振光的旋转,被称为光学活性。如果使偏振光的平面按顺时针方向发生偏转,则称该物质为右旋的,用正号(+)表示;反之,使偏振光的平面按逆时针方向偏转,则称该物质为左旋的,用负号(-)表示。以酒石酸为例,有3种空间结构,分别称为右旋(+)、左旋(-)和内消旋酒石酸。手性化合物的两个对映体具有数值相等但方向相反的比旋光,等量的右旋和左旋对映体混合后,旋光将彼此抵消而不具光学活性,称为外消旋体,表示为(±)或rac-。但如果一个对映体的量超过了另一个,该混合物就具有了光学活性。分子内含有相像的手性碳原子,但因具有对称因素而形成的不旋光性化合物称为内消旋体,一般在分子名称前加前缀meso-来表示。
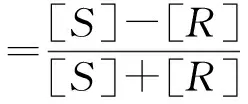
手性化合物的对映体虽然在结构上很相似,在非手性环境中物理性质(如溶解度、熔点、沸点等)也基本相同(在手性环境中不一定相同,例如,在手性溶剂中,一对对映体的溶解度就不一定相同),但所起的作用却往往大相径庭。获得光学纯的手性化合物对生物学、化学或药学都有非常重要的意义。譬如,苯并吗啡的一对对映体,其中(-)型对映体具有非常好的镇痛效果,而且不会产生药物依赖性;而(+)型对映体止痛效果很差,且长期使用易成瘾。获得光学纯化合物的方法很多,常见的有:① 拆分;② 天然产物的修饰;③ 生物转化;④ 化学剂量的不对称合成;⑤ 不对称催化等。其中化学拆分是用于分离外消旋体的一种应用最广的经典方法,大多数光学活性药物的生产均用此方法。其原理是利用具有光学活性的试剂作为拆分剂,与被拆分物作用形成溶解度差异较大的非对映立体异构体盐,将它们分离后再脱去拆分剂,便可以分别得到一对对映异构体。适用于光学拆分方法的外消旋体有酸、碱、醇、酚、醛、酮、酰胺及氨基酸。该方法得到的对映体光学纯度高,安全性好。其缺点是,通常只有一种光学对映体是有用的,从原子经济和产率的角度来看,应在尽可能早的阶段引入不对称的手性中心,以排除非预期的光学异构体,并仔细考虑简捷合成原则。
不对称催化反应可以高选择性地将潜手性和非手性底物转化为手性产品,被认为是合成具有高光学活性化合物的最有经济效益、最具发展前景的方法[1]。金属配合物催化和有机小分子催化及生物催化一道成为当今手性不对称催化的主流领域。在过去的几十年里,化学家合成了许多手性金属配合物,并用于不对称催化中,使不对称催化领域得到突飞猛进的发展。
Salen配体就是一种用途广泛的手性配体,通常由水杨醛、取代水杨醛和手性胺缩合而成。目前,主要从水杨醛上引入取代基和选择手性氨基醇和手性二胺两个方面对手性Salen金属催化剂进行结构改造。由于Salen配体的手性碳上的基团及苯环上的取代基对不对称诱导起决定性作用,相应的金属配合物在不对称催化环氧化、环氮化、环丙烷化、Diels-Alder反应、氢转移氢化,以及环氧化合物水解动力学拆分、仲醇动力学拆分等反应中,显示出了非常好的不对称诱导效果[2]。
3 实验内容
目前,以廉价的氢气为氢源,由潜手性的酮不对称加氢是制备手性醇的最好方法之一。但存在手性催化剂的膦配体不稳定以及贵金属(Ru、Rh)的流失等问题。硼氢化钠是一种较温和的氢化试剂,本实验首先拆分外消旋(±)-1,2-环己二胺得到(1R,2R)-环己二胺-L-(+)-酒石酸盐(1),与取代水杨醛缩合制备手性Salen配体(1R,2R)-LH2(2),再与钴配位形成光学活性的金属化合物((1R,2R)-L)Co(Ⅱ)(3)(图1),进一步用于催化硼氢化钠不对称还原芳香酮反应。
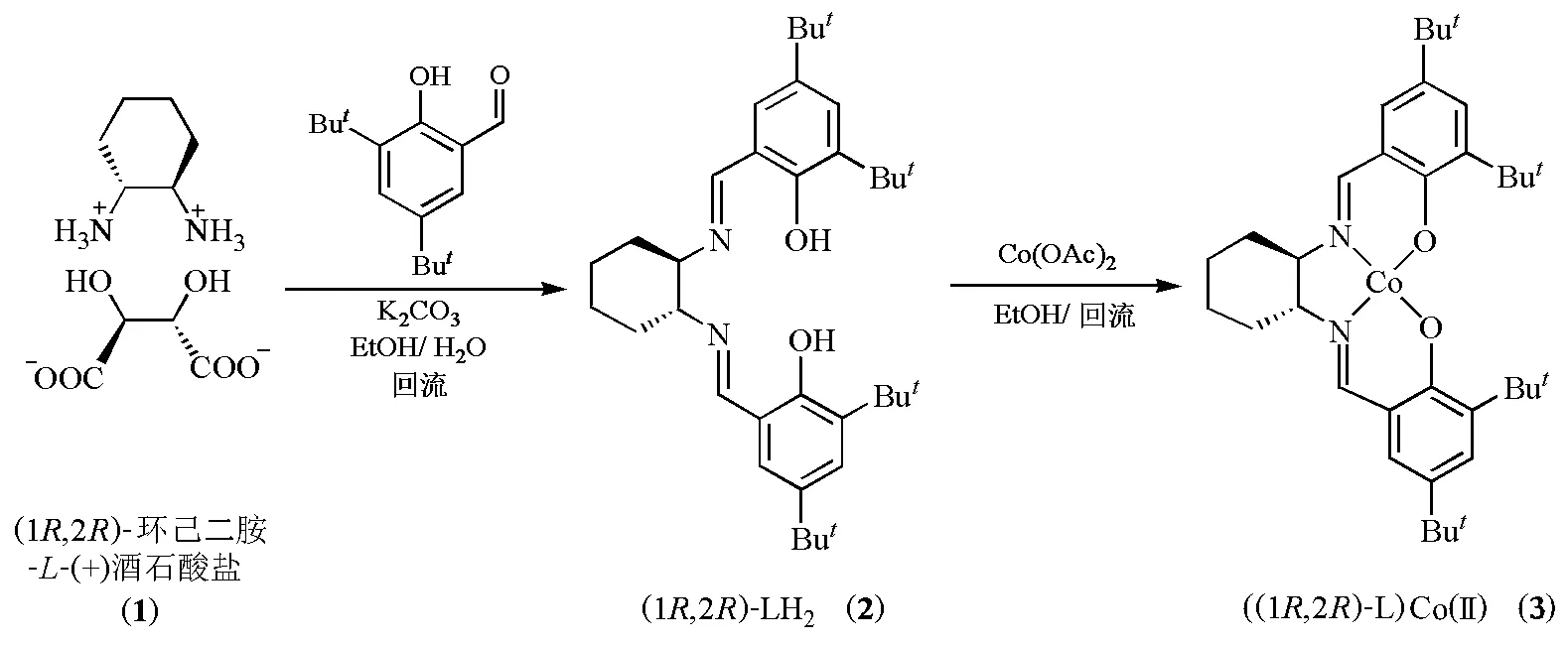
图1 手性Salen-Co(Ⅱ)配合物的合成
4 试剂与仪器
试剂:2,4-二叔丁基苯酚,三乙胺,多聚甲醛,1,2-环己二胺,L(+)-酒石酸,氢化钙,无水四氯化锡,碳酸钾,无水醋酸钴,硼氢化钠,苯乙酮,冰乙酸,甲醇,乙醇,二氯甲烷,三氯甲烷,乙酸乙酯,石油醚,盐酸,氯化钠,氯化铵,无水硫酸钠,硅胶(300~400目)。
仪器:无水无氧操作系统,TLC及柱层析设施;JNM-MY60FT型和Bruker AMX400型核磁共振仪;RUDOLPH AP IV589型旋光仪;MAGNA-R760型红外光谱仪;LAMBDA 40型紫外可见光谱仪;HP6890手性气相色谱仪。
5 实验步骤
5.1 3,5-二叔丁基水杨醛的制备
将35.8g 2,4-二叔丁基苯酚(0.2mol)溶于40mL干燥新蒸的甲苯(经氢化钙搅拌回流去水后蒸出备用)中,加入5.2g无水四氯化锡(0.02mol)、8.1g三乙胺(0.08mol),搅拌20分钟后加入13.2g多聚甲醛(0.44mmol),于100℃下反应12小时,冷却,将反应液倒入1L水中,用2mol/L盐酸酸化到pH=2左右,滤去不溶物,乙醚萃取(100mL×3),合并有机相,饱和食盐水洗涤,无水硫酸钠干燥,旋转浓缩除去溶剂,残留物用甲醇重结晶得3,5-二叔丁基水杨醛(淡黄绿色结晶;产量32.5g,产率85%)。
5.2 外消旋(±)-1,2-环己二胺的拆分[3]
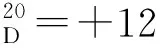
5.3 手性Salen配体(R,R)-N,N′-二(3,5-二叔丁基-水杨醛)-1,2-环己二胺(2)的合成[4]
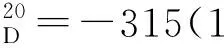
5.4 手性配合物((1R,2R)-L)Co(Ⅱ)(3)的制备[5]
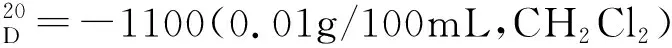
5.5 手性Salen-Co(Ⅱ)催化芳香酮不对称还原反应

5.6 手性气相色谱柱还原产物分析实验[6]
测试仪器:HP6 890气相色谱仪; 氢火焰检测器; 瓦里安公司手性毛细管柱(Chrompak CP-Chirasil-Dex CB column,25m×0.25mm,0.25μm i.d);测试条件:气化室温度250℃,检测器温度250℃,控制手性柱温125℃,每次进样1.0μL;用上述柱层析分离洗脱液上机进行对映体分离,估算产物的对映体过量值及产率(手性GC实验分离结果见图2)。
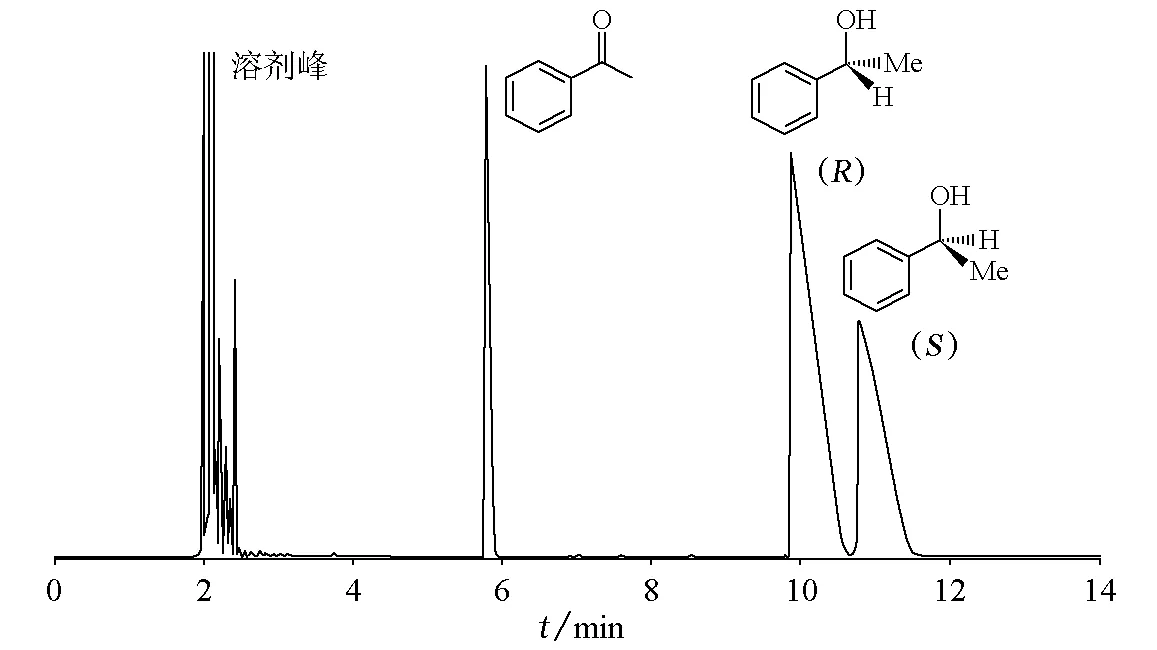
图2 手性GC色谱分离图
6 思考题
(1) 结合本实验,查阅文献并总结手性化合物的分离方法。
(2) 请查阅文献后总结本实验合成的手性配合物还可能催化哪些种类的不对称反应?
(3) 本实验中如何确定不对称反应产物的产率、顺反比例及相应的对映体过量值?
7 教学实践效果
整个实验需要两天时间,学生可以在规定的时间内灵活安排。在实验前和实验后,我们要求学生认真阅读指定的文献,以便对金属有机催化的机理和应用有一定的了解。通过该综合实验,学生都能够在教师的指导下查阅资料、设计实验细节并完成实验,写出具有个人见解的实验报告。
该实验已经在我校化学系本科高年级中开设,在06和07级本科生中连续两年4个学期运行,学生人数为40人×4=160人,不对称催化实验结果为: 产率16%~77%;对映体过量值9%~36%。
从手性Salen-Co(Ⅱ)催化剂合成及催化芳香酮不对称还原反应综合实验的教学实践来看,该实验的开设提高了学生从有机合成、手性拆分、金属有机催化剂制备、不对称催化反应到手性柱气相色谱GC分离表征系统综合实验的能力,培养了学生深入思考的思维习惯,加强了学生对金属不对称催化的认识,增进了教学实验与科学研究的衔接。这对启迪探索精神、训练科学思维、引导学生建立正确的科学观能起到积极的作用。
参 考 文 献
[1] 林国强,李月明,陈耀全,等.手性合成-不对称反应及其应用.第3版.北京:科学出版社,2007
[2] Baleizao C,Garcia H.ChemRev,2006,106:3987
[3] Larrow J F,Jacobsen E N,Gao Y,etal.JOrgChem,1994,59:1939
[4] 孙伟,夏春谷,赵培庆.化学学报,2001,59(6):976
[5] Tokunaga M,Larrow J F,Kakiuchi F,etal.Science,1997,277:936
[6] 吴兰均,李智,宓爱巧,等.色谱.1996,14(2):81
