利用简单蒸馏和分馏分离两组分液体混合物
2012-09-25熊英王晓玲侯安新
熊英王晓玲 侯安新
(武汉大学化学与分子科学学院实验中心 湖北武汉 430072)
有机化学实验不仅是对有机化学理论课的重要补充,而且是学生熟练掌握有机化学实验基本操作技能的基础性实验课程。通过该课程的学习,可使学生在实践中锻炼独立操作能力及加深对相关理论知识的理解,为以后从事科研工作打下良好基础。近年来,各高等院校越来越认识到培养高素质创新型人才的重要性,都在教学内容以及教学方式上进行着积极探索与尝试。
传统的有机化学实验教学多以训练学生的基本操作技能(比如蒸馏、萃取、过滤、重结晶、色谱、熔点测定等)为目标来设计、安排实验。这样就容易造成过分强调技能的培养,而忽视对学生化学思维的启迪。而思维的启迪是培养高素质创新型人才的一项重要内容。因此,实验内容的设计对取得良好的实验教学效果以及人才的培养显得格外重要。
蒸馏是分离、提纯液体化合物的常用方法,也是学生必须熟练掌握的基本操作之一。由于蒸馏(特别是简单蒸馏)操作简单,其实验内容的设计往往被忽视,如工业乙醇的简单蒸馏[1]。我们在教学中发现,该实验重在训练简单蒸馏操作(含沸点测定),缺乏其他分析、表征方法。实验完毕,学生容易走入误区(比如,两组分液体混合物沸点相差30℃以上,就可以用简单蒸馏分离开来;沸点稳定的液体就是纯的化合物)。这显然不符合对创新型人才培养的要求。基于以上考虑,我们重新设计了蒸馏的实验内容,意在引导学生在实验中发现问题,培养他们分析问题以及综合运用所学知识解决问题的能力。
1 实验目的
① 掌握简单蒸馏、分馏分离两组分(丙酮+正丁醇)等体积液体混合物的基本原理与方法。
② 掌握阿贝折光仪测定液态有机化合物折光率的基本原理与方法。
2 实验简介
简单蒸馏和分馏的基本原理相同,都是利用物质的沸点不同,将液体加热气化,同时使产生的蒸气冷凝液化并收集的联合操作。在蒸馏过程中,低沸点的组分先蒸出,高沸点的组分后蒸出,从而达到分离提纯的目的。简单蒸馏和分馏装置的不同只是分馏装置多一个分馏柱,液体能够在分馏柱中经多次的气化、冷凝,相当于进行多次简单蒸馏。因此,它们的应用范围及分离效果有很大差异。一般来说,液体中各组分的沸点要相差至少30℃以上,才有可能进行简单蒸馏分离;而分馏则可使沸点相近、不能用简单蒸馏分离的液体混合物得到有效的分离。
丙酮与正丁醇的沸点虽然相差较大(表1,Δt=61.2℃),但简单蒸馏丙酮与正丁醇等体积混合物,馏出物沸点从第1滴开始一直稳步上升直至正丁醇的沸点,也就是说丙酮与正丁醇并没有完全分离开来。改用分馏装置以后,能够收集到沸点稳定的两个组分,并证明它们分别是丙酮与正丁醇。
阿贝折光仪由于操作简单、容易掌握,是有机化学实验室的常备仪器。测量折光率所需的样品量少、测量精密度高,可准确到小数点后4位。因此,作为鉴定液体有机化合物的重要物理常数,折光率比沸点更为可靠。折光率不仅可以用来鉴定未知化合物,也可以用来确定液体混合物的组成。通过对丙酮-正丁醇混合液折光率和组成标准曲线的绘制,发现它们有很好的线性关系。因此,通过对简单蒸馏与分馏馏出液折光率的测定,可以从标准曲线上方便地读出馏分中各组分的含量,确定馏分的纯度。
3 实验试剂及主要仪器
实验试剂:丙酮(分析纯),正丁醇(分析纯)。
主要仪器:5mL带刻度移液管,洗耳球,50mL圆底烧瓶,蒸馏头,磨口温度计,直形冷凝管,真空尾接管,10mL量筒,长颈三角漏斗,试管(7支),沸石,电热套,变压器,升降台,WAY-2S 数字阿贝折射仪(上海申光仪器仪表有限公司)。
4 实验装置
实验所用蒸馏装置见图1。

图1 蒸馏装置
5 实验步骤
5.1 标准曲线的绘制
用带刻度的5mL移液管移取相应的试剂,按表2配制标准溶液[3]。按表1中的相关物理常数计算各标准溶液中正丁醇的质量百分数(w(正丁醇)),记录在表2中。用阿贝折光仪测定各标准溶液的折光率,记录在表2中,测定温度为25℃,折光率记为n25。以各标准溶液的折光率(n25)为横坐标,正丁醇的质量百分数(w)为纵坐标绘制标准曲线(图2)。
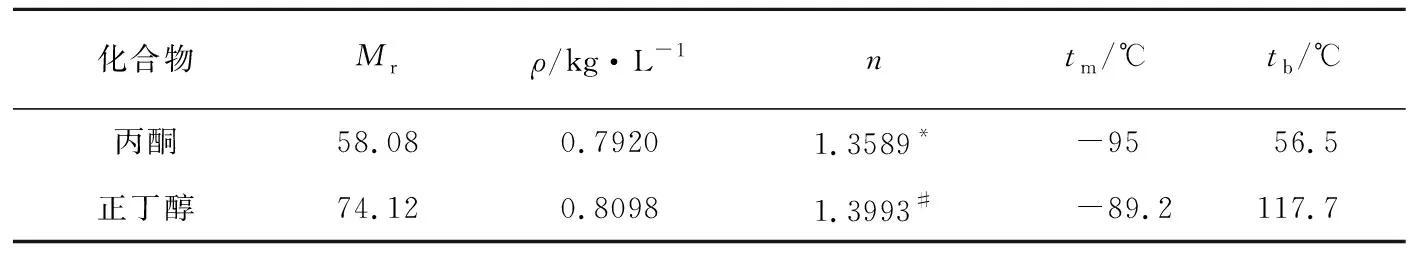
表1 化合物的物理常数[2]
*折光率为19.4℃时的测定值,#折光率为20℃时的测定值。
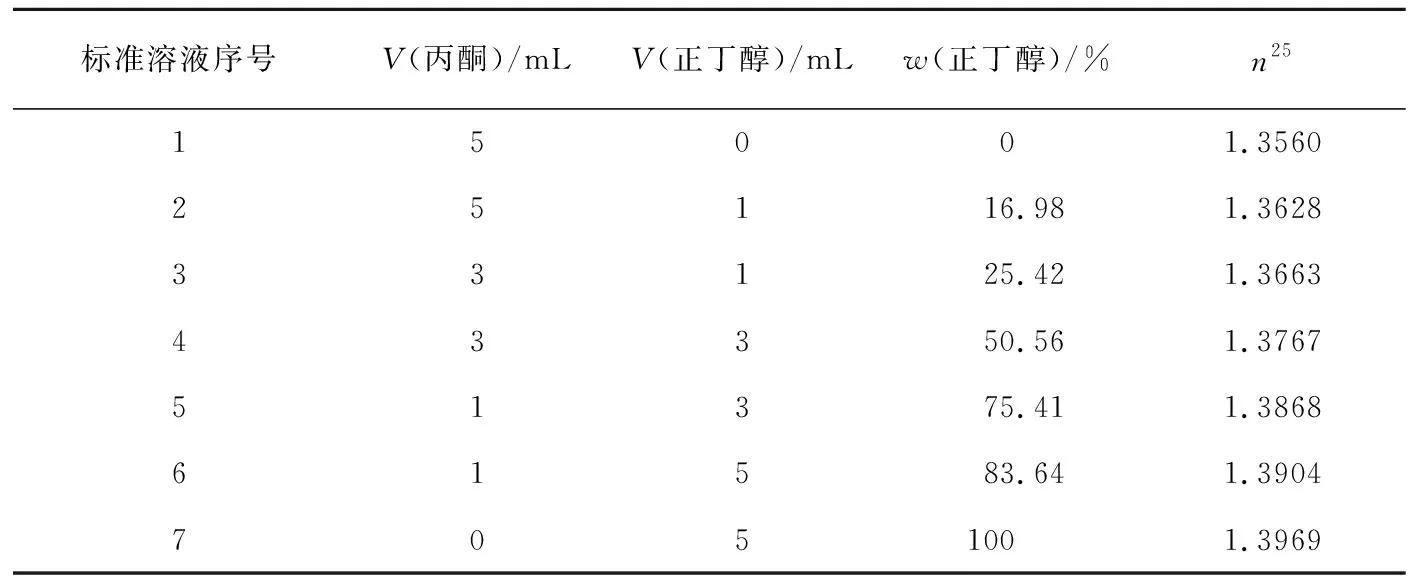
表2 标准溶液的配制及其折光率的测定
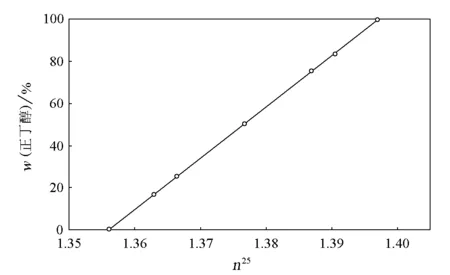
图2 标准曲线
该标准曲线可由教师提供。如果学生测定折光率时的温度高于或低于25℃,可由折光率校正公式进行校正:
n25=nt+0.00045×(t-25)
其中,t为测定时仪器显示的温度,nt为液体在测定温度下的折光率,n25为液体25℃时的折光率。例如,某液体20℃时测定的折光率为1.3698,则n20=1.3698,那么25℃时的折光率为:
n25=nt+0.00045×(t-25)=1.3698+0.00045×(20-25)=1.3676
5.2 简单蒸馏
用阿贝折光仪分别测定7个馏分的折光率并记录测定时的温度,将数据记录在表4中。如果馏分测定温度不是25℃,用折光率校正公式将测定的折光率换算成相应于25℃时的数值,再从标准曲线(图2)上读出正丁醇的质量百分数(w),将数据记录在表4中。
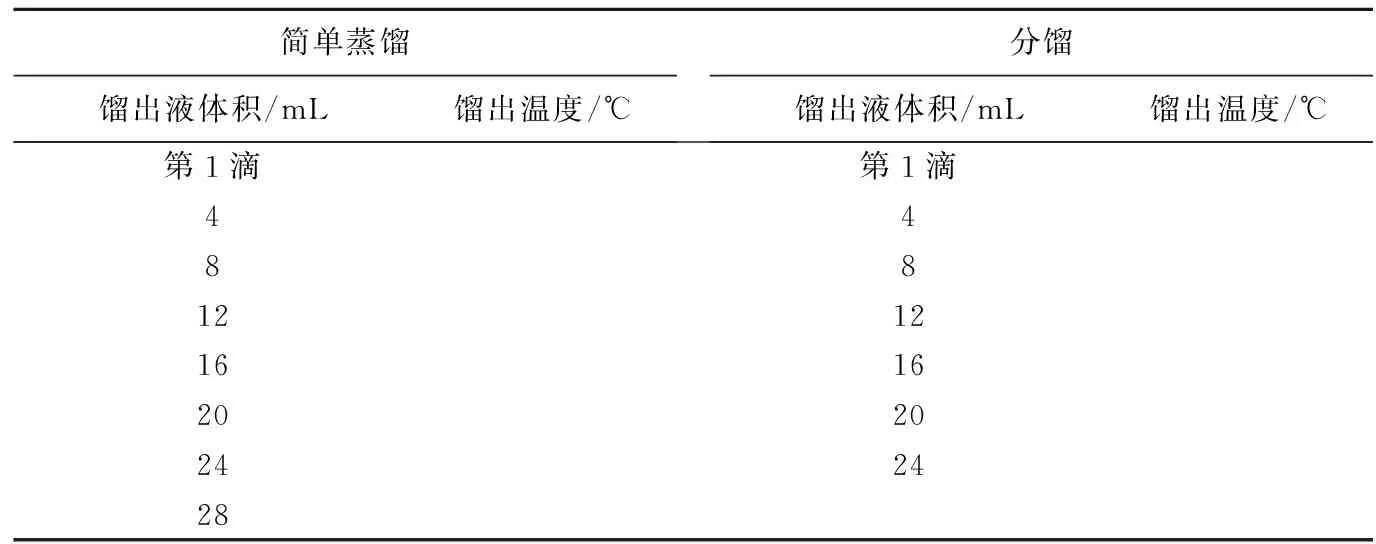
表3 简单蒸馏与分馏馏出液体积及温度记录
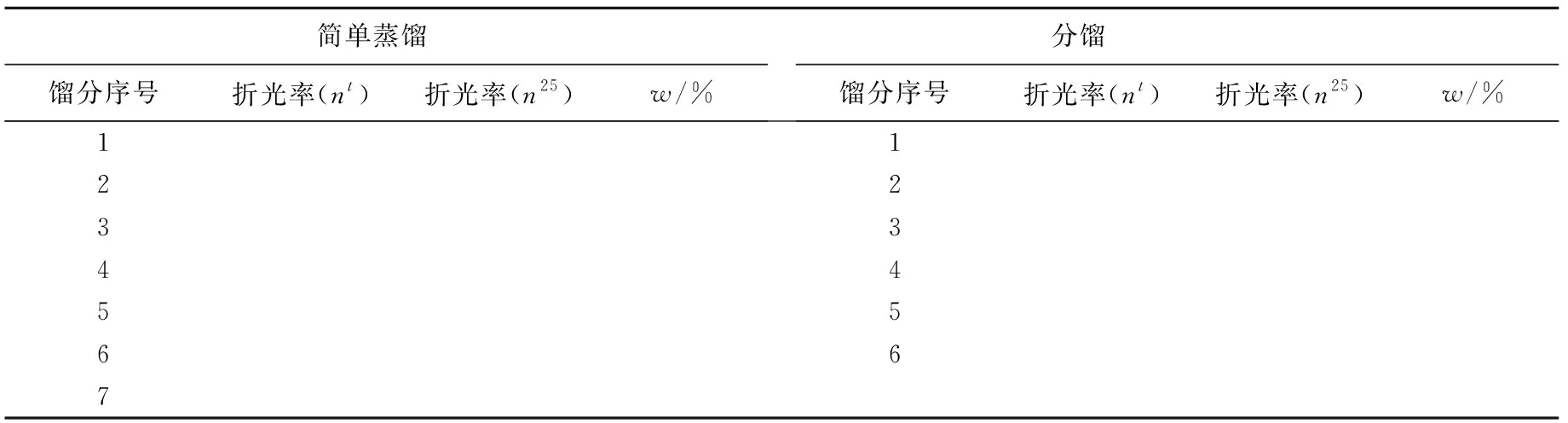
表4 简单蒸馏与分馏各馏分折光率测定及组成
5.3 分馏
分馏装置与简单蒸馏装置相似,不同的只是在圆底烧瓶和蒸馏头之间插入一根韦氏分馏柱。分馏操作步骤与简单蒸馏基本相同,但要注意控制蒸馏速度以不超过每秒1滴为宜。同样收集等体积的6个馏分,并注意记录相应的柱顶温度作为馏出温度,将数据记录在表3中。由于分馏速度较慢,在此过程中液体有一定损失(挥发);同时,一部分液体作为滞留液不能被蒸出;另外,烧瓶中又要保留一定量的残液,考虑到这3部分损失,我们只接收了等体积的6个馏分。
用阿贝折光仪分别测定6个馏分的折光率并记录测定时的温度,将数据记录在表4中。如果测定温度不是25℃,用折光率校正公式将测定的折光率换算成相应于25℃时的数值。再从标准曲线上读出正丁醇的质量百分数(w),将数据记录在表4中。
6 数据记录与处理
① 根据表3中的数据,以馏出液体积为横坐标,馏出温度为纵坐标,在同一坐标上分别绘制简单蒸馏与分馏曲线。
② 根据表4中的数据,以馏分序号为横坐标,正丁醇的质量百分数(w)为纵坐标,在同一坐标上分别绘制简单蒸馏与分馏的馏分组成曲线。
7 结果与讨论
① 比较简单蒸馏与分馏曲线中沸点随蒸馏过程的变化,并以拉乌尔定律及两组分气液平衡相图来解释。对两种分离方法的分离效果进行评价。
② 比较简单蒸馏与分馏的馏分组成曲线的变化,它与沸点的变化是否一致?评价两种分离方法的分离效果。
③ 丙酮与正丁醇的沸点虽然相差较大(61.2℃),简单蒸馏却很难将它们完全分离开来,试从分子结构分析可能的原因。
8 时间安排
① 标准曲线的绘制最好由教师提供,也可以安排学生在做简单蒸馏时完成。
② 该实验可以安排学生分两次独立完成,每次6学时。
③ 该实验也可以安排两个学生合作完成,一个学生做简单蒸馏,另一个学生做分馏,共享数据。6学时。
④ 数据处理、结果与讨论在正式的实验报告中完成。
9 教学实践效果
该实验已在我院2009级星拱班和2010级弘毅班的有机化学实验中开设过两次,均取得了令人满意的教学效果。学生分两次独立完成该实验,每次6学时。通过比较简单蒸馏与分馏曲线以及比较简单蒸馏与分馏的馏分组成曲线,学生能够对简单蒸馏与分馏的分离效果做出正确判断,即分馏能够获得良好的分离效果。
该实验不仅基础性强,能训练简单蒸馏和分馏两种基本操作,而且涉及仪器使用、数据处理以及运用所学有机化学、物理化学知识对结果进行分析、讨论,锻炼了学生的综合实验技能。更为重要的是,通过引导学生对分离过程的分析以及分离效果的比较和评价,可培养学生独立思考、分析问题、解决问题的能力,以及严谨的科学态度。
参 考 文 献
[1] 武汉大学化学与分子科学学院实验中心.有机化学实验.武汉:武汉大学出版社,2004
[2] Hodgman C D,Weast R C,Selby S M.Handbook of Chemistry and Physics.37th ed.Cleveland,Oh:Chemical Rubber Publ.Co.,1955
[3] 武汉大学化学与环境科学学院.物理化学实验.武汉:武汉大学出版社,2000
