托品酮及其衍生物卓柯卡因的合成
——介绍一个中级有机化学实验
2012-09-25关玲徐烜峰张奇涵
关玲 徐烜峰 张奇涵
(北京大学化学与分子工程学院 北京 100871)
托品酮的合成被认为是首个由简单底物出发的天然产物全合成。其合成法(Robinson-Schopf反应)被广泛用于合成托品酮类化合物,而该类化合物又被进一步用于其他天然产物的合成。该反应是一个高效反应,在一步反应中同时形成4个化学键。我们选取这样一个合成示例,作为面向大学二年级本科生的中级有机实验课的学生实验,希望学生通过了解托品酮合成方法的研究进展,体会其中蕴含的研究思想;通过广泛查阅文献,培养学生选择适宜的反应方法和反应条件的能力;实验中的1,3-丙酮二羧酸和托品酮两个化合物的制备实验能够很好地训练学生精确控制反应条件和分析不同条件对反应的影响的能力。本实验还涉及了多种条件下柱层析分离纯化产物方法的综合训练。
1 实验原理
托品酮2(又称颠茄酮、莨菪酮)是从茄科植物颠茄(AtropabelladonnaL.)等分离得到的生物碱,是托烷类生物碱的重要母体化合物。托烷类生物碱多具有明显的生物活性和重要的药用价值,因此其化学合成备受重视。托品酮的合成是有机合成史上的重要事件。1902年,德国化学家Willstatter从环庚酮出发,经卤化、氨解、甲基化、消除等十几步反应成功合成了托品酮[1]。1917年,英国著名有机化学家R.Robinson(1947年诺贝尔化学奖获得者)从生源学说出发,模拟自然界植物体合成莨菪碱的过程,以丁二醛、甲胺、丙酮二羧酸为原料,经曼尼希反应,巧妙地一步缩合成环。反应在缓冲水溶液中进行,采用的反应温度及溶液pH均接近天然条件,经改进后的总收率达90%,这一反应被命名为Robinson托品酮合成法(又称Robinson-Schopf反应)[2-3]。 R.Robinson的托品酮合成是迄今天然产物生源合成最著名和最为成功的事例。有机化学家在近年来也陆续发展了一些其他合成托品酮的方法[4-5],但总体上仍以Robinson托品酮合成法为佳。1997年,John M.McGill等报道了对 Robinson托品酮合成方法的改进,使用 2,5-二甲氧基四氢呋喃水解原位生成丁二醛,在缓冲体系中控制进行反应,使得反应的稳定性大为改善,更适于托品酮的规模性合成制备[6]。
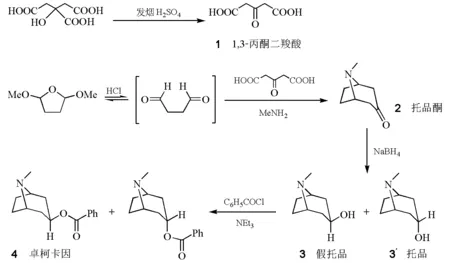
图1 托品酮及衍生物卓柯卡因的合成
本实验基于上述工作,参考相关文献,由柠檬酸制备1,3-丙酮二羧酸(1),继而按照John M.McGill等的改进方法合成托品酮(2),经硼氢化钠还原得到托品醇(假托品(3)和托品(3′)的混合物,羟基分别为β和α构型),再与苯甲酰氯进行酯化反应制得卓柯卡因(4)。卓柯卡因是从爪哇产的古柯叶中分离得到的托烷类生物碱[7]。
2 仪器试剂
2.1 仪器
电磁搅拌器,pH计,紫外检测仪,层析柱,耐酸玻璃漏斗,磨口玻璃仪器一套。
2.2 试剂
柠檬酸,20%发烟硫酸,2,5-二甲氧基四氢呋喃,33%甲胺水溶液(或甲胺盐酸盐),NaBH4,苯甲酰氯,三乙胺,乙酸乙酯,无水乙醇,甲苯,二氯甲烷,石油醚,碱性Al2O3,无水乙酸钠,氢氧化钠,盐酸,硅胶H,无水硫酸钠,无水硫酸镁。
3 实验步骤
3.1 1,3-丙酮二羧酸的制备[8]
在400mL烧杯中加入 45mL 20%发烟硫酸,用冰盐浴充分冷却至-5℃以下,搅拌下缓慢加入21.0g研碎的柠檬酸。缓慢升温使反应混合物升温到30℃左右,并保持到不再有泡沫发生为止。冰盐浴冷至0℃以下,将72g碎冰分成小部分,分批加入到混合物中。加冰完毕后重新冷却至0℃,用玻璃砂芯漏斗迅速抽滤,经乙酸乙酯充分洗涤、抽干后得到白色疏松固体。
3.2 托品酮的制备[6]
(1) 在4.86g 2,5-二甲氧基四氢呋喃的20mL水溶液中加入0.6mL浓盐酸,于70~75℃加热30分钟,所得溶液冷至室温备用。
(2) 在100mL三口瓶中加入11.7g乙酸钠、30mL去离子水、3.75g 33%甲胺水溶液、5.70g丙酮二羧酸,冰水浴冷至10℃, 调pH至5.1,慢慢滴加前述备用的丁二醛溶液。撤去冰水浴,约10分钟升温到40℃并恒温反应1小时。冷却至20℃,加入6mol·L-1NaOH溶液至反应液的pH约为10,加入9.2g NaCl。用CH2Cl2萃取反应液,合并有机相,无水硫酸钠干燥,除去干燥剂,旋蒸除去溶剂。
(3) 残余物以碱性氧化铝柱层析纯化,石油醚-乙酸乙酯梯度洗脱。薄板检测收集洗脱液,旋蒸除去溶剂,冷冻得近白色或淡黄色托品酮结晶。1H NMR(CDCl3):δ1.62(m,2H),2.05~2.29(m,4H),2.50(s,3H),2.66(m,2H),3.43~3.47(m,2H)。13C NMR(CDCl3):δ27.67,38.27,47.50,60.67,209.67。
3.3 托品醇的制备
将2.4g托品酮溶于25mL乙醇中,搅拌下加入1.9g NaBH4,室温(或40~60℃)下反应至还原完全。加入适量水,旋蒸除去乙醇。用CH2Cl2萃取水相,无水Na2SO4干燥萃取液,除去干燥剂,旋蒸除去溶剂。残余物以碱性氧化铝柱层析纯化,乙酸乙酯洗脱,薄板检测收集洗脱液,旋干后冷冻得近白色或微黄色托品醇晶体。
3.4 卓柯卡因的制备

4 注意事项
(1) 1,3-丙酮二羧酸制备中释放大量一氧化碳,反应必须在通风橱中进行。
(2) 1,3-丙酮二羧酸在室温下很容易分解,应密封低温保存。
(3) 托品酮、托品醇在空气中室温下均易变质,宜密封低温保存。
(4) 托品酮合成反应中pH的精密控制十分重要,反应最好用pH计监控,精密pH试纸亦可用但效果稍差。
5 分析讨论
(1) 托品酮及托品醇中的杂质对后续反应的影响:合成得到的粗品颜色较深,薄板检测仅含少量其他杂质,柱层析纯化对产率影响较为明显,但学生实验结果表明柱层析纯化是必要的。① 层析纯化所得产物经冷冻后均可结晶,未经层析纯化则否。② 直接用未经层析纯化产物进行后续反应,产物不易纯化且收率明显降低。
(2) 柱层析纯化条件的选择:托品酮、托品醇分子中存在氨基,不适合进行硅胶柱层析分离纯化,而以碱性氧化铝柱层析可以得到较好结果;托品醇洗脱过程较长,但增大洗脱剂极性会明显影响纯度。同样由于胺基的影响,硅胶柱层析纯化卓柯卡因时洗脱剂中需加入适量三乙胺。
(3) 托品醇、伪托品醇的分离:二者采用柱层析分离较为困难,继续反应生成苯甲酸酯后较易分离。作为中间产物,本实验可以只纯化得到二者的混合物。
6 思考题
(1) 查阅文献了解托品酮合成进展,并与本实验建议的合成方法进行比较。
(2) 比较柠檬酸脱水生成乌头酸与本实验中由柠檬酸生成1,3-丙酮二羧酸两个反应的差异。
(3) 查阅有关托品酮还原反应的文献,分析以不同比例选择性生成α、β型产物的原因。
(4) 写出Robinson-Schopf环合反应的机理。
(5) 本实验制备1,3-丙酮二羧酸使用了20%发烟硫酸,如使用50%发烟硫酸是否可行?请查阅有关数据进行分析。
感谢自2007年本实验开设以来参加实验教学的梁勇、叶思宇、张慧君、李茜、马子玥、余达刚、张云舒、周焱、郭子豪、李亦舟、王恒等研究生助教和05~09级选课同学的参与合作。
参 考 文 献
[1] Willstatter R.JustusLiebigsAnnalenderChemie,1903,326:23
[2] Robinson R.JChemSoc,1917,762
[3] Schopf C.AngewChem,1937,50:779
[4] Koichi M,Hirofumi O.ChemCommun,2002,38(22):2626
[5] Nicolaou K C,Montagnon T,Baran P S,etal.JAmChemSoc,2002,124:2245
[6] Burks J E,Espinosa L,LaBell E S,etal.OrgProcessResDev,1997(1):198
[7] O′Neil M J,Smith A,Heckelman P E,etal.The Merck Index.13rd ed.Whitehouse Station,NJ:MERCK & CO,INC,2001
[8] Adams R,Gilman H.Acetonedicarboxylic Acid∥Organic Syntheses.Coll.1941(1):10
[9] Maksay G,Nemes P,Bro T.JMedChem,2004,47:6384
