正、反相色谱结合分离制备西洋参中的人参皂苷类物质
2012-09-25周锋伟,姜照祥,付绍平,朱靖博
周 锋 伟, 姜 照 祥, 付 绍 平, 朱 靖 博
( 大连工业大学 植物资源化学与应用研究所, 辽宁 大连 116034 )
0 引 言
西洋参(PanaxquinquefoliumL.)又称花旗参、洋参、西洋人参,味苦、性凉、入心、肺、肾经[1],为五加科(Araliaceae)人参属多年生草本植物,原产于美国东部和加拿大,目前我国已有大面积栽培。西洋参具有补气养阴,清火生津的功效。其性偏于寒凉,对气虚而阴津耗伤有热者最为适宜[2-3]。
人参皂苷是西洋参中的主要活性物质[4-5]。迄今为止,中外学者已从西洋参中分离鉴定出的皂苷类成分的苷元有3种:达玛烷型(Dammarane)、齐墩果烷型(Oleanane)、奥克梯隆醇型(Ocotillol);而分离出的人参皂苷单体化合物近50种。对于西洋参中高纯度单体皂苷制备已有报道[6-7],其中以色谱法分离效果最佳,分离填料的选择多集中在大孔树脂、葡聚糖凝胶、硅胶等[8-9]。本文首次采用正相硅胶色谱柱和反相SG-64色谱柱相结合的方法,仅通过两次柱色谱分离就从西洋参总皂苷中分离得到6个纯度超过95%的单体人参皂苷类物质。此方法成本低、效率高、操作简便。
1 材料与方法
1.1 材料与设备
西洋参总皂苷粉,沈阳药科大学提供;薄层层析硅胶,青岛海洋化工有限公司;薄层色谱硅胶预制板GF254,烟台化学工业研究所;反相填料SG-64,购自美国罗门哈斯公司;旋转蒸发仪,上海申生科技有限公司;UltiMate3000高效液相色谱仪,美国DIONEX公司;Finnigan MAT LCQTMESI接口的离子阱质谱仪,美国Finnigan公司。
1.2 方 法
1.2.1 西洋参总皂苷的初分离
称取西洋参总皂苷粉130 g,用适量的甲醇溶解,加入200~300目硅胶390 g,水浴蒸干,过程中不断搅拌,用研钵将其研成粉末,待用。取薄层层析硅胶2.6 kg作为分离胶,用漏斗慢慢装入到玻璃柱内,使其铺放均匀(其间要用真空泵把硅胶抽实),在其上用漏斗装入样品胶,最上层放置滤纸,然后用洗脱液洗脱。首先用纯氯仿平衡柱子,然后按照V(氯仿)∶V(甲醇)=9.5∶0.5,9∶1,…,0.5∶9.5进行梯度洗脱(洗脱液中加千分之一的水),TLC和HPLC检测分离结果。将具有相同物质的组分合并。
1.2.2 初分物的二次分离
将“1.2.1”得到的粗品组分溶解于10%甲醇水中,上反相SG-64色谱柱,甲醇-水梯度洗脱(10%~100%),HPLC跟踪检测,合并单体皂苷物质,减压浓缩至干。
1.2.3 薄层层析法
用氯仿-甲醇-水[V(氯仿)∶V(甲醇)∶V(水)=65∶35∶10]作展开剂,用碘蒸汽进行显色。每组馏分进行薄层检测,根据Rf值,合并具有相同物质的馏分。
1.2.4 液相色谱分析
色谱柱,Hypersil ODS2(4.6 mm×250 mm,5 μm);体积流量,1.00 mL/min;检测波长,203 nm;柱温,室温;进样量,20 μL。采用二元梯度洗脱,流动相为乙腈和水。洗脱比例:乙腈体积分数10%(0 min)→20%(5 min)→35%(20 min)→35%(30 min)→43%(45 min)→43%(52 min)→58%(67 min)→75%(72 min)→75%(75 min)。
1.2.5 质谱检测条件
m/z扫描范围,100~1 500 U;干燥气温度,325 ℃ ;干燥气体积流量,10.0 L/min;雾化气压力,27.6 Pa;离子化方式,ESI(+)和ESI(-);电喷雾电压,3 500 V。
2 结果与讨论
2.1 化合物的分离
采用正相硅胶真空柱分离,共收集150瓶(2 L/瓶)。根据TLC检测,合并Rf值相同点的馏分溶液,得到了11组馏分。最后用旋转蒸发仪浓缩,蒸干得到固体产物。
称取9.5 g的初分得到的馏分5的干物质,将其溶解于10%的甲醇水中,上于反相SG-64柱(6 cm×60 cm),体积流量70 mL/min,流动相依次以10%~100%甲醇水进行梯度洗脱,HPLC检测分离结果。合并具有相同物质的馏分,得到化合物Ⅰ、Ⅱ、Ⅲ见图1。
称取12.5 g的初分得到的馏分7的干物质,将其溶解于10%的甲醇水中,上于反相SG-64柱(6 cm×60 cm),体积流量70 mL/min,流动相依次以10%~100%甲醇水进行梯度洗脱,HPLC检测分离结果。合并具有相同物质的馏分,得到化合物Ⅳ、Ⅴ、Ⅵ见图1。
2.2 化合物的结构鉴定
化合物Ⅰ:白色粉末(甲醇),溶于甲醇、乙醇,微溶于甲醇水,不溶于丙酮、乙酸乙酯。盐酸-镁粉反应阳性,Molish反应阳性,薄层酸水解检出葡萄糖。由图2可知,(-)ESI-MSm/z:846.6[M+HCOO]-,800.4[M-H]-;(+)ESI-MSm/z:802.5[M+H]+,640.8[M-Glc+H]+,622.3[M-Glc-H2O+H]+,459.7[M-2Glc-H2O+H]+,441.9[M-2Glc-2H2O+H]+,423.8[M-2Glc-3H2O+H]+。通过图2、3可以发现化合物Ⅰ与化合物Ⅱ的分子质量一样,与文献[5]报道中的人参皂苷Rg1和La一致,通过对比化合物在液相色谱上的保留时间可以发现,化合物Ⅱ的保留时间大于化合物Ⅰ,故鉴定化合物Ⅰ为人参皂苷Rg1。
化合物Ⅱ:白色粉末(甲醇),溶于甲醇、乙醇,微溶于甲醇水,不溶于丙酮、乙酸乙酯。盐酸-镁粉反应阳性,Molish反应阳性,薄层酸水解检出葡萄糖。由图3可知,(-)ESI-MSm/z:846.3[M+HCOO]-,800.4[M-H]-;(+)ESI-MSm/z:802.5[M+H]+,622.3[M-Glc-H2O+H]+。通过与文献[5]对比,鉴定该物质为化合物Ⅰ的同分异构体人参皂苷La。
化合物Ⅲ:白色粉末(甲醇),溶于甲醇、乙醇,微溶于甲醇水,不溶于丙酮、乙酸乙酯。盐酸-镁粉反应阳性,Molish反应阳性,薄层酸水解检出葡萄糖。由图4可知,(-)ESI-MSm/z:830.4[M+HCOO]-,784.3[M-H]-;(+)ESI-MSm/z:768.4[M-H2O+H]+,750.4[M-2H2O+H]+,622.0[M-Rha-H2O+H]+,441.9[M-Rha-Glc-2H2O+H]+,423.8[M-Rha-Glc-2H2O+H]+,405.8[M-Rha-Glc-2H2O+H]+。通过参考文献[5]鉴定该化合物为人参皂苷Rg2。

图1 化合物Ⅰ~Ⅵ的高效液相色谱分析结果
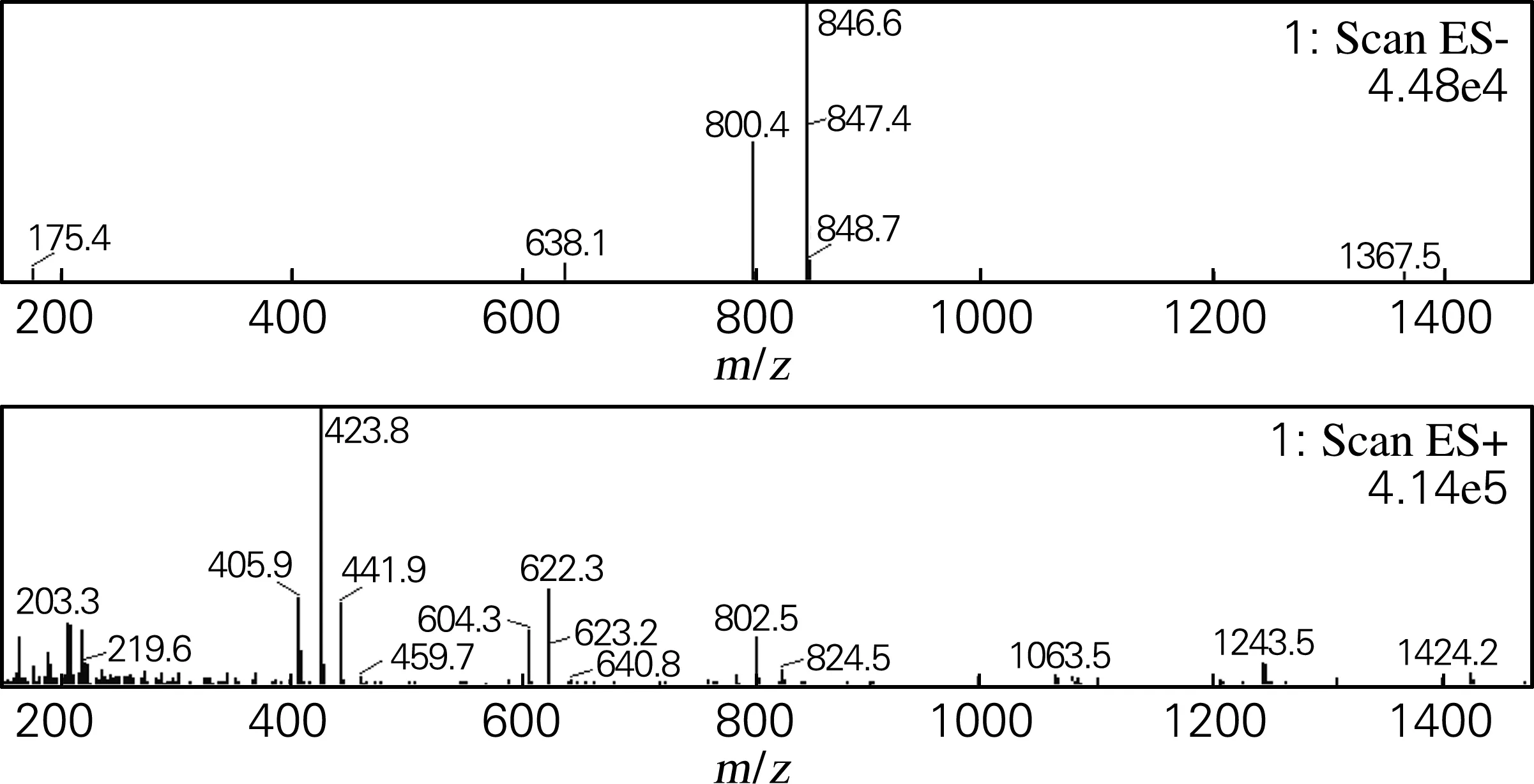
图2 化合物Ⅰ的质谱图

图3 化合物Ⅱ的质谱图
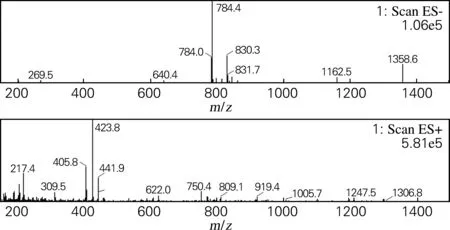
图4 化合物Ⅲ的质谱图
化合物Ⅳ:白色粉末(甲醇),溶于甲醇、乙醇,微溶于甲醇水,不溶于丙酮、乙酸乙酯。盐酸-镁粉反应阳性,Molish反应阳性,薄层酸水解检出葡萄糖。由图5可知,(-)ESI-MSm/z:992.8[M+HCOO]-,946.7[M-H]-;(+)ESI-MSm/z:769.1[M-Glc-H2O+H]+,588.1[M-2Glc-2H2O+H]+。通过参考文献[6]鉴定该物质人参皂苷Re。
化合物Ⅴ:白色粉末(甲醇),溶于甲醇、乙醇,微溶于甲醇水,不溶于丙酮、乙酸乙酯。盐酸-镁粉反应阳性,Molish反应阳性,薄层酸水解检出葡萄糖。由图6可知,(-)ESI-MSm/z:846.2[M+HCOO]-,800.6[M-H]-;(+)ESI-MSm/z:783.8[M-H2O+H]+,638.2[M-Rha-H2O+H]+,碎片439、421是人参皂苷P-F11在正离子模式下的特征碎片。鉴定该物质为拟人参皂苷P-F11。
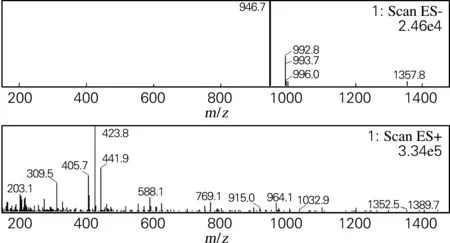
图5 化合物Ⅳ的质谱图

图6 化合物Ⅴ的质谱图
化合物Ⅵ:白色粉末(甲醇),溶于甲醇、乙醇,微溶于甲醇水,不溶于丙酮、乙酸乙酯。盐酸-镁粉反应阳性,Molish反应阳性,薄层酸水解检出葡萄糖。由图7可知,(-)ESI-MSm/z:992.9[M+HCOO]-,946.7[M-H]-;(+)ESI-MSm/z:768.2[M-Glc- H2O+H]+,750.3[M-Glc-2H2O+H]+,以上数据与文献[7]报道一致,因此,可鉴定该化合物为人参皂苷Rd。
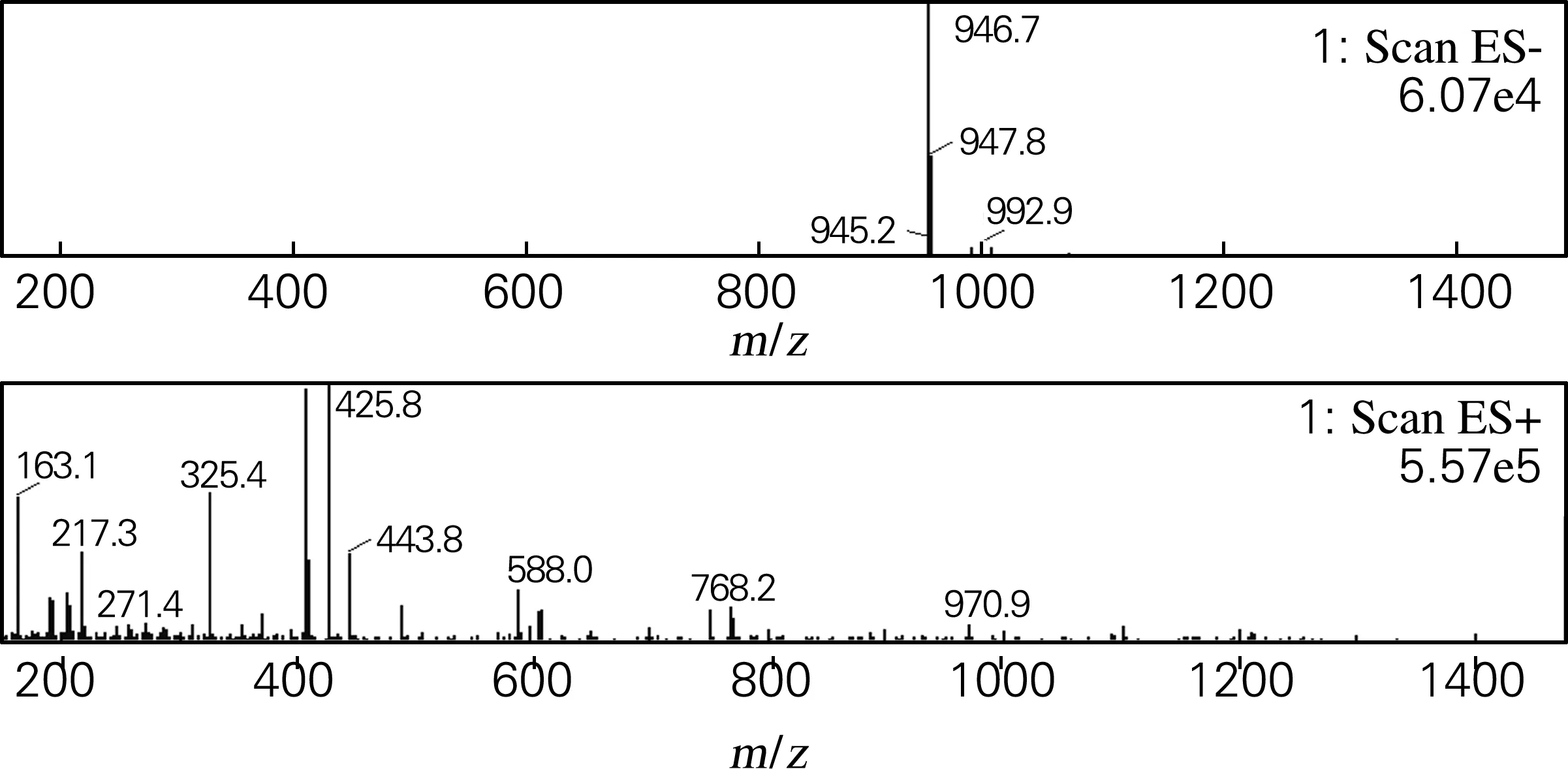
图7 化合物Ⅵ的质谱图
3 结 论
本文采用硅胶柱层析与反相SG-64柱层析相结合的方式,对西洋参中的人参皂苷类物质进行分离。通过两次柱层析得到了6个单体化合物,通过HPLC检测其纯度都达到95%。根据单体化合物的理化性质和波谱数据对其进行结构鉴定,确定这6种物质分别是人参皂苷Rg1、人参皂苷La、人参皂苷Rg2、人参皂苷Re、拟人参皂苷P-F11、人参皂苷Rd。与传统的分离方式对比,该方法分离成本低,效率高。为人参皂苷类物质的大规模生产、药理学试验和临床实验奠定了基础。
[1] 国家药典委员会. 中国药典:一部[M]. 北京:中国医药科技出版社, 2000:122-123.
[2] 王蕾,王英平,许世泉,等. 西洋参化学成分及药理活性研究进展[J]. 特产研究, 2007(3):73-77.
[3] 罗辉. 人参皂甙的生物特性及其临床应用的研究[J]. 井冈山学院学报, 2006, 27(8):79-83.
[4] CHRISTENSEN L P. Ginsenosides:chemistry, biosynthesis, analysis, and potential health effect[J]. Advances in Food and Nutrition Research, 2008, 55:1-99.
[5] 孟祥颖,李向高,于洋. 国产西洋参花蕾化学成分的研究[J]. 吉林农业大学学报, 2007, 26(4):294-297.
[6] 王笳,袁崇均,陈帅,等. 从西洋参中提取分离纯化人参皂苷Rb1和人参皂苷Re的研究[J]. 天然产物研究与开发, 2008, 20(2):357-359.
[7] 王岩,于小溪,吴迪,等. 人参皂苷Rd的分离提纯[J]. 大连轻工业学院学报, 2007, 26(4):294-297.
(WANG Yan, YU Xiao-xi, WU Di, et al. Separation and purification of ginsenoside Rd[J]. Journal of Dalian Institute of Light Industry, 2007, 26(4):294-297.)
[8] 李洪刚,何克江,韩蔚,等. 树脂联用纯化人参总皂苷[J]. 中医药学刊, 2005, 23(4):708-711.
[9] 曾庆荣,刘放,张振坤. 从人参茎叶中提取人参皂甙的研究[J]. 化工时刊, 2009, 23(6):26-28.
