果糖制备的糖基化终末产物对大鼠离体血管环舒张功能的损伤作用及氯沙坦的保护机制
2012-09-21郑凌云赵宇红广东药学院基础学院生理学系广东广州510006
郑凌云 赵宇红 (广东药学院基础学院生理学系,广东 广州 510006)
动物研究证实,高果糖饮食引起的血管内皮功能紊乱在促进高血压形成中有重要作用〔1〕,但其具体的分子基础并不清楚。研究表明,果糖代谢产生的甲基乙二醛等中间产物可促进血管平滑肌细胞产生活性氧(ROS),并降低内皮细胞NO的释放,从而可能引起血管内皮功能紊乱〔2〕;而且果糖比葡萄糖更容易引起体内生物大分子的非酶糖基化作用〔3〕,从而产生糖基化终末产物(AGEs)。因此,高果糖引起的血管内皮功能紊乱可能是通过AGEs的形成而介导的。而目前有关AGEs的研究基本上都是利用葡萄糖制备所得,研究显示,AGEs可引起血管内皮细胞凋亡〔4〕。近年来的研究还提示,AGEs引起的血管舒张功能紊乱与血管紧张素受体(AT1)活化密切相关〔5〕。但对于果糖制备的AGEs对血管舒张的影响,以及AT1在其中的作用尚未见报道。因此,本研究采用离体大鼠胸主动脉环,研究高果糖制备的AGEs对血管环舒张功能的影响,以及AT1在其中的作用机制。
1 材料与方法
1.1 主要试剂及仪器 D-果糖(纯度≥99%,上海生物工程公司),牛血清白蛋白(BSA,纯度≥98%,Sigma公司),β-肌动蛋白(β-actin)抗体(boster bio-engineering公司),p-eNOS(兔抗大鼠,Cell signaling technology),磷酸化蛋白酶 B(p-AKT,兔抗大鼠,SAB),powerlab生物信号采集处理系统(AD instrument,澳大利亚);雄性SD大鼠200~220 g(中山大学实验动物中心提供,合格证号:0098406),组织裂解液(millipore公司),N,N,N’,N’-四甲基乙二胺(TEMED,Sigma 公司),聚偏氟乙烯(PVDF)膜(millipore公司),抗兔二抗(boster bio-engineering公司),蛋白酶抑制剂 cocktail(Sigma公司),电化学发光法(ECL)化学发光剂(cell signaling technology公司),酶联免疫分析仪(美国MJ research公司),垂直电泳装置(美国Bio-Rad公司),凝胶扫描分析系统(美国 Advanced American biotechnology公司),高速冷冻离心机(德国Beckman公司),荧光分光光度仪(HITACHI U3010,Japan),紫外分光光度仪(岛津 UV-265FM,日本)。
1.2 方法
1.2.1 利用果糖制备AGEs并检测AGEs的形成情况 按文献方法〔6〕,采用果糖作为还原糖制备糖基化的BSA。具体方法如下:取BSA(10 mg/ml)与D-果糖(250 mmol/L)在磷酸钾缓冲液(PBS,200 mmol/L,pH7.4)中用二甲基亚砜(DMSO)进行溶解,体积分数<0.2(V/V),则不影响反应进行。以上试剂均用0.2 μm滤膜进行无菌过滤,并于37℃、5%CO2混合气体环境中孵育6 d。反应混合物用PBS透析48 h,以除去多余未结合果糖,用荧光分光光度仪测定产物的荧光密度,其激发波长为370 nm,发射波长440 nm。AGEs对照组采用D-果糖与PBS在同样条件下孵育6 d,空白对照组则用BSA与PBS孵育,氨基胍(20 mmol/L)+AGEs作为阳性对照组。
1.2.2 离体动脉环实验设计与分组 分为空白对照组、BSA对照组和 AGEs组以及氯沙坦 50 μmol/L组、氯沙坦10 μmol/L+AGEs组、氯沙坦 50 μmol/L+AGEs组。各组血管环与AGEs、氯沙坦以及氯沙坦+AGEs的孵育时间为1 h,随后分别检测乙酰胆碱(Ach)介导的内皮依赖的血管舒张(EDR)和硝普钠(SNP)介导的非内皮依赖性舒张反应(NEDR)。
1.2.3 离体动脉环的制备和血管张力测定 取SD大鼠,断头处死后,打开胸腔,迅速取出胸主动脉条上段,并置于预冷的Krebs-Henseleit(K-H)液中。K-H液成分(mmol/L):NaCl 120、NaHCO325、KH2PO41.2、MgSO41.2、KCl 4.5、CaCl21.25、glucose 11.1。用显微器械小心剔除血管周围的脂肪以及结缔组织,并将血管剪成约3~4 mm的主动脉环后,快速悬挂于离体血管环灌流装置中,将灌流浴槽内充以37℃的K-H液,并持续给予95%O2和5%CO2的混合气体,让血管环在无张力情况下维持15 min。逐步调节血管环张力至2 g,并维持1 h,期间每隔15 min换一次液。用100 mmol/L的KCl刺激,反复三次,以激发血管环的最大收缩,如两次的最大收缩幅度差小于5%认为血管反应性良好。之后给予10-6mol/L的苯肾上腺素引发预收缩,再用10-5mol/L的Ach舒张血管环以检查内皮的完整性。各组血管环在药物处理1 h后,分别测定对Ach和SNP介导的舒张反应。血管环舒张反应以血管舒张力占血流峰值速度(PE)(10-6mol/L)预收缩时引起的最大收缩张力的百分比表示,并计算最大舒张百分率(Emax)。
1.2.4 血管环组织中NO含量测定 收集各组血管环,加入冰预冷的PBS液,冰上进行组织匀浆后以4℃、10 000 r/min离心5 min,取上清100 μl进行蛋白定量,并按照NO检测试剂盒说明书用紫外分光光度仪进行NO含量测定。
1.2.5 免疫印迹检测血管环中eNOS、AKT的磷酸化表达 收集各组血管环,加入冰预冷的组织蛋白裂解液,用显微剪在冰上剪碎组织,并振荡裂解30 min,离心取上清,用双辛可宁酸(BCA)法进行蛋白定量,调整各组蛋白上样量,使每个加样孔总蛋白量一致。取一定量蛋白上清液,与蛋白质相对分子质量Marker一起进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDSPAGE)电泳。电泳分离蛋白质,卸下分离胶,置于电转缓冲液中平衡30 min。转移到PVDF膜上,室温下封闭,孵育p-eNOS抗体(1∶400)以及p-AKT(1∶500)抗体4℃过夜,PBS室温洗脱,孵育二抗(抗HRP标记的二抗稀释倍数为1∶1 000)1 h,PBST室温洗脱1 h,中间换液3次。取发光试剂盒中的发光底物溶液和增强剂溶液各0.25 ml,加入去离子水稀释至5 ml,混匀静置1 min后,与膜作用3 min,在暗室中,使X光胶片感光。胶片用凝胶成像系统扫描分析灰度。
1.3 统计学方法 应用SPSS13.0统计软件进行分析,各组数据以±s表示,组间采用方差分析。
2 结果
2.1 果糖制备的AGEs的鉴定和检测 取AGEs制备各组,进行荧光分光光度仪测定,根据标准曲线得到所制备的AGEs的FU值为2 989 FU/ml。用D-果糖或BSA单独与PBS孵育并不能形成AGEs,而上述两者共同孵育后,可在440 nm处得到一个最大峰,并且用氨基胍作为抑制AGEs形成的阳性对照药物,结果显示氨基胍有效抑制了果糖所制备的AGEs,提示AGEs制备成功。BSA组、D-果糖组未形成AGEs,AGEs组及AGEs+AS组AGEs形成率分别为98.5%及11.2%。
2.2 AGEs以及氯沙坦对Ach介导的大鼠胸主动脉环舒张反应的影响 AGEs预处理大鼠胸主动脉环1 h后,可明显抑制Ach引起的内皮依赖的血管舒张反应,其Emax仅为(32.45±2.93)%(P<0.01);单独氯沙坦(50 μmol/L)预处理组和AGEs对照组的BSA均不影响血管环的内皮依赖性舒张,两组间相比无统计学差异(P>0.05),其Emax分别为(82.14±6.14)%和(81.42±2.36)%,提示果糖制备的AGEs可引起血管环舒张功能降低,而与BSA和氯沙坦药物本身无关。见图1。
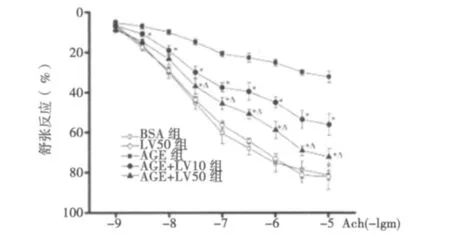
图1 AGEs及氯沙坦对大鼠胸主动脉环舒张反应的影响
2.3 AGEs以及氯沙坦对血管环组织中NO含量(μmol/mg)的影响 AGEs预处理血管环1 h后,与对照组BSA(113.47±4.73)相比,NO含量(88.41±5.32)明显降低(P<0.01),而氯沙坦10 μmol/L(92.43±2.85)不能有效逆转AGEs抑制作用(P>0.05),50 μmol/L氯沙坦(102.42 ±3.57)可较明显的恢复血管壁中NO产生(P<0.05)。而单独应用氯沙坦50 μmol/L组血管环组织中NO含量为(110.84±5.16)μmol/mg,提示AGEs可能通过抑制NO合成导致血管环内皮依赖舒张功能降低,氯沙坦则可逆转这一作用,进一步说明AGEs可能活化血管内皮细胞的AT1而影响NO的生成。
2.4 AGEs以及氯沙坦对血管环中eNOS和AKT磷酸化的影响 AGEs预处理血管环1 h后,血管环中eNOS活性明显下降(P<0.01),而对照组BSA和单独氯沙坦药物处理1 h后,血管环中eNOS无显著差别,提示AGEs引起的血管舒张功能降低与其抑制eNOS磷酸化有关。给予氯沙坦(10 μmol/L)和AGEs共同孵育1 h后,血管环中eNOS活性与单纯AGEs处理组相比有所升高(P<0.05);而50 μmol/L氯沙坦可明显恢复eNOS活性(P<0.01),提示AGEs引起的血管舒张损伤机制可能与AT1受体的活化有关。进一步检测AKT磷酸化水平,结果发现AGEs预处理后AKT磷酸化与BSA对照组相比明显下调(P<0.01),而氯沙坦可恢复AKT磷酸化,提示AGEs引起的eNOS活性降低可能是通过AT1受体抑制PI3K/AKT信号途径活化,进而引起血管环舒张功能损伤。见图2。
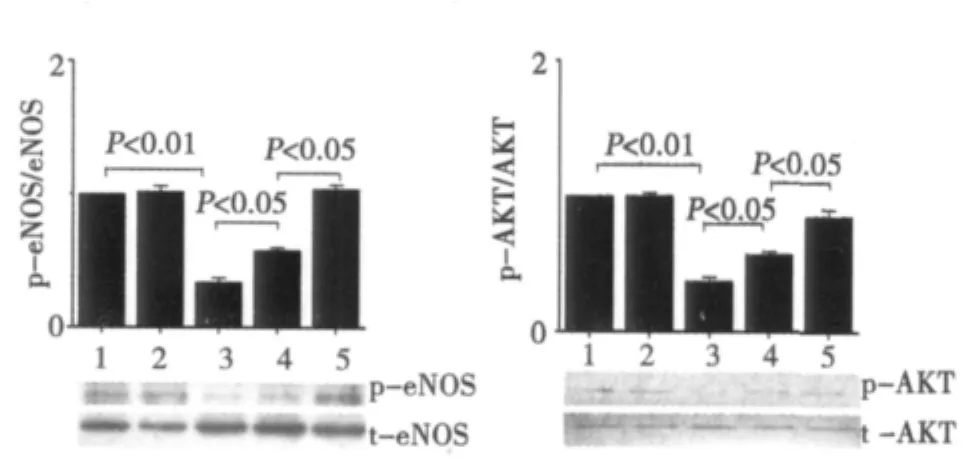
图2 AGEs及氯沙坦对血管环eNOS和AKT磷酸化的影响
3 讨论
AGEs在糖尿病血管并发症中有十分重要的作用〔7〕。研究证实,高果糖饮食会导致动物出现胰岛素抵抗和血管内皮功能紊乱〔8〕,但其具体的分子基础并不十分清楚。既往研究〔9〕和本文结果都证实,果糖和BSA在37℃条件下共同孵育6 d即可生成AGEs,因此提示高果糖对血管的舒张功能损伤可能与促进AGEs的形成有关。
本实验中采用文献报道的方法,用果糖作为还原糖,对BSA进行修饰以得到AGEs。用AGEs预处理大鼠胸主动脉环1 h后,发现果糖制备的AGEs引起内皮完整的血管环对Ach的舒张反应明显下降,而对硝普钠引起的血管环舒张无显著作用,提示果糖制备的AGEs主要引起内皮依赖的血管舒张反应受损,这与葡萄糖制备的AGEs的损伤作用相似。进一步观察了血管环组织中eNOS磷酸化的表达,发现与BSA组相比,AGEs可明显降低eNOS的磷酸化水平,而氯沙坦与AGEs共同孵育血管环后,eNOS磷酸化水平有所增加,而50 μmol/L氯沙坦本身对eNOS的磷酸化水平与BSA的作用无统计学差异,提示果糖制备的AGEs可能通过抑制eNOS活性、降低内皮细胞来源的NO水平引起舒张功能下调,而50 μmol/L的氯沙坦可明显逆转这一变化,进一步提示AT1介导了AGEs引起的急性血管舒张功能损伤过程;有研究表明,葡萄糖制备的AGEs引起的血管内皮损伤与PI3K/AKT活性有关〔4〕,因此,本文还观察了各组血管环中AKT的磷酸化水平,结果显示果糖制备的AGEs显著降低AKT的磷酸化,而氯沙坦预处理后可恢复AKT磷酸化水平,提示果糖制备的AGEs引起的eNOS活性下降与PI3K/AKT信号途径有关,而氯沙坦的保护作用则说明AT1活化参与急性AGEs引起的血管舒张功能损伤。通过检测血管环中NO含量,本文也证实AGEs的损伤作用与NO合成下调有关。进一步的分子机制还需要在细胞水平进行研究。
综上所述,高果糖制备的AGEs可以导致血管内皮功能紊乱,但在制备AGEs的时间上明显短于葡萄糖,提示果糖在诱导AGEs形成中的重要性。而且,果糖制备的AGEs能明显损害内皮的eNOS活性,从而引起NO生成降低,而AT1阻断剂氯沙坦的保护作用提示急性的AGEs引起的血管舒张反应降低也与AT1活化有关,并且可能通过抑制PI3K/AKT信号途径调控eNOS的活化。
1 Kim JA,Montagnani M,Koh KK,et al.Reciprocal relationships between insulin resistance and endothelial dysfunction:molecular and pathophysiological mechanisms〔J〕.Circulation,2006;113(15):1888-904.
2 Dhar A,Dhar I,Desai KM,et al.Methylglyoxal scavengers attenuate endothelial dysfunction induced by methylglyoxal and high concentrations of glucose〔J〕.Br J Pharmacol,2010;161:1843-56.
3 Lee O,Bruce WR,Dong Q,et al.Fructose and carbonyl metabolites as endogenous toxins〔J〕.Chem Biol Interact,2009;178(1-3):332-9.
4 Xiang Y,Li Q,Li M,et al.Ghrelin inhibits AGEs-induced apoptosis in human endothelial cells involving ERK1/2 and PI3K/Akt pathways〔J〕.Cell Biochem Funct,2011;29(2):149-55.
5 Schupp N,Schinzel R,Heidland A,et al.Genotoxicity of advanced glycation end products:an involvement of oxidative stress and of angiotensinⅡtype 1 receptors〔J〕.Ann N Y Acad Sci,2005;1043:685-95.
6 Kim HY,Kim K.Protein glycation inhibitory and antioxidative activities of some plant extracts in vitro〔J〕.J Agric Food Chem,2003;51(6):1586-91.
7 Brownlee M.Biochemistry and molecular cell biology of diabetic complications〔J〕.Nature,2001;414(6865):813-20.
8 Tran LT,Yuen VG,Mc Neill JH.The fructose-fed rat:a review on the mechanisms of fructose-induced insulin resistance and hypertension〔J〕.Mol Cell Biochem,2009;332(1-2):145-59.
9 Hao M,Li SY,Sun CK,et al.Amelioration effects of berberine on diabetic microendothelial injury model by the combination of high glucose and advanced glycation end products in vitro〔J〕.Eur J Pharmacol,2011;654:320-5.
