原发性肾小球疾病患者肾组织Kim-1 mRNA表达的临床意义*
2012-09-21陈建平范振海余丽梅
王 颖,于 泓,陈建平,范振海,余丽梅,王 虹,蒲 涛
(1.遵义医学院附属医院肾内科,贵州 遵义 563099;2.巴淖尔市医院肾内科,内蒙古 巴淖尔市 015000;3.遵义市妇幼保健院内科,贵州 遵义 563000;4.遵义医学院附属医院细胞工程重点实验室,贵州 遵义 563099)
肾小球疾病是一组以血尿、蛋白尿、水肿和高血压等为临床表现的肾脏疾病,是我国慢性肾衰竭的主要病因,大多数原发性肾小球疾病(primary glomerulopathy,PG)为免疫介导性炎症,随着疾病的进展,除肾小球病变外,还有不同程度的肾小管间质损伤。尽管临床上仍主要用血肌酐和尿量来评价肾损害和肾功能,但其影响因素众多,因而研究人员一直在寻找新的生物标志物;近年的研究发现肾损害分子-1(kidney injury molecule 1,Kim-1)和中性粒细胞明胶酶相关脂质运载蛋白(NGAL)等可用作急性肾损害时的早期标志物,胱抑素C也被逐渐用于临床,作为比血肌酐更好的反应肾小球滤过功能的指标[1]。其中Kim-1是一种I型跨膜糖蛋白,在正常肾脏几乎不表达,急性肾损伤时肾小管Kim-1表达和尿液中Kim-1含量均明显增加[2,3],但其生物学功能尚未阐明,Kim-1可能参与肾脏疾病的损伤及修复过程,对抗损伤性黏附,参与免疫反应调节等。最近国外文献报道,尿中Kim-1水平也用于IgA肾病、原发性肾病综合征伴发急性肾功能衰竭的肾损害评价[4,5]。因而在初步研究 PG患者肾组织 Kim-1 mRNA的表达情况基础上,分析其表达水平与肾功能损害和肾脏病理改变的相关性,以此探讨Kim-1表达在PG病情评价中的临床意义。
1 材料与方法
1.1 材料 Trizol试剂,逆转录试剂盒、Kim-1引物均购自宝生物工程(大连)有限公司;SYBR®GREEN PCR Master Mix购自美国ABI公司;βactin引物购自美国Sigma公司。TU-1810紫外可见分光光度计购自北京普析通用仪器有限责任公司;梯度PCR仪为德国Eppendorf公司;实时荧光定量PCR仪购自美国BIO-RAD公司。
1.2 方法
1.2.1 病例资料 纳入标准:随机收集遵义医学院附属医院肾内科2006年9月至2007年1月,符合1992年中华医学会肾脏病分会诊断标准的PG住院患者22例,除外其它继发因素。其中男16例,女 6例,年龄分布在15~64岁,平均年龄(27.85±14.76)岁。剔除标准:入院时存在缺血、缺氧、明确感染等诱发肾功能急性加重因素及使用糖皮质激素。分组标准及一般状况:所有病例按初入院时临床肾功能状况分为两组,估测肾小球滤过率(estimation of glomerular filtration rate,eGFR)≥90 mL/min/1.73 m2为 PG II组,eGFR<90 mL/min/1.73 m2为PG I组。
1.2.2 肾功能等实验室检查 患者入院次日,取清晨空腹静脉血5 mL,置于普通采血管中,送遵义医学院附属医院检验科,检测血浆白蛋白(albumin,Alb)、血肌酐(serum creatinine,Scr)和血尿素(Blood urea,U-rea)等,按简化MDRD方程计算eGFR,eGFR=186×[Scr]-1.154×[年龄(岁)]-0.203×[女性 ×0.742][6],式中Scr单位为mg/dl;同时收集24h尿液,测定24 h尿蛋白量(24h urine protein,UP)。
1.2.3 肾组织病理检查及组织学评分方法 临床诊断PG患者,符合经皮肾穿刺活检条件,签署知情同意书,经B超定位肾活检穿刺患者22例(PG I组9例,PG II组13例)。肾穿刺组织标本送病理科经石蜡包埋、切片,常规行HE、过碘雪夫酸(periodic acid shiff,PAS)、Masson、PASM 染色,进行光镜检查,光镜中肾小球数≥10个。参考北京大学第一医院肾内科IgA肾病简明半定量病理评分方法[7],从内皮细胞增生、肾小球慢性病变指数、肾间质炎症细胞浸润指数、系膜细胞增生指数和肾小管萎缩和肾间质纤维化等8个指数进行肾脏病理评分(renal pathological scoring,RPS)。
1.2.4 RT real-time PCR 留取部分肾穿刺活检肾组织,保存于Trizol中,按试剂盒说明书操作步骤提取总RNA,检测RNA纯度与含量,按试剂盒操作说明进行逆转录,反应条件:37℃,15 min,85℃,5s。cDNA 产物按照ABI公司SYBR®GREEN PCR Master Mix试剂盒说明书步骤进行定量PCR,反应条件:95℃,8min;95℃,15s,60℃,1min。β - actin 基因上游引物(5'-3')GTCCACCTTCCAGCAGATGTG,下游引物GCATTTGCGGTG GACGAT。
Kim-1基因上游引物(5'-3')GGCATTGTCTGGACCAATGG,下游引物 (3'-5')CTTGAAAGGTCCCCCAATAGC。结果取Ct值,以 βactin为内参照进行相对定量分析。
1.3 统计学处理 所有实验数据采用SPSS 13.0统计学软件包进行统计处理,非正态分布数据进行对数转换,即取Scr、Kim-1 mRNA表达量和肾脏病理评分的对数,分别以lgScr、lgKim和lgRPS表示;所有计量资料以均数±标准差(±s)表示,正态分布资料进行t检验及Pearson相关分析,非正态分布资料则进行秩和检验和Spearman相关分析,P<0.05表示有统计学意义。
2 结果
2.1 PG患者肾功能检查 如表1所示,PG II组eGFR)均≥90 mL/min/1.73 m2,明显高于 PG I组,而PG I组Scr水平明显高于PG II组的Scr水平(P<0.01);且PG I组BUN、UP水平也明显高于正常值和PG II组(P<0.05,见表1)。
表1 PG患者的肾功能检查结果Scr,BUN,eGRF,Alb,24h尿蛋白(±s)。

表1 PG患者的肾功能检查结果Scr,BUN,eGRF,Alb,24h尿蛋白(±s)。
注:vs.PG II组,*P <0.05,**P <0.01。
检测指标 PG I组 PG II组13 lgScr(μmol/L) 2.33 ±0.19** 1.86 ±0.11 Urea(mmol/L) 14.32 ±5.71* 7.81 ±3.48 eGRF(mL/min/1.73 m2)34.79 ±16.32** 115.71 ±33.38 Alb(g/L) 28.52 ±8.31 22.04 ±8.88 24 h尿蛋白(g)n 9 4.07 ±0.84 3.85 ±2.19
2.2 肾脏病理改变及评分 PG II组13例患者表现为轻度系膜增生性肾小球肾炎/轻度系膜增生型IgA肾病;PG I组9例患者中,轻度系膜增生性肾小球肾炎/轻度系膜增生型IgA肾病4例,局灶增生硬化性肾小球肾炎2例,增生硬化性肾小球肾炎3例。根据北京大学第一医院肾内科RPS标准,PG I组RPS值显著高于PG II组(P<0.01),其10为底的对数值lgRPS 分别为1.01 ±0.24 和0.46 ±0.21。
2.3 肾组织中Kim-1 mRNA水平 PG患者肾活检穿刺肾组织均有Kim-1 mRNA表达,与PG II组比较,PG I组肾组织Kim-1 mRNA表达水平明显降低,两组间lgKim相比较,差异有统计学意义(P <0.05,见表2)。
表2 PG患者肾组织Kim-1 mRNA表达水平(±s)

表2 PG患者肾组织Kim-1 mRNA表达水平(±s)
注:vs.PG II组,*P <0.05,**P <0.01。
lg Kim-1 mRNA PG I组 9 1.58 ±0.58组 别n**PG II组13 2.15 ±0.29
2.4 PG患者肾组织Kim-1 mRNA表达水平与Scr水平、eGFR及RPS的相关与回归分析如图1所示,PG患者肾组织Kim-1 mRNA水平的对数lgKim1与lgScr之间呈负相关,lgKim1与eGFR之间呈正相关;lgKim1与lgRPS评分之间呈负相关,而eGFR与lgRPS之间则呈负相关。上述相关数据的直线回归方程、相关系数r与P值见表3。lgKim-1、lgRPS与UP、BUN之间没有明显的相关性。
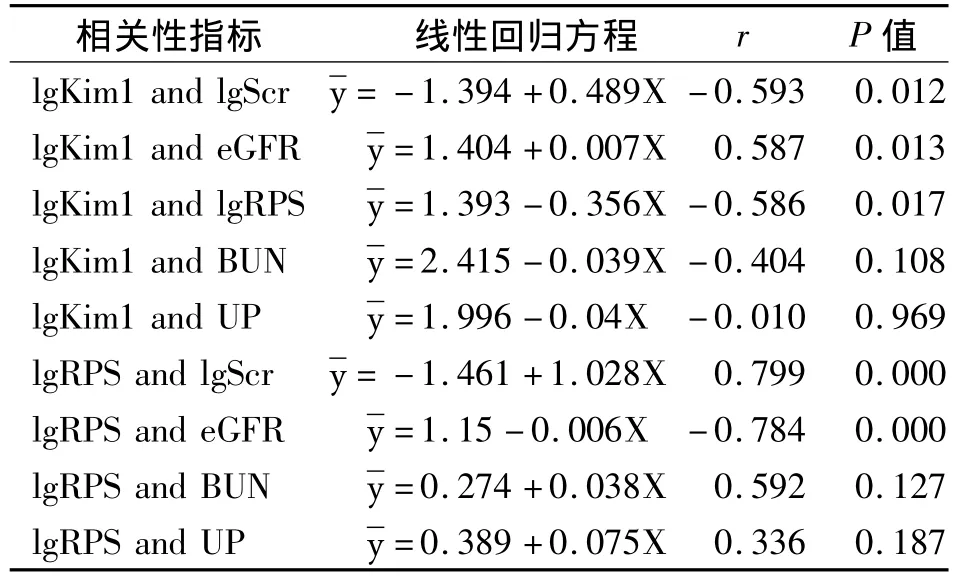
表3 PG患者肾组织Kim-1 mRNA表达水平与肾功能、RPS指标间的相关性分析

图1 PG患者Kim-1 mRNA表达水平与Scr(A)、eGFR(B)、RPS(C)之间,RPS与eGFR之间的散点图及相关性分析结果
3 讨论
Kim-1属于免疫球蛋白基因超家族,在肾损伤因素作用下,于肾脏近曲小管上皮细胞表达,在金属蛋白调节下,其胞外近膜部位的裂隙处发生断裂,使胞外片段被释放到尿液中。Kim-1作为急性肾小管损害标志物,能迅速、灵敏、特异地反映肾脏的损伤及恢复过程[1,5,8]。
本研究结果显示,eGFR<90 mL/min/1.73 m2的PG I组患者,Scr和Urea均高于PG II组,表明PG I组肾功能损伤明显重于PG II组。PG I组RPS值也大于PG II组,也进一步证明PG I组肾脏组织损伤更为严重。排除年龄、性别等影响因素计算所得的eGFR与lgScr之间呈明显的负相关,而lgScr与lgRPS之间呈正相关,lgRPS对数值与eGFR之间呈负相关,即PG患者肾组织中肾小球、肾小管及其间质和小动脉病变积分越高,肾组织损害越大,其肾功能降低也越明显。
轻度系膜增生型原发性肾病综合征合并急性肾小管坏死(acute tubule nerosis,ATN)患者尿液Kim-1水平与尿β2-微球蛋白、Scr和肾小管间质病理损害程度呈正相关[4]。IgA肾病患者尿液Kim-1与肾组织Kim-1蛋白表达不但高于正常人,还与Scr、蛋白尿呈正相关,与肌酐清除率呈负相关[5]。但在终末期肾病中尿液Kim-1水平与尿β2-微球蛋白、eGFR却没有明显相关性。本研究中两组PG患者肾组织均有Kim-1 mRNA表达,且lgKim1 mRNA水平与lgScr正相关,与上述文献报道相似,但值得关注的是,PG I组患者肾组织lgKim-1明显低于PG II组者,且lgKim-1与eGFR呈正相关,lgKim-1与lgRPS之间呈负相关。在原发性肾病综合征合并ATN等肾脏疾病中,尿液Kim-1水平与Scr呈正相关,即Kim-1高表达除主要反应肾损伤严重程度外;在损伤修复过程中Kim-1持续高表达可能还参与损伤的修复,本研究所显示的相关关系也进一步支持Kim-1参与肾损伤修复的观点,提示在PG的慢性疾病进程中,Kim-1的表达不仅反应肾小管间质损害程度,也可能反应肾损伤修复的能力,从而间接影响肾小球滤过功能。
Kim-1的高表达是肾小管上皮细胞凋亡、死亡等损伤的早期或持续标志[1,9],且主要表达于再生的近曲小管上皮细胞和去分化上皮细胞,ATN时,Kim-1还可能参与肾小管上皮细胞的去分化与增殖,从而保持肾小管组织形态和功能的完整性[5,10]。Kim -1 具有“双刃”性,在不同的肾脏病中,在肾损伤和修复中的病理生理功能也不尽相同[11]。PG患者慢性病变过程中,PG I组RPS较高,而Kim-1 mRNA表达较低,组织病理学检查可见多数患者已出现明显的肾间质炎症、肾小管萎缩、肾间质纤维化及肾小球增生硬化改变,因而推测在慢性肾功能减退过程中,由于肾小管损伤数量和程度的增加,可能降低了肾组织Kim-1 mRNA的表达;也提示PG患者出现较为严重的慢性肾功能衰退时,Kim-1 mRNA的低表达可能提示肾小管上皮去分化或增生的能力及保持肾组织损伤修复的能力明显减弱。
lgKim-1与lgRPS之间呈负相关,与原发性肾病综合征出现急性肾衰竭患者Kim-1与肾小管损伤程度正相关的结果不尽相同,除本研究所选择的肾病类型、采用的RPS标准不同外,疾病进程的不同可能是引起这一差异的主要原因,Kim-1在不同肾病中的生物学功能及其临床意义值得进一步深入研究。
[1]Ichimura T,Hung C C,Yang S A,et al.Urinary kidney injury molecule-1:a sensitive quantitative biomarker for early detection of kidney tubular injury[J].Am J Physiol Renal Physiol,2006,290(2):517 -529.
[2]赵飞,王立军.急性肾损伤新型早期诊断标志物研究进展及评价[J].医学综述,2010,16(19):2927 -2929.
[3]Ichimura T,Hung C C,Yang S A,et al.Kidney injury molecule-1:a tissue and urinary biomarker for nephrotoxicant- induced renal injury[J].Am J Physiol Renal Physiol,2004,286(3):552 -563.
[4]会苗,李绍梅.原发性肾病综合征患者尿白介素-18及肾损伤因子-1的检测及其意义[J].中国全科医学,2010,13(11C):3751 -3754.
[5]Peters H P,Waanders F,Meijer E,et al.High urinary excretion of kidney injury molecule-1 is an independent predictor of end-stage renal disease in patients with IgA nephropathy[J].Nephrol Dial Transplant,2011,26(11):3581 -3588.
[6]翁敏,白云凯,毕丹青,等.肾小球滤过率评估方程在我国慢性肾脏病人中的适用性[J].陕西医学杂志,2009,38(3):317-319.
[7]蒋镭,吕继成.IgA肾病简明半定量病理评分方法及其与预后的关系[J].中华肾脏病杂志,2007,23(5):278-282.
[8]McIntire J J,Umetsu S E,Akbari O,et al.Identification of Tapr(an airway hyperreativity regulatory locus)and the linked Tim gene family[J].Nat Immunol,2001,2(12):1109 -1116.
[9]Ichimural T,Asseldonk E J,Humphregs B D,et al.Kidney injury molecule-1 is a phosphatidylserine receptor that confers a phagocytic phenotype on epithelial cells[J].J Clin Invest,2008,118(5):1657 -1668.
[10]Bonventre J V.Dedifferentiation and proliferation of surviving epithelial cells in acute renal failure[J].J Am Soc Nephrol,2003,14:S55 – S61.
[11]Huo W,Zhang K,Nie Z,et al.Kidney injury molecule -1(KIM-1):a novel kidney-specific injury molecule playing potential double-edged functions in kidney injury[J].Transplant Rev(Orlando),2010,24(3):143 -146.
