Cx43蛋白的表达与不同类型肿瘤转移的相关性探讨*
2012-09-21汪秋鸿张素素郭瑞珍王海青
汪秋鸿,边 可,张素素,郭瑞珍,王海青
(遵义医学院珠海校区1.2008级临床医疗系,2.病理学教研室,广东 珠海 519041)
肿瘤转移是恶性肿瘤生物学特性的表现之一,针对同源性两种肿瘤转移率不同,和恶性肿瘤早期、晚期发生转移的几率不同等问题,本研究选用细胞间隙连接蛋白43(Cx43),采用免疫组织化学方法,检测来源相同但转移能力却不同的皮肤基底细胞癌(basal cell carcinoma.BCC)和皮肤鳞状细胞癌(squamous cell carcinoma.SCC),检测乳腺癌有转移和无转移的肿瘤组织中Cx43蛋白的表达,探讨Cx43与上述肿瘤转移的相关性及生物学行为的异样。
1 材料与方法
1.1 受检标本 收集2008年8月至2010年12月遵义医学院第五附属医院病理科的外检石蜡包埋标本,连续4μm厚切片,每例4张,备用。常规HE染色,光镜观察,确诊。所有病例术前均未经放疗和(或)化疗。
1.1.1 皮肤 BCC和 SCC组 皮肤BCC 15例,男性6例,女性4例,年龄35~74岁,平均65岁,均发生在颜面部。SCC组10例,男6例,女4例;年龄17~83岁,平均62.50岁;下肢3例,头皮4例,耳周及面部各3例,上肢、颈部及腹部各1例。BCC组织学类型包括有表浅型基底细胞癌、结节型基底细胞癌和色素性基底细胞癌,SCC病例均为高分化的鳞状细胞癌。
1.1.2 乳腺癌组 25例,均为女性患者。其中无淋巴结转移13例,年龄36~72岁,平均50.4岁,左乳腺5例,右乳腺8例;有淋巴结转移12例,年龄40~47岁,平均43岁,左乳腺7例,右乳腺5例,均为同侧腋窝淋巴结转移。组织学类型包括有浸润性导管癌、导管内癌。
1.2 试剂 兔抗人Cx43多克隆抗体、S-P免疫组化试剂盒、DAB显色试剂盒购自福州迈新生物技术开发公司。
1.3 实验方法 Cx43的免疫组化染色(S-P法),以子宫平滑肌组织为阳性对照,以PBS代替一抗作为空白对照。切片常规脱蜡至水,微波抗原修复,操作步骤按试剂盒说明书进行,经DAB显色,苏木素复染,脱水干燥、透明,中性树胶封片,显微镜下观察。
1.4 结果判断
1.4.1 阳性表达部位 DAB显色:CyclinA以细胞核出现棕黄色颗粒为阳性细胞,部分出现胞质阳性表达;CyclinA mRNA以细胞质出现棕黄色颗粒为阳性细胞;CyclinD1以细胞质/细胞核出现棕黄色颗粒为阳性细胞。AEC显色:CyclinD1mRNA以细胞质/细胞核出现红色颗粒为阳性细胞。
1.4.2 阳性表达半定量积分法 根据每张切片的阳性细胞百分数和染色强度计分的乘积来判定[1]。每例切片在高倍镜(400倍)下随机取10个视野,计数100个细胞/视野,分别记录每个视野的阳性细胞数并计算其算术平均值,对阳性细胞所占百分比计分(<5%=0分,5% ~25%=1分,26%~50%=2分,51% ~75%=3分,>75%=4分);染色强度计分(无色=0分,淡黄色=1分,棕黄色=2分,棕褐色=3分);阳性表达评分标准以阳性细胞数和染色强度计分的乘积来判定,根据阳性细胞百分数和染色强度得分之积分为4个等级:0~2分为阴性(-),3~5分为阳性(+),6~8分为中度阳性(++),9~12分为强阳性(+++)。≥6分为高表达,<6分为低表达。
1.4.3 表达面积和灰度值 采用CCD成像结合图像分析系统在200倍光镜下,分析测定每个视野的阳性染色面积与分析区域面积比值、平均灰度值(灰度值越大,表明阳性细胞着色越深,蛋白表达强度越高)[2]。
1.5 统计学方法 运用SPSS 13.0统计软件包,数据以均数±标准差(±s)表示,然后进行单因素方差分析,以P<0.05代表有统计学意义。
2 结果
2.1 Cx43蛋白在BCC和SCC中的表达 Cx43蛋白在BCC组织中呈阳性或弱阳性表达,在SCC中呈弱阳性或阴性表达(见图1)。BCC和SCC组织中Cx43蛋白的表达(表达水平、表达强度)有显著性差异(P<0.01,见表 1)。

图1 基底细胞癌和鳞状细胞癌中Cx43蛋白的表达(IHC×400)
2.2 Cx43蛋白在乳腺癌组织中的表达 Cx43在无淋巴结转移的乳腺癌组织中呈阳性或弱阳性表达,在有淋巴结转移乳腺癌组织中呈弱阳性或阴性表达(见图2),无转移组的表达明显高于有转移组,差异有统计学意义(P<0.01,见表1)。
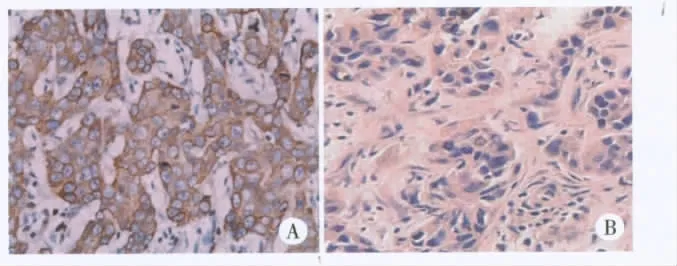
图2 无转移乳腺癌和有转移乳腺癌中Cx43蛋白的表达(IHC×400)
表1 各组组织中Cx43蛋白的表达(±s)
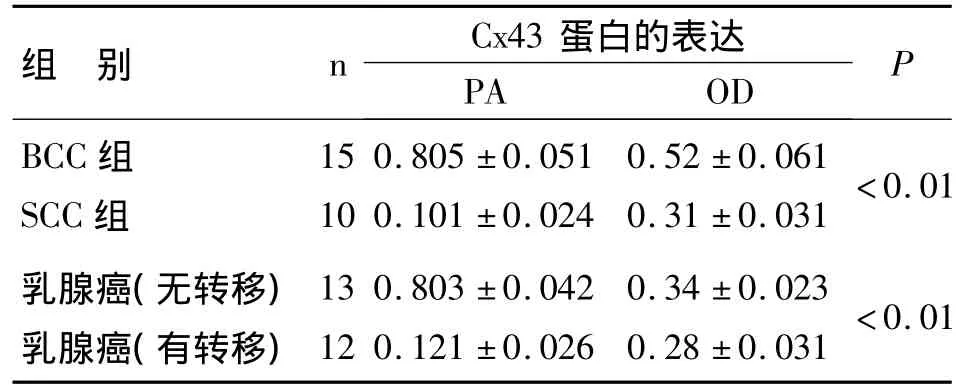
表1 各组组织中Cx43蛋白的表达(±s)
注:PA:代表阳性面积/分析区域面积;OD:代表光密度。
组 别 n Cx43蛋白的表达PA OD P BCC组SCC组15 10 0.805 ±0.051 0.101 ±0.024 0.52 ±0.061 0.31 ±0.031<0.01乳腺癌(无转移)乳腺癌(有转移)13 12 0.803 ±0.042 0.121 ±0.026 0.34 ±0.023 0.28 ±0.031<0.01
3 讨论
恶性肿瘤的侵袭转移是一个十分复杂的生物学过程,而其侵袭转移潜能的高低受多方面因素的影响。Cx43是人体内一种主要的细胞间隙连接蛋白,是近年发现的新的肿瘤抑制基因[3],Cx43基因表达异常及其导致的细胞间隙连接通讯(gap junctional intercellular communication.GJIC)功能改变与多种肿瘤的发生关系密切,GJIC功能降低与肿瘤的转移有关[4,5]。本组通过检测Cx43蛋白在BCC、SCC、有转移和无转移的乳腺癌组织中的表达,获得有意义的结果。
BCC和SCC均由皮肤表皮发生,所以称之为同源性皮肤恶性肿瘤,但在临床上,两种肿瘤的生物学行为却完全不一样。BCC具有生长缓慢、对局部组织破坏性、侵袭性很强,却极少发生转移的特殊生物学行为,是所有恶性肿瘤中唯一几乎不发生转移的恶性肿瘤。而SCC病变发展较快,具有很强的浸润转移能力,其转移明显高于BCC。目前,关于BCC特有生物学行为相关方面的研究,越来越受到人们的关注和重视。但是,Cx43与皮肤恶性肿瘤的相关性研究报道却较少。2010年郭瑞珍报道[6]Cx43在皮肤表皮、皮肤瘢痕上皮和瘢痕癌组织中的表达,发现Cx43及其mRNA在皮肤表皮、皮肤瘢痕上皮和瘢痕癌组织中的表达逐渐降低,而且两两比较有统计学意义,我们认为与正常皮肤表皮比较,Cx43及其mRNA的低表达,与瘢痕癌的发生有相关性,可能与瘢痕上皮癌变也有相关性。Cx43蛋白在BCC中的表达水平和表达强度均高于SCC组,差异有统计学意义(P<0.01),这种表达的差异,提示与SCC比较,BCC中Cx43蛋白高表达可能与其生长缓慢及极少转移的生物学特性有关,反之,其低表达可能与SCC的发生和易出现转移有相关性。在BCC中,Cx43的转移抑制作用可能占有重要地位,发挥了更大的作用。因此,不同转移潜能的肿瘤组织中,Cx43蛋白表达的强度不尽相同,其转移能力受GJIC功能强弱的影响。
乳腺癌是妇女发病率和死亡率最高的恶性肿瘤之一,远处转移是乳腺癌患者死亡的主要原因。Cx43是人类乳腺组织中主要表达的连接蛋白之一,Cx43的异常表达,在乳腺癌的发生、发展和转移方面均发挥重要作用。在肿瘤转移方面所发挥的作用目前有不同的研究结果,多项研究认为Cx43与乳腺癌的发生和转移有密切相关性,其表达与肿瘤分化程度呈正相关,而与肿瘤恶性进程和转移呈负相关[7,8]。本组在有转移和无转移的乳腺癌癌组织中检测Cx43蛋白,得出的结果与上述研究结果一致,即Cx43的表达与肿瘤转移呈负相关 。Cx43与肿瘤转移密切相关,分析其可能的机制是Cx43表达异常导致间隙连接(GJ)或GJIC异常,肿瘤细胞间的结合力下降,并能逃避正常生长控制及免疫监视,从而易于生长扩散和转移。也有认为Cx43在乳腺癌组织中表达下调可能与启动子甲基化有关。本组研究结果提示,肿瘤生长的不同时期其转移潜能不一样,肿瘤晚期转移潜能的增强,受GJIC功能逐渐减弱的影响。
综上所述,Cx43的表达与肿瘤转移呈负相关。但是,CX43在肿瘤转移方面所发挥的作用也有不同的研究结果,国内明佳等[9]探讨微小RNA-206(miR-206)和连接蛋白(Cx)43在乳腺癌原发灶(PTs)及腋窝转移淋巴结(MLNs)中的表达变化关系,结果发现与PTs相比较,MLNs中miR-206的mRNA表达较 PTs低(P<0.05),而 Cx43蛋白的表达较 PTs明显增加(P<0.05),在 PTs和MLNs中Cx43mRNA的表达没有统计学意义。我们认为在乳腺癌腋窝淋巴结转移过程中,Cx43与微小RNA基因的相互作用可能与乳腺癌腋窝淋巴结转移有关。肿瘤发生转移是多个因素、多步骤的复杂过程,Cx43基因与肿瘤发生和进展的相关性,除了蛋白水平的异常表达外,可能还有Cx基因突变,CxmRNA表达降低或异常表达等多方面的分子机制[10],这些均有待于进一步深入研究。
[1]Lu C D,Altieri D C,Tanigawa N.Expression of a novel antiapoptosis gene,survivin,correlated with tumor cell apoptosis and p53 accumulation in gastric carcinomas[J].Cancer Res,1998,58(9):1808 -1812.
[2]崔巍,王硕仁,朱陵群,等.平均光密度值分析法和阳性染色面积分析法在免疫组化图像分析中的对比研究[C].2008中华中医药学会内科分会中医内科学科建设研讨会论文汇编,2008.148 -151.
[3]King T J,Lampe P D.Temporsl regulation of connexin phosphorylation in embryonic and adult tissues[J].Biochim Biophys Acta,2005,1719(1 -2):24 -35.
[4]Wu J,Zhou H F,Wang C H,et al.Decreased expression of Cx32 and Cx43 and their function of gap junction intercellular communication in gastric cancer[J].Chinese Journal of oncology,2007,29(10):742 -747.
[5]王海琴,霍继荣,胡继雄,等.Cx43基因在肝细胞癌中的表达及意义[J].中国老年学杂志,2008,28(1):35 -36.
[6]郭瑞珍,王娟,陈世玖.Cx43、Survivin、PTEN 在皮肤瘢痕及瘢痕癌组织中的表达[J].肿瘤防治研究,2010,37(1):81-84.
[7]Li Z,Zhou Z,Donahue H J.Alterations in Cx43 and OB -cadher in affect breast cancer cell metastatic potential.[J].Clin Exp Metastasis,2008,25(3):265 -272.
[8]张光谋,徐振平,张志谦,等.乳腺癌中间隙连接蛋白Cx43和Cx26表达的意义[J].实用肿瘤杂志,2002,17(3):170-172.
[9]明佳,范林军,钟玲,等.微小RNA206和连接蛋白43在乳腺癌原发灶及腋窝淋巴结中的表达变化[J].中华乳腺病杂志(电子版),2011,5(1):65 -71.
[10]梁智勇,史景泉.缝隙连接细胞间通讯与肿瘤的关系[J].临床与实验病理学杂志,2001,17(5):432 -434.
