谷氧还蛋白1和硫氧还蛋白1基因在云南乌金猪不同组织中的表达特点及L-组氨酸对其在氧化应激细胞中表达的影响
2012-09-20张春勇陈克嶙黄金昌郭荣富
张春勇 陈克嶙 黄金昌 郭荣富
(云南农业大学,云南省动物营养与饲料重点实验室,昆明 650201)
乌金猪是云南高原的特色猪种,具有耐粗饲、肉质鲜嫩、肌肉脂肪含量高等特点,是研发高端优质猪肉重要的种质资源。乌金猪长期生活在2 200 m以上的高海拔地区,通常认为其具有较强的抗逆、抗病和抗氧化特性,但因紫外线作用可产生氧化应激,使机体产生活性氧簇(ROS),使过氧化氢(H2O2)、超氧阳离子(O2-)和羟自由基(OH-)等在体内或细胞内蓄积,引起氧化损伤,从而诱导机体抗氧化能力发生变化。而谷氧还蛋白(glutaredoxin,GRX)和硫氧还蛋白(thioredoxin,TRX)作为机体内重要的抗氧化防御体系,对消除体内由ROS引起的氧化应激损伤具有重要的作用,GRX和TRX分别由GRX1和TRX1基因编码,它们分别是抗氧化酶和非酶系统的成员,具有抗衰老、强抗氧化效应[1]。因此,研究乌金猪不同组织GRX1和TRX1基因表达规律及其调节作用,对探索乌金猪特有抗逆性和缓解其氧化应激损伤具有重要科学意义。迄今为止,国内外对乌金猪GRX1和TRX1基因表达、营养素的调节作用及其作用机制的研究鲜见报道,特别是对云南乌金猪的抗氧化适应性的研究未见报道。由此我们提出如下假设:氧化应激可刺激GRX1、TRX1基因产生过表达,而通过功能性营养素可能调节氧化应激细胞中GRX1、TRX1基因的表达,从而增强猪的抗氧化能力,这可能是通过营养途径缓解机体氧化应激损伤的重要方式之一。为检验上述假设,本试验采用实时荧光定量PCR(RT-qPCR)和体外H2O2刺激细胞建立氧化应激细胞模型的方法,分别测定云南乌金猪肝脏、皮肤、十二指肠、空肠、回肠等11种组织中GRX1和TRX1基因相对表达量;以H2O2刺激氧化应激细胞 GRX1、TRX1基因产生过表达,探讨L-组氨酸对GRX1、TRX1基因的调节作用。旨在为增强云南乌金猪抗氧化能力、发挥其特色资源优势和开发高端优质猪肉提供科学依据。
1 材料与方法
1.1 试验材料
选取2月龄、健康、饲养方式相同和体重相近的云南乌金猪12头,屠宰后迅速取出脑垂体、下丘脑、甲状腺、胸腺、胰腺、生殖腺、肝脏、皮肤、十二指肠、空肠、回肠11种组织,液氮速冻,-80℃保存。
细胞培养试验采用乌金猪胎儿皮肤成纤维细胞(pig fetal skin fibroblasts,PFSF)为研究对象,以H2O2为氧化应激源构建氧化应激细胞模型,整个试验均在细胞的4~5代间进行。
1.2 主要试剂与仪器
RNAsimple Total RNA Kit(北京天根生化科技有限公司);PrimeScripRT Master Mix(Perfect Real Time)反转录试剂盒(日本TaKaRa公司);SsoFastTMEva GreeSupermix(美国Bio-Rad公司);维生素E(美国Sigma公司);DMEM/F12细胞培养基、胎牛血清(美国Gibco公司)。
细胞培养箱(美国Thermo公司);Bio-Rad CFX96TMReal-Time PCR仪(美国Bio-Rad公司)。
1.3 试验方法
1.3.1 引物设计及合成
利用Primer 5.0软件进行引物设计,并用NCBI数据库中的Primer-Blast工具确认引物的特异性,由上海英骏生物技术有限公司合成,选用在猪机体内稳定表达的 β-肌动蛋白(β-actin)、甘油醛-3-磷酸脱氢酶(GAPDH)、TATA框结合蛋白(TBP)3个基因作为内参基因[2-3],引物信息见表1。

表1 实时荧光定量PCR引物信息Table1 Information of primers used for RT-qPCR
1.3.2 细胞培养
参照黄金昌[2]方法进行,PFSF来源于妊娠40~50 d的乌金猪胎儿背部组织,在含10%的胎牛血清的DMEM/F12培养液中,37℃、5%CO2饱和湿度条件下培养。用胰酶消化、传代,取增殖旺盛、状态良好的细胞用于试验研究。非应激细胞(正常态细胞):用含10%胎牛血清的DMEM/F12培养液培养;氧化应激细胞:用含有10 μmol/L H2O2DMEM/F12 培养液应激 5 min。处理5 min后,非应激细胞和氧化应激细胞同时移去培养板中的培养液,用PBS缓冲液冲洗1次,换用含有L-组氨酸的DMEM/F12培养液,具体浓度分 别 是 0(对 照 组)、35、70、140、280 和560 μg/mL,DMEM/F12培养液中含有 5%的胎牛血清。以24 h为考察点,用胰酶消化细胞,移入离心管待用。
1.3.3 总RNA提取及cDNA的合成
按照RNAsimple Total RNA Kit试剂盒说明书提取各组织和细胞中的总RNA,置于超低温冰箱中,-80℃保存。分别吸取1 μL总RNA溶液,使用核酸蛋白测定仪分别测定OD260nm、OD280nm值;将所提取的总RNA用1.5%琼脂糖凝胶电泳检测RNA完整性。参照PrimeScripRT Master Mix(Perfect Real Time)说明书,合成cDNA第1条链,-20℃保存。
1.3.4 标准品制备
以cDNA为模板进行PCR,扩增产物经琼脂糖凝胶DNA回收试剂盒回收目的片段。使用EASY Dilution(日本TaKaRa公司)先100倍稀释回收产物,然后10倍梯度连续稀释得到RT-qPCR的标准品。
1.3.5 标准曲线的建立和目的基因定量
RT-qPCR采用染料法,反应在Bio-Rad CFX96TMReal-Time PCR仪上进行。按照预先筛选好的RT-qPCR反应条件和体系将上述标准品进行扩增。每次反应都设置标准品、未知样品(重复3次)和1个阴性对照。结果通过Bio-Rad CFX96TM软件分析制作标准曲线,根据标准曲线和熔解曲线的阈值循环(Ct)值计算定量结果。
RT-qPCR反应体系为 20 μL:SsoFastTMEva GreeSuperMix 10 μL,上、下游引物(10 μmol/L)各1 μL,cDNA 模板2 μL,灭菌去离子水6 μL。
反应条件为:95℃预变性30 s,95℃变性5 s,55.5℃退火20 s,72℃延伸15 s,40个循环。
1.4 统计分析
所有检测组织以及细胞中的GRX1和TRX1基因的表达量均是以β-actin、GAPDH、TBP为内参基因,最终以相对表达量来表示,计算方法参照Pfaffl等[3]报道的方法,使用 SAS 8.20软件进行最小二乘均值分析,结果以最小二乘均值±标准差表示,均值间的多重比较用Duncan氏法进行。
2 结果
2.1 细胞氧化应激模型的建立
依据含H2O2DMEM/F12培养液诱导细胞氧化应激预试验的结果和参考 Gallogly等[4]的报道,本试验最终选用10 μmol/L H2O2DMEM/F12培养液,应激时间为5 min。PFSF的各种形态如图1所示。
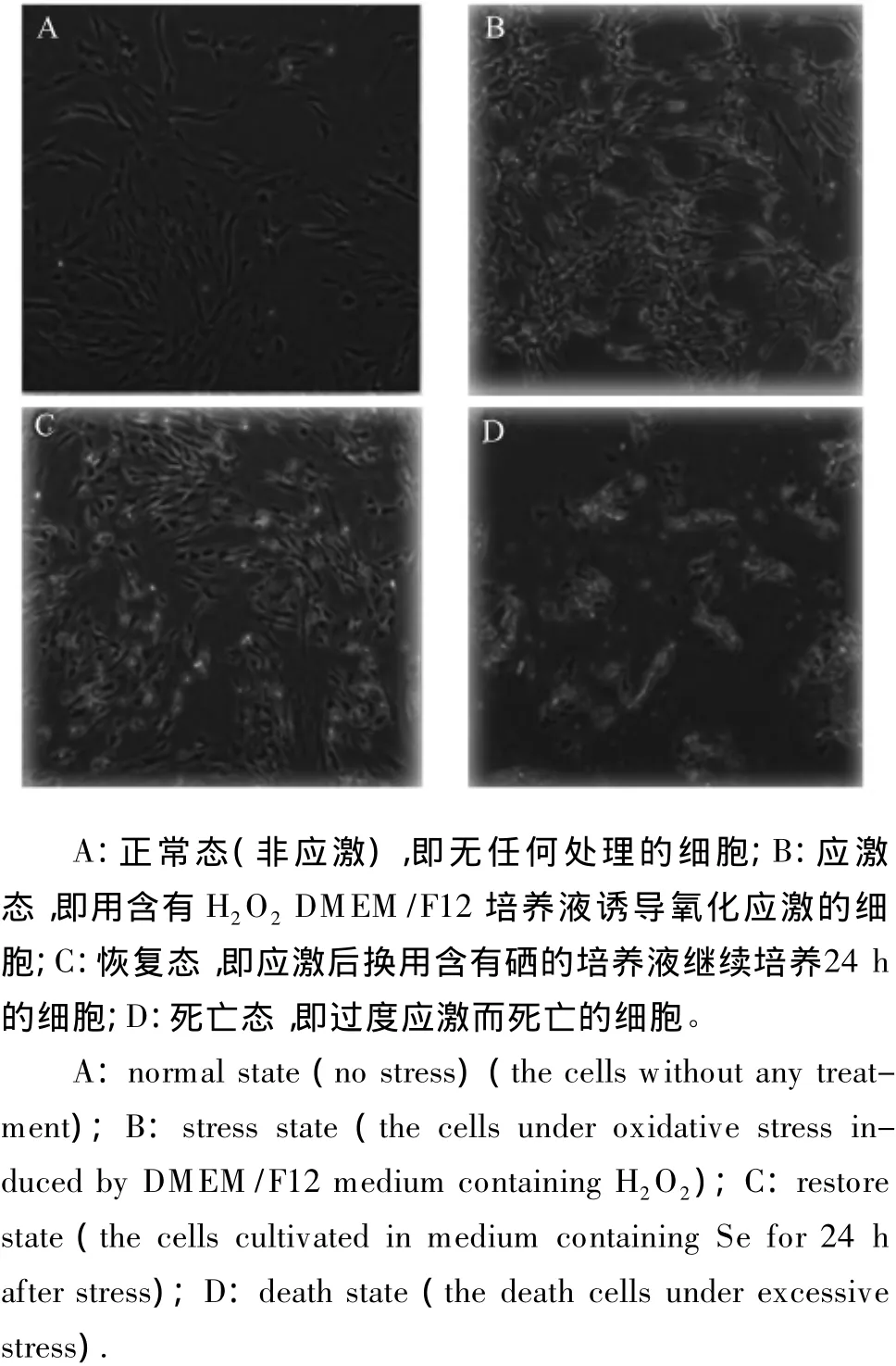
图1 PFSF的形态Fig.1 Morphology of PFSF(40×)
2.2 总RNA的提取与鉴定
所提取的总RNA用1.5%琼脂糖凝胶电泳鉴定其完整性,如图2所示,28S、18S条带清晰,无DNA污染条带,OD260nm/OD280nm在1.8~2.0之间,表明提取的总RNA纯度较高。

图2 总RNA凝胶电泳结果Fig.2 Agarose gel electrophoresis result of total RNA
2.3 标准曲线和熔解曲线
本试验的标准曲线的相关系数(R2)和扩增效率(E)均等于或接近1.000,说明本试验得到的Ct值可以准确确定起始cDNA拷贝数,试验误差较小,可信度较高。
本试验目的基因定量分析的熔解曲线均有一个单一的峰,如图3所示,说明在扩增过程中没有非特异性扩增和引物二聚体的产生,荧光强度均来自于特异性扩增。
图3 实时荧光定量PCR反应产物熔解曲线Fig.3 Melting curve of RT-qPCR product
2.4 乌金猪组织中GRX1和TRX1基因的表达差异
乌金猪肝脏、皮肤、十二指肠、空肠、回肠等11种组织均检测到GRX1和TRX1基因表达,其基因表达谱为:肝脏GRX1和TRX1基因表达量最高,其次为皮肤和空肠,内分泌腺和其他组织的表达量较低。各种被检测乌金猪组织中TRX1基因表达量均高于GRX1基因。
由图4可知,肝脏中GRX1和TRX1基因表达量均极显著高于皮肤(P<0.01);肝脏和皮肤TRX1基因表达量显著高于GRX1基因(P<0.05)。
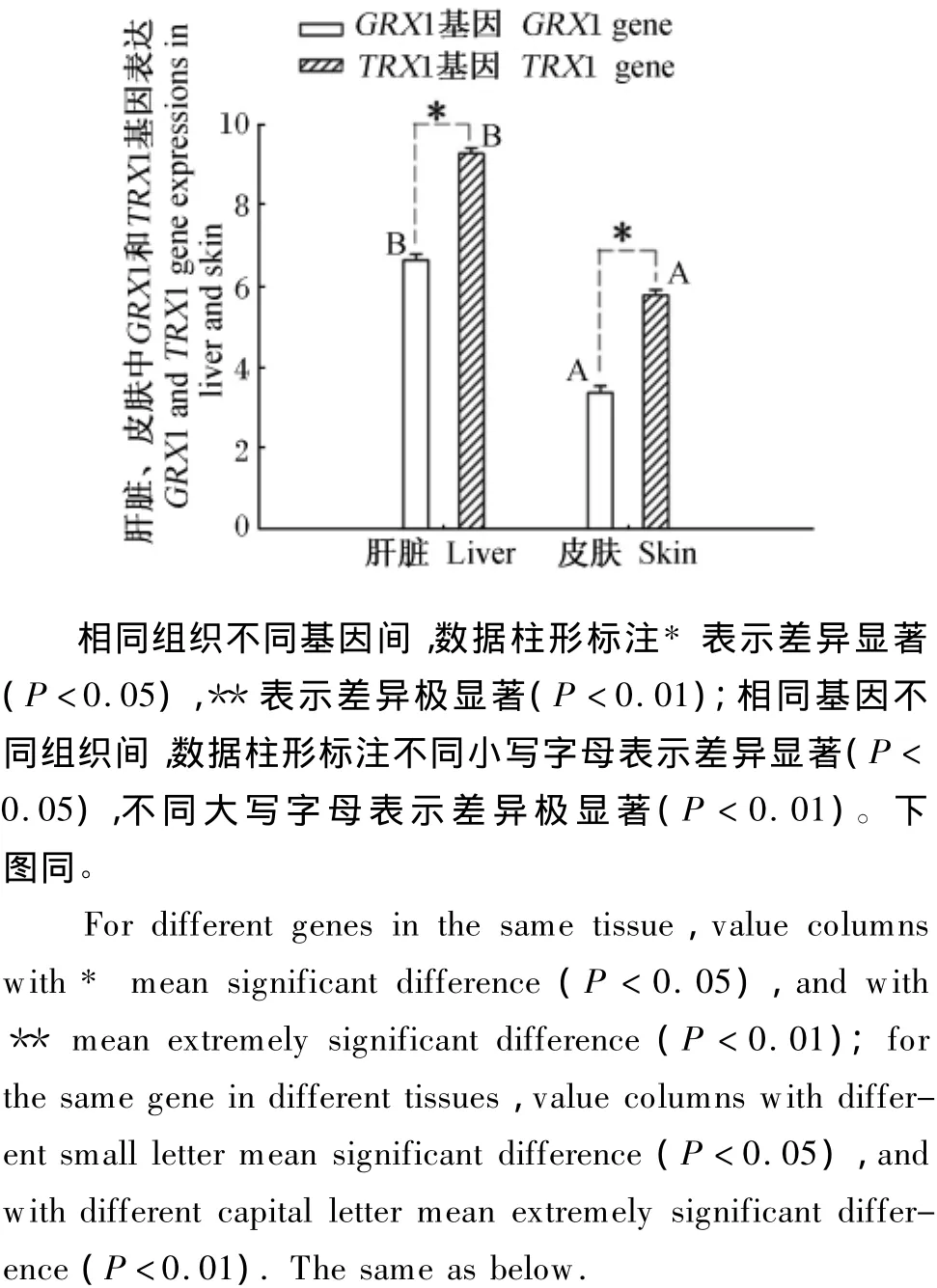
图4 乌金猪肝脏和皮肤中GRX1和TRX1基因的表达Fig.4 GRX1 and TRX1 gene expressions in liver and skin of Wujin pigs
由图5可知,空肠中TRX1基因表达量极显著高于十二指肠和回肠(P<0.01);而空肠中GRX1基因表达量显著高于十二指肠和回肠(P<0.05)。被检测十二指肠、空肠和回肠TRX1基因表达量均显著或极显著高于GRX1基因(P<0.05或P<0.01)。

图5 乌金猪小肠中GRX1和TRX1基因的表达Fig.5 GRX1 and TRX1 gene expressions in intestine of Wujin pigs
由图6可知,下丘脑中GRX1基因表达量显著高于垂体和甲状腺(P<0.05),垂体、甲状腺与胸腺间差异不显著(P>0.05);垂体和胸腺中TRX1基因表达量显著高于下丘脑和甲状腺(P<0.05),而垂体、胸腺和下丘脑与甲状腺间差异不显著(P>0.05)。被检测内分泌腺中TRX1基因表达量均显著或极显著高于GRX1基因表达量(P<0.05或 P<0.01)。

图6 乌金猪内分泌腺中GRX1和TRX1基因的表达Fig.6 GRX1 and TRX1 gene expressions in endocrine glands of Wujin pigs
由图7可知,胰腺和生殖腺中TRX1基因表达量显著或极显著高于GRX1基因(P<0.05或P<0.01)。
2.5 L-组氨酸对氧化应激细胞GRX1和TRX1基因表达的影响
由图8可知,对 GRX1基因,与对照组相比(0 μg/mL L- 组氨酸),添加 280 μg/mL L- 组氨酸显著提高非应激细胞GRX1基因表达(P<0.05),其他浓度 L-组氨酸差异不显著(P>0.05);添加280和560 μg/mL L-组氨酸均显著提高氧化应激细胞中GRX1基因表达(P<0.05),而其他浓度L-组氨酸不影响GRX1基因表达(P > 0.05);添加 35、70、140、280 和 560 μg/mL L-组氨酸使非应激细胞和氧化应激细胞间GRX1基因表达差异达到显著或极显著水平(P<0.05或P<0.01)。

图7 乌金猪胰腺、生殖腺中GRX1和TRX1基因的表达Fig.7 GRX1 and TRX1 gene expressions in pancreas and gonad of Wujin pigs
由图9可知,对TRX1基因,与对照组相比,添加280 μg/mL L-组氨酸显著提高非应激细胞中TRX1基因表达(P<0.05),其他浓度L-组氨酸差异不显著(P>0.05);而添加 140、280和560 μg/mL L-组氨酸均显著提高氧化应激细胞中TRX1基因表达(P<0.05),其他浓度L-组氨酸差异不显著(P >0.05);添加35、70、140、280 和560 μg/mL L-组氨酸使非应激细胞和氧化应激细胞间TRX1基因表达差异达到显著或极显著水平(P<0.05或P<0.01)。
3 讨论
3.1 乌金猪组织中GRX1、TRX1基因表达规律
GRX和TRX是独立于谷胱甘肽过氧物酶(GSH-Px)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)抗氧化酶的抗氧化系统,分别为猪体内抗氧化酶系统和非酶系统的主要成员,具有重要的抗氧化作用[5]。本试验检测了乌金猪脑垂体、下丘脑、甲状腺、胸腺、胰腺、生殖腺、肝脏、皮肤、十二指肠、空肠、回肠11种组织中GRX1和TRX1基因表达,结果表明,GRX1和TRX1基因表达谱为:肝脏中GRX1和TRX1基因表达量最高,其次为皮肤和空肠,内分泌腺和其他组织的表达量较低,GRX1和TRX1基因表达具有明显的组织特异性,TRX1基因表达量明显高于GRX1基因。

图8 L-组氨酸对乌金猪氧化应激细胞中GRX1基因表达的影响Fig.8 Effects of L-histidine on GRX1 gene expression in oxidative stress cells of Wujin pigs

图9 L-组氨酸对乌金猪氧化应激细胞中TRX1基因表达的影响Fig.9 Effects of L-histidine on TRX1 gene expression of oxidative stress cells of Wujin pigs
肝脏是动物营养物质代谢和解毒的重要器官,在乌金猪适应云南高原立体生态环境中具有重要作用。乌金猪的高原生物适应性和抗氧化能力是其维持健康和生长潜力的重要基础。本试验结果显示,肝脏中GRX1和TRX1基因表达量最高,结果提示了GRX1和TRX1基因在乌金猪抗氧化生物学过程中扮演重要角色;皮肤是猪与外界环境之间交流的第一道防御屏障,皮肤细胞参与了抗原生成、趋化因子和细胞因子的产生等过程[6-7],本试验结果表明,皮肤是 GRX1和 TRX1基因表达量最高的组织之一,结果显示,GRX1和TRX1基因在猪的抗氧化保护方面起重要作用。
消化道是猪对饲料养分消化吸收与代谢的重要器官,消化道还是猪体内最大的分泌器官和免疫器官。本研究结果表明,乌金猪空肠中GRX1和TRX1基因表达量显著高于内分泌腺、生殖腺和胰腺组织,结果提示:GRX1和TRX1基因对乌金猪肠道健康可能具有抗氧化保护作用。内分泌腺、胰腺和生殖腺中GRX1和TRX1基因表达量相对较低,其作用机理有待研究。
乌金猪不同组织中GRX1和TRX1基因差异性表达研究显示,具有明显组织特异性。结果提示:11种组织检测到GRX1和TRX1基因表达,说明这些组织可能与乌金猪机体抗氧化能力有关,但不同组织的抗氧化生物学意义可能存在明显差异。硒蛋白或硒酶是目前研究较多的抗氧化蛋白,Kryukov等[8]研究表明,目前已确认了25种人类和24种啮齿动物硒蛋白,而许多硒蛋白或硒酶对清除自由基和保护细胞膜完整性等方面均具有重要生物学功能。硒蛋白研究结果能给我们很好启发,推测乌金猪不同组织中GRX、TRX的存在形式或功能具有多样性,其调节机制更为复杂,这也为进一步深入研究乌金猪不同组织中GRX、TRX抗氧化生物学功能开创了新的研究领域,研究结果可为阐明乌金猪的抗氧化特性及其调节机制提供科学依据。
3.2 L-组氨酸对氧化应激细胞中GRX1、TRX1基因的诱导表达
L-组氨酸是猪的一种必需氨基酸,在体内肌肽合成酶下参与合成肌肽而发挥抗氧化作用。本试验结果表明,添加L-组氨酸对氧化应激细胞和非应激细胞中GRX1和TRX1基因均有明显上调表达作用,当L-组氨酸浓度达280和560 μg/mL时,GRX1基因表达量显著高于对照组和其他组,当L-组氨酸浓度达140、280和560 μg/mL时,TRX1基因表达量显著高于对照组和其他组。对氧化应激细胞或非应激细胞,当L-组氨酸浓度为280 μg/mL时,GRX1和TRX1基因表达量均显著高于对照组和其他组。未添加L-组氨酸的氧化应激细胞与非应激细胞间GRX1基因表达量无显著差异,不同浓度L-组氨酸对氧化应激细胞中GRX1和TRX1基因表达量均显著或极显著高于非应激细胞。Kondo等[9]研究表明,在人类 T淋巴细胞受到H2O2应激时,TRX1基因会大量表达;Gallogly等[4]发现,在氧化应激状态下,细胞中的GRX1基因表达量会增加,抑制GRX1基因表达时,氧化性的细胞增加;Berggren等[10]报道,在缺硒的动物体内或人类细胞系中硫氧还蛋白还原酶(TRXR)活性显著下降,补充微量元素硒后,TRXR活性增加。上述报道表明,氧化应激或添加营养素可诱导应激细胞中GRX1或TRX1基因表达,本试验添加L-组氨酸均能诱导氧化应激细胞或非应激细胞中GRX1或TRX1基因表达上调。
动物机体内L-组氨酸通过肌肽而发挥抗氧化作用,肌肽是一种较强的自由基清除剂,具有重要抗氧化特性,能够保护细胞膜,阻止猪细胞膜的过氧化反应,其抗氧化机理可能在于肌肽的咪唑环的共轭π键及酰胺键的作用。肌肽中L-组氨酸残基上的咪唑环N原子和肽键N原子对金属离子进行螯合,抑制由金属离子引起的脂肪氧化,其L-组氨酸对羟基自由基和过氧化自由基具有捕捉能力,抑制非金属离子引起的脂肪氧化作用[11-12]。关于动物体内 L-组氨酸与 GRX1、TRX1基因及肌肽间抗氧化作用机制有待进一步研究。
综上所述,乌金猪肝脏、皮肤中GRX1、TRX1基因的表达量最高,空肠,胰腺、内分泌腺和生殖腺表达量相对较低,且组织中TRX1基因表达量明显高于GRX1基因,并具有明显组织特异性。H2O2氧化应激可刺激乌金猪细胞中GRX1、TRX1基因产生过表达,而通过功能性营养素可能诱导氧化应激细胞中GRX1、TRX1基因的表达,增强乌金猪的抗氧化能力,这可能是通过营养途径缓解机体氧化应激损伤的重要方式之一。
4 结论
①云南乌金猪11种组织中均有GRX1和TRX1基因表达,其基因表达谱为:肝脏中GRX1和TRX1基因表达量最高,其次为皮肤和空肠,胰腺、内分泌腺和其他组织的表达量较低;GRX1和TRX1基因具有明显组织特异性;TRX1基因表达量明显高于GRX1基因。
②H2O2刺激乌金猪细胞时,L-组氨酸对氧化应激细胞和非应激细胞中GRX1和TRX1基因具有明显上调作用,L-组氨酸适宜浓度为280 μg/mL。
③通过营养途径即添加适宜浓度L-组氨酸可诱导GRX1和TRX1基因表达明显上调,这可能是改善云南乌金猪抗氧化能力的重要方式之一。但对GRX1和TRX1基因的抗氧化机制有待进一步研究。
[1]HOLMGREN A.Antioxidant function of thioredoxin and glutaredoxin systems[J].Antioxidants & Redox Signaling,2000,2(4):811-820.
[2]黄金昌,猪GRX1、TRX1基因表达特点及Se、VE的调节作用[D].硕士学位论文.昆明:云南农业大学,2011:6.
[3]PFAFFL M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Research,2001,29(9):45-50.
[4]GALLOGLY M M,SHELTON M D,QANUNGO S,et al.Glutaredoxin regulates apoptosis in cardiomyocytes via NFκB targets Bcl-2 and Bcl-xL:implications for cardiac aging[J].Antioxidants & Redox Signaling,2010,12(6):1339-1353.
[5]黄金昌,郭荣富.谷氧还蛋白和硫氧化蛋白对动物抗氧化应激生物学效应的研究进展[J].动物营养学报,2010,22(4):845-850.
[6]ANDERSON R R,PARRISH J A.The optics of human skin[J].Journal of Investigative Dermatology,1981,77:13-19.
[7]NESTLE F O,DI MEGLIO P,QIN J Z,et al.Skin immune sentinels in health and disease[J].Nature Reviews Immunology,2009,9(10):679-691.
[8]KRYUKOV G V,CASTELLANO S,NOVOSELOV S V,et al.Characterization of mammalian selenoproteomes[J].Science,2003,300:1439-1443.
[9]KONDO N,ISHII Y,KWON Y W,et al.Redox-sensing release of human thioredoxin from T lymphocytes with negative feedback loops[J].The Journal of Immunology,2004,172(1):442-448.
[10]BERGGREN M,GALLEGOS A,GASDASKA J,et al.Cellular thioredoxin reductase activity is regulated by selenium [J].Anticancer Research,1997,17:3377-3380.
[11]KANSCI G,GENOT C,MEYNIER A,et al,The antioxidant activity of carnosine and its consequences on the volatile profiles of liposomes during ironlascorbate induced phospholipids oxidation[J].Food Chemistry,1997,60(2):165-175.
[12]AARON L,ANTHONY S.Structures of the coppercarosine and copper-anserine chelates[J]The Journal of Organic Chemistry,1961,26(2):617-619.
