博落回提取物对脂多糖诱导猪应激细胞应激参数及免疫球蛋白G和超氧化物歧化酶mRNA表达的影响
2012-09-20张春勇陈克嶙李美荃郭荣富
满 意 张春勇 陈克嶙 李美荃 郭荣富
(云南农业大学,云南省动物营养与饲料重点实验室,昆明 650201)
近年来抗生素使用的弊端日益严重,针对抗生素药物残留和耐药性问题,研究和应用新型抗生素替代品已成为重要课题内容。博落回(M.cordata)在动物生产中,具有广谱清热解毒消肿、抗菌等作用。而博落回提取物(MC extracts)是从罂粟科博落回属植物博落回或小果博落回(M.microcarpa)植株中提取出来的生物碱,作为安全新型抗生素替代品在畜牧业中具有广阔的应用前景。经过前期发现,添加适宜浓度博落回提取物对仔猪具有明显的促生长作用,进一步研究博落回提取物是否可作为仔猪免疫和抗氧化调节剂具有重要科学意义。研究表明,博落回提取物中主要含有苯并菲啶类生物碱血根碱和白屈菜红碱,博落回提取物中的血根碱与白屈菜红碱具有抑菌、抗肿瘤细胞增殖、保护肝脏、杀虫等作用[1-4],博落回在欧盟是允许添加的饲料添加剂之一。Vieira等[5]报道,在火鸡饲粮中添加含有博落回提取物的饲料添加剂,结果表明添加32.8 mg/kg博落回提取物能提高火鸡采食量,在35日龄时有最大的饲料转化率。饶华等[6]研究表明,血根碱和博落回提取物均能显著提高断奶仔猪的生长性能,有效缓解了断奶应激。满意[7]研究表明,博落回提取物显著改善仔猪生产性能、免疫性能和抗氧化能力,仔猪饲粮适宜添加量为4.5 mg/kg。生物碱是存在于自然界中的一类含氮的碱性有机化合物,有显著的生物活性,是中草药中重要的有效成分之一,生物碱具有提高机体免疫力和抗氧化能力的作用,但其作用机制仍不清楚,对博落回提取物是否通过影响动物相关基因表达而改善机体免疫性能和抗氧化能力的研究资料很少,迄今为止,博落回提取物对猪免疫球蛋白G(IgG)和超氧化物歧化酶(SOD)mRNA表达影响的研究鲜见报道。本试验旨在通过脂多糖(LPS)诱导猪细胞以建立应激细胞模型,检测细胞应激参数的变化,采用实时荧光定量PCR法,研究博落回提取物对猪应激和正常细胞IgG和SOD mRNA表达的影响,探讨博落回提取物对猪细胞内源IgG、SOD mRNA的诱导作用,为博落回提取物对猪抗病营养作用机理的研究提供新的试验证据。
1 材料与方法
1.1 试验材料
猪胚胎背部皮肤成纤维细胞为云南农业大学动物营养实验室冷冻保存。
本试验使用博落回提取物总生物碱含量≥60%,其中含血根碱45%、白屈菜红碱19%[7]。土霉素为广州中邦生物科技有限公司产品。
基础培养液(DMEM/F12细胞培养液)、胎牛血清、青霉素 -链霉素双抗、胰酶,均购自美国Gibco公司;LPS购于美国Sigma公司;IgG含量采用全自动生化分析仪检测;乳酸脱氢酶、溶菌酶、一氧化氮(NO)、一氧化氮合酶(NOS)试剂盒由南京建成生物工程研究所提供;总RNA提取试剂Trizol购自美国Invitrogen公司;反转录PCR试剂盒(PrimeScripRT Reagent Kit with gDNA Eraser)及荧光定量PCR试剂盒(SYBPremix Ex TaqTMⅡ)均购自日本TaKaRa公司。
利用Primer 5.0软件进行引物设计,并用NCBI数据库中的Blast工具确认引物的特异性,选用在猪机体内稳定表达的3个基因β-肌动蛋白(ACTB)、甘油醛 -3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、TATA框结合蛋白(TATA box binding protein,TBP)作为看家基因,引物由上海生工生物工程有限公司合成,序列及参数见表1。
1.2 LPS对细胞的抑制率的检测
采用6孔板和基础培养液细胞,收集对数期细胞,调整细胞悬液浓度,每孔加入100 μL,铺板使待测细胞调密度至1 000~10 000个/孔。5%CO2、37℃孵育,至细胞单层铺满孔底。加入LPS使其终浓度为 5、10、15 μg/mL,每个处理 3 个重复,每孔为1个重复。5%CO2、37℃孵育12~48 h,倒置显微镜下观察。每孔加入20 μL甲基噻唑基四唑(MTT)溶液(5 mg/mL,即 0.5%MTT),继续培养4 h。终止培养,吸去孔内培养液。每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量吸光度(OD)值,同时设置调零孔(培养基+MTT+二甲基亚砜)和对照孔(细胞+相同浓度的药物溶解介质+培养基+MTT+二甲基亚砜)。观察细胞,计算细胞的抑制率。
细胞的抑制率(%)=100×(对照孔OD-培养后细胞OD)/对照孔OD。
1.3 试验设计
细胞复苏培养后,传代培养,当细胞长满培养瓶时进行以下处理。
LPS溶解于基础培养液中至终浓度为10 μg/mL,培育12 h后得到LPS应激细胞。
试验设计见表2,正常细胞和应激细胞分别进行处理,对照组采用基础培养液,土霉素组在基础培养液中添加土霉素50 μg/mL(阳性对照组),博落回组在基础培养液中分别添加50、100、150 ng/mL的博落回提取物。每个处理3个重复,1个孔为1个重复。各组细胞在37℃的条件下培养24 h后,收集各孔细胞液,3 000 r/min离心10 min,取上清液于-20℃冰箱保存待测。所有样品参测细胞的抑制率、IgG和SOD mRNA表达量;应激细胞上清液进行应激参数的检测。

表1 引物序列及参数Table1 Sequences and parameters of primers
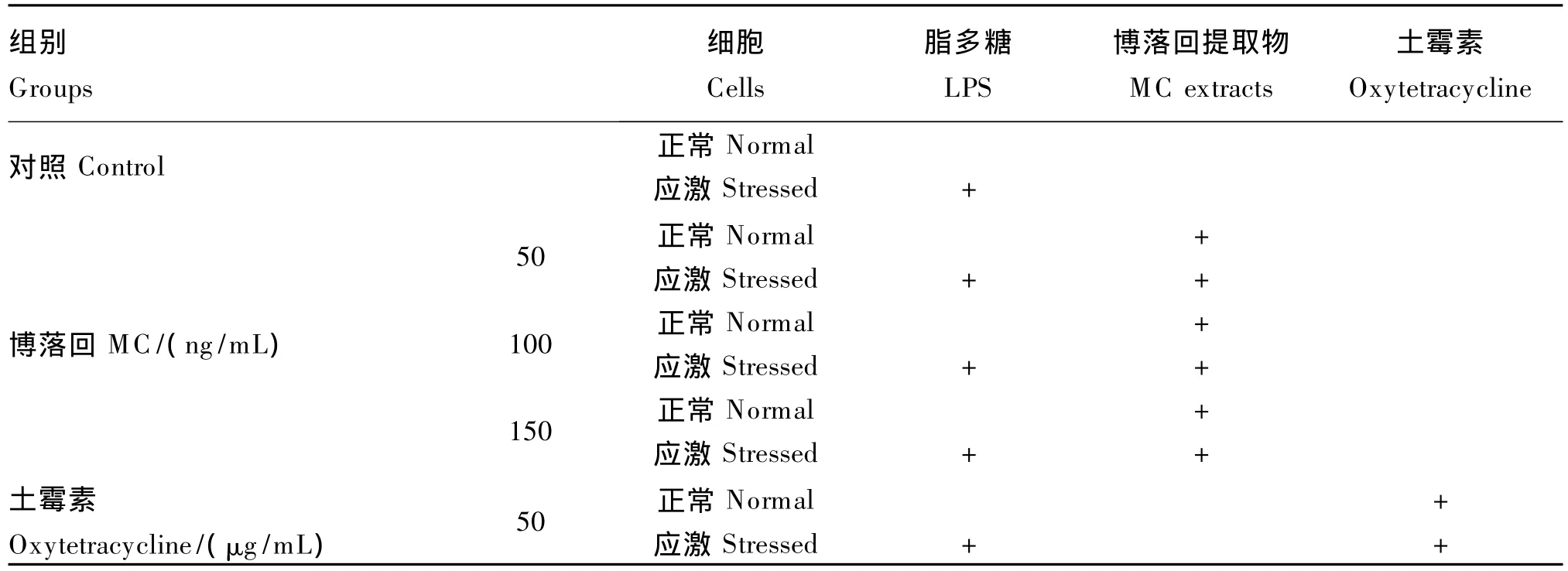
表2 试验设计Table2 The experimental design
1.4 应激参数的检测
严格按照说明书要求检测细胞培养液中IgG、溶菌酶、NO含量及NOS、乳酸脱氢酶的活性。
1.5 IgG和SOD mRNA表达量检测
用常规方法提取细胞总RNA,采用1%琼脂糖凝胶电泳鉴定总RNA抽提样品完整性。所提取的总RNA经紫外分光光度计检测。
以提取的总RNA反转录产物作为模板进行常规PCR反应,用2%琼脂糖凝胶电泳检测PCR产物。
实时荧光定量PCR采用Eva GreenⅠ染料法,反应在Bio-RadCFX 96TMReal-TimePCR Systems上进行。反应体系为 20μL:SsoFastTMEvaGREESupermix(Bio-Rad,美国)10 μL,上、下游引物(10 μmol/L)各 1.0 μL,cDNA 模板2.0 μL,加灭菌去离子水至 20 μL。样品分装于96孔板(Bio-Rad,美国)中,将可透光盖(Bio-Rad,美国)盖紧。反应条件为:95℃、10 s;95℃、5 s,59℃、20 s,72℃、15 s,40 个循环。
1.6 数据处理与分析
所有试验数据均采用SPSS 13.0软件处理和方差分析,用Duncan氏法进行多重比较,进行二次回归分析,试验结果用平均值±标准差表示。
2 结果
2.1 LPS对细胞的抑制率
在添加 LPS 使其终浓度为 5、10、15 μg/mL后,观察细胞形态,正常细胞(图1-A)和应激细胞(图1-B)形态差异不大,但是应激细胞间隙有所增大。加入博落回提取物后,细胞继续正常生长(图1-C),未加入博落回提取物的细胞因过度免疫应激而死亡,形态发生改变(图1-D)。不同浓度LPS在不同时间段对细胞的抑制率见表3,本次试验条件下LPS最适宜浓度和培养时间分别为10 μg/mL 和 12 h。

图1 LPS和博落回提取物对细胞的形态的影响Fig.1 Effects of LPS and MC extracts on cell modalities
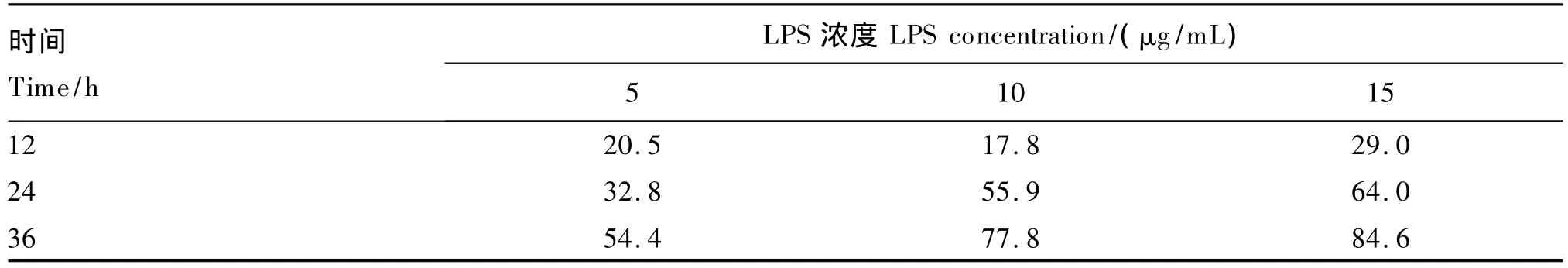
表3 不同浓度LPS在不同时间段对细胞的抑制率Table3 Inhibition rates of different concentrations of LPS on cells at different time points %
2.2 博落回提取物对猪LPS应激细胞应激参数的影响
由表4可见,经LPS刺激,在加入不同浓度博落回提取物之后,细胞培养液中IgG含量极显著高于对照组和土霉素组(P<0.01);土霉素组细胞培养液中IgG含量极显著高于对照组(P<0.01)。博落回组细胞培养液中溶菌酶含量极显著高于对照组(P<0.01);土霉素组与150 ng/mL博落回组溶菌酶含量差异不显著(P>0.05),但是这2组溶菌酶含量显著高于50和100 ng/mL博落回组(P<0.05)。博落回组与土霉素组细胞培养液中乳酸脱氢酶活性极显著低于对照组(P<0.01),50 ng/mL博落回组细胞培养液中乳酸脱氢酶活性显著低于另外2个博落回组及土霉素组(P<0.05)。博落回组NO含量及NOS活性极显著高于对照组和土霉素组(P<0.01)。

表4 博落回提取物对猪LPS应激细胞应激参数的影响Table4 Effects of MC extracts and oxytetracycline on stress parameters of cells challenged by LPS in pigs
2.3 博落回提取物对猪LPS应激细胞IgG和SOD mRNA表达量的影响
2.3.1 总RNA提取与反转录PCR产物
由图2可见,其18S、28S条带清晰,无 DNA污染条带,无明显降解条带。所提取的总RNA经紫外分光光度计检测 OD260nm/OD280nm在6~10,纯度较高。

图2 总RNA提取琼脂糖电泳图Fig.2 Agarose gel electrophoresis results of extracted total RNA
由图3可见,反转录PCR扩增产物条带清晰、明亮、无杂带,说明引物可以特异性地扩增出目的产物。
2.3.2 博落回提取物对猪LPS应激细胞IgG mRNA表达量的影响
由图4可见,对正常细胞而言,博落回组和土霉素组IgG mRNA表达量均有极显著的提高(P<0.01),博落回组提高程度极显著高于土霉素组(P<0.01)。对应激细胞而言,与对照组相比,50 ng/mL博落回组IgG mRNA表达量是对照组的1.91倍(P<0.01),100 ng/mL博落回组是对照组的1.85倍(P<0.01),150 ng/mL博落回组是对照组的1.82倍(P<0.01),但3个博落回组间差异不显著(P>0.05)。土霉素组IgG mRNA表达量是对照组的1.65倍(P<0.01)。博落回组细胞中IgG mRNA表达量均极显著高于土霉素组(P<0.01)。应激细胞与正常细胞之间比较,应激细胞IgG mRNA表达量均高于正常细胞,对照组和100 ng/mL博落回组应激细胞与正常细胞差异极显著(P<0.01),50和100 ng/mL博落回组以及土霉素组应激细胞与正常细胞差异显著(P<0.05)。

图3 反转录PCR产物琼脂糖凝胶电泳结果Fig.3 Agarose gel electrophoresis results of the RT-PCR

图4 博落回提取物对猪LPS应激细胞IgG mRNA表达量的影响Fig.4 Effects of MC extracts on IgG mRNA expression level of LPS challenged cells in pigs
2.3.3 博落回提取物对猪LPS应激细胞SOD mRNA表达量的影响
由图5可见,对正常细胞而言,博落回组和土霉素组SOD mRNA表达量均有极显著的提高(P<0.01),土霉素组提高程度极显著高于博落回组(P<0.01)。对应激细胞而言,50 ng/mL博落回组SOD mRNA表达量是对照组的1.39倍(P<0.01),150 ng/mL博落回组是对照组的1.40倍(P<0.05),100 ng/mL博落回组是对照组的1.32倍(P<0.05)。但3个博落回组间差异不显著(P>0.05)。土霉素组SOD mRNA表达量是对照组的1.69倍(P<0.01)。
应激细胞与正常细胞之间比较,对照组、50 ng/mL博落回组和土霉素组应激细胞SOD mRNA表达量极显著高于正常细胞(P<0.01),100和150 ng/mL博落回组应激细胞SOD mRNA表达显著高于正常细胞(P<0.05)。
对于应激细胞与正常细胞,土霉素组SOD mRNA表达量均极显著高于对照组及博落回组(P<0.01)。

图5 博落回提取物对猪LPS应激细胞SOD mRNA表达量的影响Fig.5 Effects of MC extracts on SOD mRNA expression level of LPS challenged cells in pigs
3 讨论
3.1 猪LPS应激细胞的应激参数的变化
血液免疫球蛋白浓度是仔猪免疫性能和健康的重要标识之一。IgG具有免疫替代和免疫调节的双重治疗效果[8]。人们试图通过多种途径来改变仔猪血液IgG浓度,从改善仔猪免疫性能和抗病力。本试验结果显示,细胞培养液中博落回组IgG含量极显著高于对照组和土霉素组(P<0.01),土霉素组也极显著高于对照组(P<0.01),说明博落回提取物和土霉素均能诱导细胞产生IgG,但博落回提取物增加IgG含量效果显著优于土霉素(P<0.01)。本试验结果表明,添加博落回提取物和土霉素均极显著提高了溶菌酶含量(P<0.01),可能缓解细胞免疫应激损伤。乳酸脱氢酶存在于组织细胞的胞质内,乳酸脱氢酶释放与细胞膜通透性和完整性有关,且释放量与细胞受损程度呈正相关,故可通过测定培养液中乳酸脱氢酶活性变化评定博落回提取物和土霉素是否损伤及损伤的程度。本试验结果表明,博落回组(50、100 ng/mL)及土霉素组细胞培养液中乳酸脱氢酶活性均极显著低于对照组(P<0.01),说明对细胞没有损伤或者损伤不大。有研究表明,通过减少白细胞来促进诱导型一氧化氮合酶(iNOS)产生,能保护肠道免受炎症损伤[9]。iNOS基因在受到细胞因子或LPS刺激时才表达,iNOS基因表达能催化合成大量的NO。LPS能刺激巨噬细胞产生 NO[10],简华刚等[11]报道,LPS 剂量在 0.001 ~0.100 μg/mL时,体外培养大鼠肺微循环内皮细胞分泌NO的量随LPS剂量的增加而增多,但当LPS剂量大于1 μg/mL,其含量不再增加。在本试验条件下,土霉素组细胞培养液NO含量和NOS活性极显著高于对照组(P<0.01),而不同浓度博落回组的细胞培养液NO含量和NOS活性均极显著高于对照组和土霉素组(P<0.01),结果说明,博落回提取物与缓解猪细胞应激损伤有关。上述结果提示,适宜浓度博落回提取物作为营养调节剂可以改善猪细胞应激参数,其作用机理有待进一步研究。
3.2 博落回提取物对猪LPS应激细胞IgG mRNA的诱导表达
IgG是由脾脏和淋巴结中的浆细胞产生的一种免疫球蛋白,是介导体液免疫的主要抗体,发挥着抗菌、抗病毒、抗毒素的免疫学效应。IgG分泌细胞在口腔黏膜、胃肠道黏膜及生殖道均有存在[12-13]。IgG是动物自然感染和人工主动免疫后机体产生的主要抗体,是动物机体抗感染的主力。在本试验中,应激细胞中IgG mRNA表达量均高于正常细胞,应激细胞中添加博落回对IgG mRNA表达量影响不显著(P>0.05),说明博落回提取物能向上调节IgG mRNA表达,土霉素组与对照组相比表达量也有所提高(P<0.01)。本试验中,IgG mRNA表达得到了增强,从而能产生更多的IgG抗体,增强体液免疫。
3.3 博落回提取物对猪LPS应激细胞SOD mRNA的诱导表达
生物碱具有抗氧化能力,生物碱能清除羟自由基使其能具有抗突变和抗基因毒性的作用[14]。SOD、谷胱甘肽过氧化物酶一起构成体内重要的抗氧化系统,保护细胞膜及细胞内的核酸免受自由基的攻击。本试验结果表明,与对照组比较,添加不同浓度博落回提取物和土霉素均能极显著提高细胞中SOD mRNA的表达量(P<0.01),博落回提取物向上调节SOD mRNA表达的能力低于土霉素,而博落回提取物各浓度之间差异不显著(P >0.05)。Slunská 等[15]通过细胞培养后发现,血根碱、白屈菜黄碱、血根黄碱、白屈菜红碱不会增加细胞活性氧族产量,并能降低过氧化氢(H2O2)含量引起的氧化应激反应,显示出具有抗氧化作用。本试验结果显示,博落回提取物能诱导SOD mRNA表达,改变SOD活性,结果可能影响猪应激细胞的抗氧化能力。其作用机理仍有待研究。
4 结论
博落回提取物可提高LPS应激细胞IgG、NO和LSZ的含量及NOS活性,提高应激细胞和正常细胞IgG和SOD mRNA的表达量,总体效果优于土霉素,较好的添加浓度为50~100 ng/mL。
[1]KOSINA P,GREGOROVA J,GRUZ J,et al.Phytochemical and antimicrobial characterization of Macleaya cordata herb[J]Fitoterapia,2010,81(8):1006-1012.
[2]ILARIA D S,GIUSEPPINA R,GIAN F Z,et al.Antiproliferative and antiangiogenic effects of the benzophenanthridine alkaloid sanguinarine in melanoma[J].Biochemical Pharmacology,2009,78(11):1374.
[3]肖俐,易键,赵静,等.博落回提取物对大鼠急性酒精性肝损伤的保护作用[J].中南药学,2011,9(7):485-489.
[4]张国洲,尤民生.博落回根杀虫有效成分分析及其活性测定[J].安徽农业大学学报,2009,36(1):18-21.
[5]VIEIRA S L,BERRES J,REIS R N,et al.Studies with sanguinarine like alkaloids as feed additive in broiler diets[J].Brazilian Journal of Poultry Science,2008,10(1):67-71.
[6]饶华,蔡鹏,周锡红,等.博落回提取物对断奶仔猪生长性能的影响[J].中国兽药杂志,2009,43(11):42-43.
[7]满意.博落回提取物对断奶仔猪生长性能、血液免疫、氧化应激指标及相关基因表达的影响[D].硕士学位论文.昆明:云南农业大学,2012.
[8]何万涛,舒永霞.人免疫球蛋白外敷治疗皮肤过敏的疗效观察[J].内蒙古中医药,2011(9):103-105.
[9]MCCAFFERTY D M,MUDGETT J S,SWAIN M G,et al.Inducible nitric oxide synthase plays a critical role in resolving intestinal inflammation[J].Gastroenterology,1997,112(3):1022-1027.
[10]段慧琴,乔健,张永东,等.LPS对大鼠黏膜微血管内皮细胞分泌 NO的影响[J].畜牧兽医学报,2005,36(9):974-976.
[11]简华刚,周继红,朱佩芳,等.内毒素对体外培养大鼠肺微血管内皮细胞的影响[J].中国危重病急救医学,2000(8):457.
[12]车传艳,赵立平,杨倩.寡果糖对人源菌群仔猪肠道中IgA和IgG分泌细胞的影响[J].动物营养学报,2007,19(1):50-55.
[13]刘胜兵,杨倩,姜平.猪繁殖与呼吸综合征弱毒苗阴道免疫对母猪子宫IgA和IgG分泌细胞的影响[J].南京农业大学学报,2005,28(1):90-93.
[14]MOURA D J,RICHTER M F,BOEIRA J M,et al.Antioxidant properties of beta-carboline alkaloids are related to their antimutagenic and antigenotoxic activities[J].Mutagenesis,2007,20(4):293-302.
[15]SLUNSKÁ Z,GELNAROVÁ E,HAMMEROVÁ J,et al.Effect of quaternary benzo[c]phenanthridine alkaloids sanguilutine and chelilutine on normal and cancer cells[J].Toxicology in Vitro,2010,24(3):697-706.
