抗盐碱转基因大豆对盐碱土根际土壤化学特性的影响
2012-09-20王宏燕邵婧鑫刘志华
王宏燕,邵婧鑫,刘志华
(东北农业大学资源与环境学院,哈尔滨 150030)
土壤盐碱化作为限制植物产量的重要因素之一,是世界性的土壤退化问题,给农业生产造成了极大的损失[1]。黑龙江省西部地区是典型的盐碱化土地,是松嫩平原盐碱化程度最严重的地区之一,重度盐碱化土地面积仍以每年1.4%的速度扩展[1]。抗盐碱转基因大豆的出现使盐碱地农业高效利用成为可能,对盐碱化土地资源的开发利用有重要意义。
转基因作物因其优越性状得到快速发展,但其负面影响也开始引起关注。近年来的研究表明,转基因作物的外源基因及其基因表达产物可通过残茬或根系分泌物进入土壤生态系统[2],进而影响土壤生态系统。Palm等将转Bt棉花枝叶埋入5种不同土壤生态系统中,140 d后仍能在3种土壤中检测到Bt毒素[3]。James的研究表明,Bt毒素可通过根系分泌物残留在土壤中,其毒性可持续2~3个月[4]。许多研究表明转基因作物根系分泌物成分的差异能不同程度地影响土壤理化性质,如团聚体大小和分布、酸碱度、阳离子交换量和吸附性能等[5]。根系分泌物中的甲酸、乙酸和草酸能降低土壤的酸碱度从而加速土壤的酸化[6]。土壤生态系统是土壤物理、化学和生物性质的综合反映,近年来的研究多集中在转基因作物对土壤生物及微生物方面的影响,而其对土壤化学特性影响的研究相对较少。本文主要研究抗盐碱转基因大豆对盐碱土壤化学特性的影响,旨在为评价抗盐碱转基因大豆对土壤生态系统的影响提供基础研究资料。
1 材料与方法
1.1 试验地概况
实验地位于黑龙江省安达市(E 125°21′781″,N 46°23.916′),海拔149.3 m,地势平坦。供试土壤为盐碱土,部分理化性状如下:全氮2 g·kg-1,速效氮 103 mg·kg-1,全 磷 2 g·kg-1,速 效 磷 27 mg·kg-1,速效钾150 mg·kg-1,pH 8.44 ,钠吸附比0.382,总碱度0.002 cmol·kg-1,碱化度0.04,阳离子交换量14 cmol·kg-1,交换性钠 0.55 cmol·kg-1。
1.2 供试品种
本试验研究对象为抗盐碱转基因大豆(Salinization resistence transgenic soybeans,SRTS),是利用基因工程技术将甜菜碱醛脱氢酶基因(BADH)转化栽培大豆黑农-35培育出的转基因大豆品种。其余品种及代号分别为亲本非转基因大豆黑农35(HN-35)、合丰50(HF-50)、抗线王(K)、野生21(Y-21)。
1.3 试验设计及样品采集
试验处理为随机区组设计,每垄长3 m,宽0.7 m,植株间距6 cm,垄间距68 cm,6垄为一个小区,小区面积为30 m2。2010年5月至10月于大豆苗期、花期、结荚期、鼓粒期和成熟期取样。每个小区用五点法随机取10棵植株,采用抖落法收集根际土壤,将根际土壤用无菌塑封袋封好带回实验室分析。
1.4 相关指标的测定方法
pH采用酸度计进行测定(土水比为1∶5)[7]。土壤阳离子交换量采用乙酸钠法。交换性钠的测定采用NH4OAc-NH4OH火焰光度法[7]。碱化度为交换性钠与阳离子交换量的比值[7]。钠吸附比以土壤中Na+含量与(1/2Mg+1/2Ca)1/2的含量的比值来表示[8]。总碱度采用双指示剂—中和滴定法[7]。土壤速效氮采用碱解扩散法[7]。土壤速磷的测定采用NaHCO3法[7]。
1.5 数据分析
采用Excel(2003)对试验数据进行整理,采用SPSS 13.0对试验数据结果进行方差分析。
2 结果与分析
2.1 SRTS对根际土壤pH的影响
SRTS与不同基因型大豆对根际土壤pH的影响如图1所示,根际土壤pH随大豆生育期的变化呈现降低趋势。苗期pH在大豆整个生育期最高,不同品种大豆根际土壤pH主要在8.31~8.41之间,成熟期较低,分布在7.20~7.90之间。
不同品种大豆pH在苗期和花期未存在显著差异(P<0.05)。结荚期SRTS根际土壤pH显著低于HN-35,与其余品种大豆未达到显著水平(P<0.05)。鼓粒期SRTS根际土壤pH显著低于HN-35、K。以上表明SRTS能够降低盐碱土壤pH,这可能是其较耐盐碱的机理,而成熟期SRTS显著的高于HN-35,可能与成熟期根系分泌物减少有关,进而使SRTS耐盐碱程度降低所致,具体原因有待于进一步研究。
2.2 SRTS对根际土壤阳离子交换量的影响
土壤缓冲性能的主要来源是土壤阳离子交换量,它不仅是改良土壤和合理施肥的重要依据,同时也是反映土壤负电荷总量及表征土壤性质的重要指标[9]。
SRTS与不同基因型大豆对根际土壤阳离子交换量的影响如图2所示,SRTS与HN-35根际土壤阳离子交换量在鼓粒期达到最大值,在结荚期、鼓粒期、成熟期均存在显著差异(P<0.05)。其中结荚期SRTS根际土壤阳离子交换量显著高于HN-35、Y-21及其余栽培品种,而后两个时期则显著低于HN-35、Y-21及其余栽培品种,说明在大豆不同生育时期SRTS对根际土壤阳离子交换量的影响不同,表明SRTS对土壤阳离子交换量的影响存在时期性。
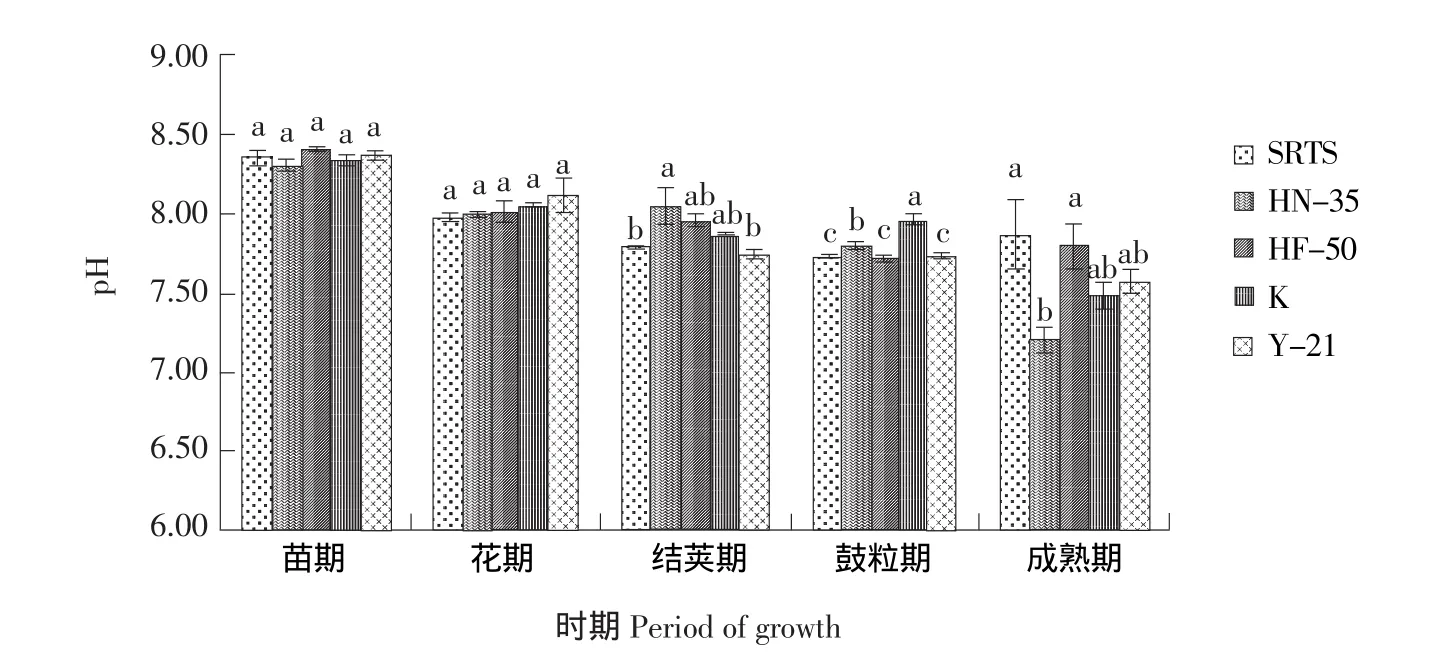
图1 SRTS与不同基因型大豆对根际土壤pH值的影响Fig.1 Effects of SRTS and different soybeans on pH in rhizospheric soil

图2 SRTS与不同基因型大豆对根际土壤阳离子交换量的影响Fig.2 Effects of SRTS and different soybeans on cation exchange capacity in rhizospheric soil
2.3 SRTS对根际土壤交换性钠的影响
SRTS与不同基因型大豆对根际土壤交换性钠的影响如图3所示,不同品种大豆在苗期、结荚期和成熟期分别表现出显著差异,但SRTS与其受体非转基因大豆HN-35在整个生育期对土壤交换性钠没有显著差异(P<0.05),表明SRTS对土壤交换性钠的影响未达到显著水平,对根际土壤交换性钠的影响较小。
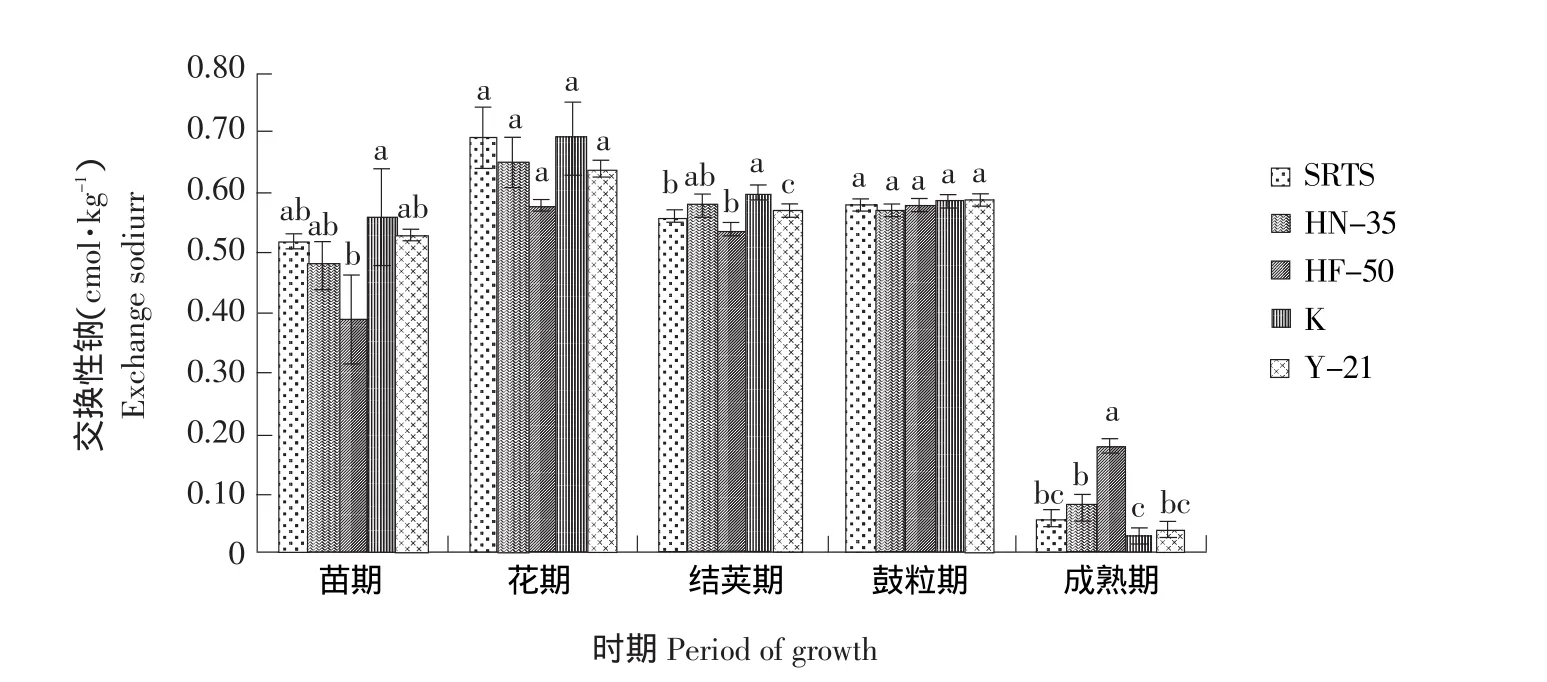
图3 SRTS与不同基因型大豆对根际土壤交换性钠的影响Fig.3 Effects of SRTS and different soybeans on exchangeable sodium in rhizospheric soil
2.4 SRTS对根际土壤碱化度的影响
SRTS与不同基因型大豆对根际土壤碱化度的影响见图4,苗期与花期各品种大豆之间根际土壤碱化度无显著差异(P<0.05),结荚期K大豆土壤碱化度分别较SRTS、HF-50提高7.05%、8.37%,SRTS及其余栽培品种之间无显著差异。鼓粒期HN-35和K之间土壤碱化度差异显著(P<0.05),成熟期K则显著低于SRTS、HN-35和HF-50土壤碱化度。整个生育期SRTS根际土壤碱化度与其亲本非转基因大豆HN-35未达到显著水平,表明SRTS对土壤碱化度的影响很小。
2.5 SRTS对根际土壤钠吸附比的影响
SRTS与不同基因型大豆对根际土壤钠吸附比的影响见图5,根际土壤钠吸附比随大豆生育期呈现波动性变化,花期品种间无显著差异,其余时期各品种之间差异显著(P<0.05)。苗期HF-50钠吸附比显著低于SRTS、K和Y-21,结荚期K显著高于SRTS、HN-35及其余栽培品种,鼓粒期Y-21显著高于SRTS和HN-35,成熟期钠吸附比:HF-50>HN-35>SRTS>Y-21>K。整个生育期,SRTS与其亲本非转基因大豆HN-35未存在显著差异(P>0.05),说明SRTS对根际土壤钠吸附比的影响很小。
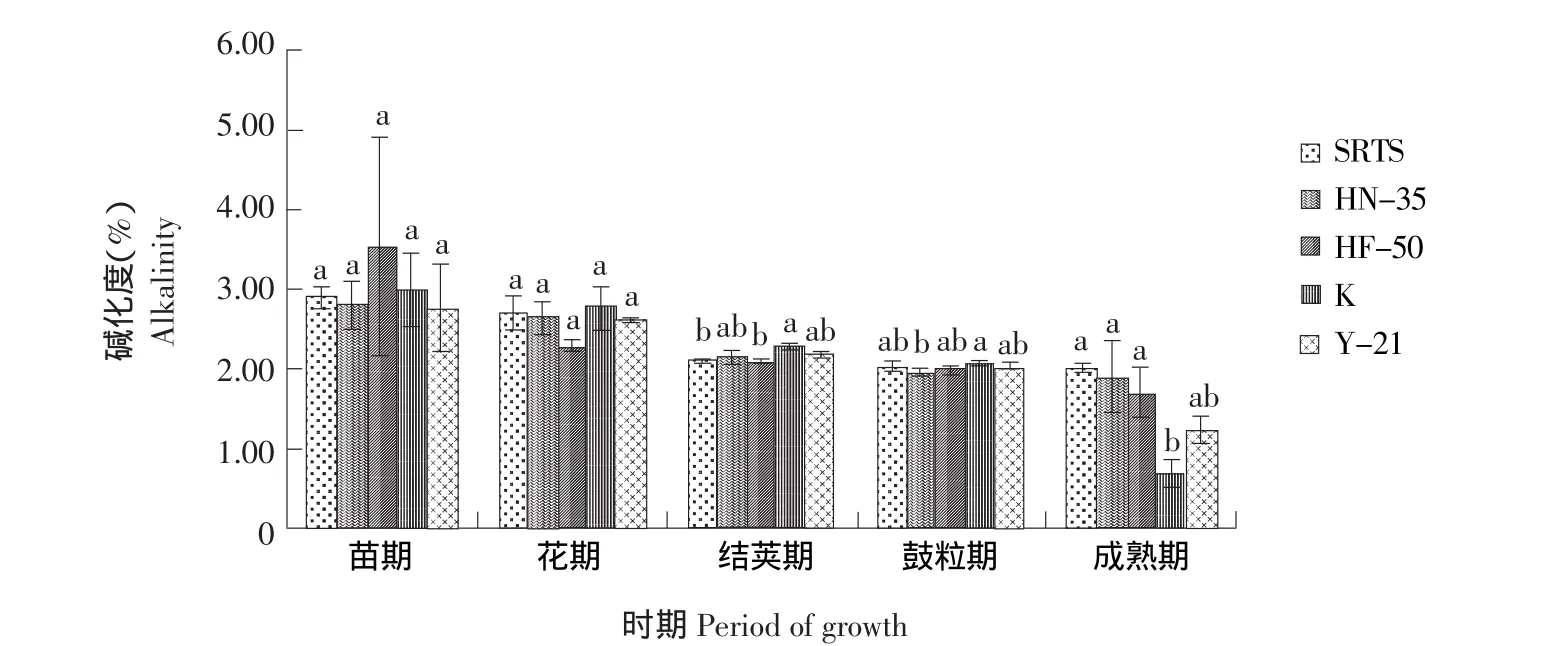
图4 SRTS与不同基因型大豆对根际土壤碱化度的影响Fig.4 Effects of SRTS and different soybeans on alkalinity in rhizospheric soil
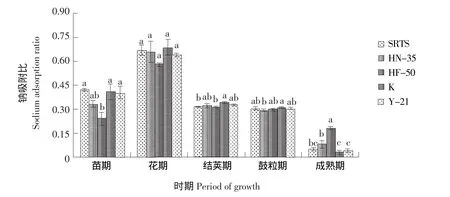
图5 SRTS与不同基因型大豆对根际土壤钠吸附比的影响Fig.5 Effects of SRTS and different soybeans on sodium adsorption ratio in rhizospheric soil
2.6 SRTS对根际土壤总碱度的影响
土壤总碱度是土壤溶液中不同来源的OH-离子的浓度总和超过H+浓度时所表现出来的碱度,总碱度可以作为改良碱化土壤的一项参数。如图6所示,苗期总碱度:SRTS>HN-35>K>HF-50>Y-21,SRTS根际土壤总碱度显著(P<0.05)高于HN-35、Y-21及其余栽培品种。花期SRTS显著高于HF-50,与HN-35、Y-21和K无显著差异。结荚期SRTS根际土壤总碱度显著低于HN-35、Y-21和K,鼓粒期SRTS根际土壤总碱度比HN-35提高了7.09%,成熟期SRTS对土壤总碱度影响与HN-35无显著差异。上述结果表明SRTS对根际土壤总碱度的影响存在时期性。
2.7 SRTS对根际土壤养分的影响
整个生育期土壤速效氮:SRTS>HF-50>K>HN-35>Y-21。SRTS与不同基因型大豆对根际土壤速效氮的影响如图7(A)所示,苗期SRTS根际土壤速效氮显著高于K和Y-21,与HN-35无显著差异(P<0.05)。花期和成熟期各品种大豆之间根际土壤速效氮无显著差异,结荚期Y-21土壤速效氮显著高于HN-35,但SRTS与HN-35之间无显著差异,鼓粒期SRTS土壤速效氮显著高于HN-35和Y-21,分别提高了11.48%和9.69%。说明鼓粒期SRTS有提高根际土壤速效氮的潜力。

图6 SRTS与不同基因型大豆对根际土壤总碱度的影响Fig.6 Effects of SRTS and different soybeans on total alkalinity in rhizospheric soil

图7 SRTS与不同基因型大豆对根际土壤速效氮(A)和速效磷(B)的影响Fig.7 Effects of SRTS and different soybeans on available N(A)and available P(B)in rhizospheric soil
整个生育期土壤速效磷:Y-21>K>HN-35>HF-50>SRTS,土壤速效磷在整个生育期呈现出波动性变化。SRTS与不同基因型大豆对根际土壤速效磷的影响如图7(B)所示,苗期SRTS根际土壤速磷显著低于HN-35和Y-21,但显著高于HF-50,说明大豆生育期前SRTS对土壤速磷有一定的抑制作用。花期SRTS显著高于HN-35、Y-21及其余品种大豆,结荚期SRTS显著高于HN-35,但低于Y-21及其余栽培品种大豆,说明SRTS在大豆生长旺盛时期对土壤速效磷有一定的促进作用。鼓粒期SRTS显著低于HN-35、HF-50及Y-21大豆,成熟期SRTS土壤速效磷显著低于Y-21,但与其余品种大豆无显著差异,表明SRTS对根际土壤速效磷存在影响,但其影响具有时期性。
3 讨论与结论
近年来,因产量高、抗逆性强,全球转基因大豆的种植面积逐年增加[10]。抗盐碱转基因大豆因其能在盐碱地正常生长,可提高盐碱地的利用价值应运而生。本研究种植抗盐碱转基因大豆(SRTS)在不同生育时期对盐碱土根际土壤化学特性的影响,结果表明,SRTS的种植能够降低盐碱土壤pH值,由于SRTS根系分泌物发生变化和转基因大豆影响根际土壤微生物数量所致。有研究指出植物种属、根系分泌物和微生物数量等环境因素都有可能影响根际土壤pH[11]。SRTS对阳离子交换量和总碱度在大豆不同生育期的影响不同,这可能是由于不同生育时期植物根系分泌物的组成成分不同造成的。由于插入外源基因片段,转基因作物本身特性与亲本有较大不同[12],会造成根系分泌物组分发生变化等,从而影响土壤某些化学特性。有研究表明,转Bt基因玉米、大米和马铃薯能够在植物的整个生育期将外源基因随根系分泌物分泌到土壤中,且转基因玉米化学组成成分不同于其非转基因玉米[13]。SRTS对交换性钠、碱化度和钠吸附比的影响较小,说明短期内种植SRTS对交换性钠、碱化度和钠吸附比的影响不明显。SRTS除在鼓粒期显著高于亲本非转基因大豆HN-35,其余生育期对速效氮均无显著影响,而对速效磷的影响随生育期不同而存在差异,大豆生长旺盛期SRTS对土壤速效磷有显著促进作用,这与孙彩霞等的研究[14]稍有不同,其研究表明,转Bt基因棉花种植一个生长季后对土壤中碱解氮、速效磷等含量无显著影响。
抗盐碱转基因大豆由于外源基因的插入,可能直接通过根系分泌物的变化,如组成成分和分泌量的不同,或通过外源基因转移等因素影响盐碱土壤的某些化学特性,而且由于本身的特性发生变化,其对土壤中某些营养元素的吸收利用可能发生变化,从而影响盐碱土根际土壤的某些化学特性。本文仅对部分化学特性进行初步评价,其它评价指标以及具体的影响机制尚待于进一步研究。
[1]冯玉杰,张巍,陈桥,等.松嫩平原盐碱化草原土壤理化特性及微生物结构分析[J].土壤,2007,39(2):301-305.
[2]王振,赵廷昌,刘学敏,等.转基因作物对土壤微生物多样性影响[J].植物保护,2007,33(4):15-20.
[3]Palm C J,Seidler R J,Schaller D L,et al.Persistence in soil of transgenic plant produced Bacillus thuringlensis var.kurstaki δ-endotoxin[J].Canadian Journal of Microbiology,1996,42:1258-1262.
[4]James R R.Utilizing a social ethic toward the environment in assessing genetically engineered insect-resistance in trees[J].Agriculture and Human Values,1997,14:237-249.
[5]王忠华,叶庆富,舒庆尧,等.转基因植物根系分泌物对土壤微生态的影响[J].应用生态学报,2002,13(3):373-375.
[6]Marscher H,Romheld V,Cakmak I.Root-induced changes of nutrient availability in the rhizosphere[J].Journal of Plant Nutrition and Soil Science,1987,10:1175-1184.
[7]鲍士旦.土壤农化分析[M].3版.北京:中国农业出版社,2005.
[8]Chi C M,Zhao C W,Sun X J,et al.Estimating exchangeable sodium percentage from sodium adsorption ratio of salt-affected soil in the songnen plain of northeast China[J].Pedosphere,2011,21(2):271-276.
[9]张彦雄,李丹,张佐玉,等.两种土壤阳离子交换量测定方法的比较[J].贵州林业科技,2010,38(2):45-49.
[10]Clive James.2009年全球生物技术/转基因作物商业化发展态势[J].中国生物工程杂志,2010,30(2):1-22.
[11]陈有,黄艺,陶澍.玉米和大豆根际土壤性质的动态变化[J].植物生态学报,2002,26(3):283-287.
[12]冷春龙.转基因抗虫棉对土壤肥力质量的影响[D].南京:南京林业大学,2007:7-9.
[13]Isik Icoz,Guenther Stotzky.Fate and effects of insect-resistant Bt crops in soil ecosystems[J].Soil Biology&Biochemistry,2008,40:559-586.
[14]孙彩霞,张玉兰,缪璐,等.转Bt基因作物种植对土壤养分含量的影响[J].应用生态学报,2006,17(5):943-946.
[15]沈晓峰,栾凤侠,陶波.抗草甘膦转基因大豆生物与环境安全性[J].东北农业大学学报,2007,38(3):401-404.
[16]吴迪,王秋玉.转基因植物对根际土壤生态系统的影响[J].中国生物工程杂志,2007,27(2):113-118.
