通脑活络针刺法对大鼠急性脑梗死细胞凋亡及梗死容积的影响
2012-09-20张臻年李继英王敬卿范刚启刘孔江
张臻年, 李继英, 赵 杨, 王敬卿, 范刚启, 黄 迟, 张 晖, 刘孔江
随着缺血半暗带和迟发性神经元死亡学说的问世,人们发现及时抑制神经细胞凋亡是减轻脑缺血再灌注损伤的关键。脑缺血后,若能及时采取脑保护措施,则能抑制死亡基因的作用,加强存活基因的功能,因此寻找抑制神经细胞凋亡的干预措施将为脑缺血的治疗开拓思路[1]。然而目前的抗凋亡药物多为多肽大分子,难以通过血脑屏障,又有较大副作用,而传统的针刺方法具有双向调节作用,安全性较高。南京市中医院脑病科曾于2003年采用通脑活络针刺疗法对急性脑梗死做过临床和实验研究,取得较好疗效[2],2006年1月~2009年10月,我们联合江苏省10家三甲级医院采用该法治疗脑梗死亦取得较好疗效[3,4],本实验试图从分子机制探讨该法治疗急性脑梗死的神经保护作用机制。
1 材料和方法
1.1 实验动物分组 12月龄SD大鼠,雄性,体重280~300g,SPF级,由上海斯莱克实验动物有限责任公司提供,许可证号SCXK(沪)2007-0005。使用南京中医药大学实验动物中心SPF级实验室,实验动物使用许可证SYXK(苏)2007-0030。
将264只造模成功后雄性SD大鼠随机分为11组,分别为(1):发病时间≤1.5h组共72例,其中通脑活络针刺(针刺)组24例、溶栓组24例、体针治疗(体针)组24例;(2)发病时间1.5~2h组共72例,其中通脑活络针刺组(针刺)24例、溶栓组24例、体针治疗组(体针)24例;(3)发病时间2~3h组共72例,其中通脑活络针刺组(针刺)24例、溶栓组24例、体针治疗组(体针)24例。并设缺血对照组和假手术组各24例。每组分别于24h、72h各随机处死一批,每批为12只,随机分为两组,一组予TTC染色测梗死容积百分比;另一组予HE染色在光镜下观察组织病理形态学变化,用TUNEL法原位标记DNA片段检测凋亡细胞计数。
1.2 处理方法 通脑活络针刺法即头针+体针:头针:百会、双侧风池、人中、太阳、后顶、病灶侧运动区;体针:屈池、合谷、足三里、三阴交。取穴参照中国针灸学会实验研究会1992年制定的《实验动物穴位定位标准》,每日一次,每次留针30min,每针捻转100转/分,捻2次(进针后、出针前),各1min;溶栓:大脑中动脉梗死后在规定时间内按10000U/Kg尿激酶在20min内从尾静脉缓慢注射。
1.3 试剂和药品 四氮唑红(TTC)由上海化学试剂总厂生产,批号20060927;0.8%戊巴比妥钠由上海西唐生物科技公司生产,批号20070302;尿激酶由天津生物化学制药厂生产,规格为10000U/支,批号20070505;TUNEL细胞凋亡试剂盒由美国罗氏公司提供。
1.4 实验方法
1.4.1 栓子制备 参考 Bednar[5]和 Sereghy[6]的方法制备栓子。在环境温度为22℃ ~27℃下,另选健康大鼠用0.8%戊巴比妥钠(40mg/kg)麻醉,分离出股动脉、股静脉。向股动脉刺入长10cm,外径0.7mm的PE管(polyethylene tubing)套取动脉血。所取血样在22℃ ~27℃下放置2h后,再放入4℃冷藏室22h,然后将血样推入盛有生理盐水消毒弯盘中,吸入长20cm外径0.7mm的PE管连续反复在管中推、吸5min(约200次)后,将栓子再推入弯盘中,截成1μl栓子,最后吸入充满生理盐水的外径0.35mm的PE管中,待用。
1.4.2 脑缺血动物模型建立的手术操作 在环境温度为22℃ ~27℃下,用0.8%戊巴比妥钠(40mg/kg)腹腔注射麻醉。取颈正中切口切开皮肤及皮下组织,分离右侧颈总动脉,充分暴露颈动脉三角、颈总动脉(CCA)、颈内动脉(ICA)、颈外动脉(ECA)及其分支,将动脉与周围的神经、筋膜细心游离开。烧灼断颈外动脉各分支包括:甲状腺上动脉、咽升动脉、枕动脉,游离ICA并牵拉开二腹肌肌腹,暴露翼腭动脉,在翼腭动脉起始处以丝线结扎。以动脉夹关闭 CCA近端、ICA远端;以丝线结扎ECA远端,断开ECA;将ECA残段拉向ICA一致的方向,使ICA、ECA呈直线,向颈外动脉残段内送入已经含有栓子和生理盐水混悬液的外径0.35mm的PE管,将其小心一直送入ICA内;继而开放ICA并向ICA内推入栓子和生理盐水混悬液2~5μl,确定栓子已顺利推入后,随即一边退PE管一边再用动脉夹关闭ICA,然后拔除PE管、结扎ECA残段根部。最后依次开放CCA、ICA的动脉夹;记录栓塞时间。生理盐水冲洗局部后全层连续缝合切口。假手术组不推入栓子,而仅推入5μl生理盐水。
1.4.3 根据典型表现判断模型是否成功 典型神经症状表现为精神萎靡,同侧霍纳氏症,对侧前肢下垂,内收内旋,并自发性向患侧转圈。术后观察症状,1~2h内有典型神经症状出现则为造模成功;2h内无典型神经症状出现则造模失败,将此例动物剔除。除假手术组外,所有入组大鼠均用造模成功大鼠完成。
1.5 神经功能缺损检测评分 按 Longa[7,8]等的方法,在栓塞后不同时间,对动物进行5分制神经行为学评分。标准如下:(1)无神经功能损伤,计0分;(2)不能完全伸展左前肢,提鼠尾离开地面约30cm时,左前肢表现为腕屈曲、肘屈曲、肩内旋或兼而有之者,计1分;(3)自发向左侧转圈,计2分;(4)将动物置于光滑平面上,行走时向左侧倾倒,或轻推肩部时即向左侧倾倒,计3分;(5)不能自发行走,或意识丧失,计4分,分数越高,动物的行为障碍越严重。
1.6 TUNEL法测凋亡细胞计数 TUNEL细胞凋亡试剂盒由美国罗氏公司提供。试剂1:酶浓缩溶液(EnzymeSolution);试剂2:标记溶液(Lable Solution);试剂 3:转化剂-POD(Converter-POD)、酶标记抗荧光素抗体(即用型)。用光学显微镜(×400)观察每个视野中阳性细胞数目(细胞核呈深蓝色者为阳性细胞),每组随机计数5个视野,取其均值作为本组的代表值。
1.7 脑组织梗死容积百分比测定 参考Swanson 等[9,10]方法全部存活动物均在栓塞后规定时间断头取脑;去除嗅部、小脑、低位脑干,取脑组织时注意观察有无蛛网膜下腔出血,脑组织取出后即置于-22℃低温冰箱快速冷冻后,由前向后每隔2mm切取组织片共6片,置2%氯化-2,3-5三苯基四氮唑(triphenyltetrazolium chloride,TTC)溶液中 37℃孵育20~25min,待完全显色后置福尔马林液固定。染色后正常组织为红色,脑梗死组织为白色,福尔马林液固定后6h将脑片平面置于刻度纸上,用相机照相后输入计算机,采用Photoshop及Autocad软件计算每片梗死面积;然后按公式V=Sd/T(S为每一脑片梗死灶面积,d为脑片厚度,T为线形放大倍数)计算每一脑梗死容积,对其不显色部分经图像分析系统处理后计算其梗死容积(mm3),并求出同侧半球的容积,求出二者容积之比即为梗死容积百分比。
1.8 组织病理学检查 各组大鼠于术后24h、72h断头取脑,取视交叉至视交叉前3mm的切片,以10%甲醛固定,石蜡包埋,4μm切片,HE染色,光镜下观察组织病理形态学变化。
1.9 统计学分析 所有实验数据经反复核查后用SPSS13.0统计软件处理,定量资料用均数±标准差(±s)表示,多组间的比较用单因素方差分析;各处理组间的两两比较用LSD检验,P<0.05认为有统计学意义。
2 结果
2.1 脑梗死后动物存活情况 除假手术组在规定时间内无死亡外,其余各组均有大鼠在规定时间内死亡。针刺组共死亡5例,其中6h死亡2例、24h死亡2例、72h死亡1例;溶栓组共死亡13例,其中6h死亡8例、24h死亡4例、72h死亡1例;体针组共死亡8例,其中6h死亡3例、24h死亡3例、72h死亡2例;缺血对照组共死亡9例,其中6h死亡4例、24h死亡3例、72h死亡2例。
2.2 各组TUNEL凋亡细胞计数表达情况(见表1) 发病≤1.5h时间窗内:针刺组、溶栓组差异无统计学意义(P=0.814>0.05),两者均优于体针组(P <0.01)及缺血对照组(P <0.01)。发病 1.5~2h时间窗内:针刺组、溶栓组差异亦无统计学意义(P=0.291>0.05),两者均优于体针组(P <0.01)及缺血对照组(P<0.01)。发病2~3h时间窗内:针刺组仍显著优于溶栓组、体针组及缺血对照组(P<0.01),但溶栓组、体针组及缺血对照组各组间比较差异均无统计学意义(P>0.05)。24h时点、72h时点,≤1.5h针刺组、1.5~2h针刺组、2~3h针刺组及缺血对照组各组凋亡细胞计数比较差异均有统计学意义(P <0.01)。
2.3 TTC染色后各组梗死容积百分比比较(见表2) 发病≤1.5h时间窗内:针刺组、溶栓组差异无统计学意义(P=0.494>0.05),两者均优于体针组和缺血对照组(P<0.01),体针组优于缺血对照组(P <0.01)。发病1.5 ~2h时间窗内:针刺组、溶栓组差异无统计学意义(P=0.553>0.05),两者均优于体针组和缺血对照组(P<0.01),体针组优于缺血对照组(P=0.011<0.05)。发病2~3h时间窗内:针刺组优于溶栓组、体针组及缺血对照组(P<0.01),但溶栓组、体针组及缺血对照组各组间比较差异均无统计学意义(P>0.05)。24h时点、72h时点,≤1.5h针刺组、1.5~2h针刺组、2~3h针刺组及缺血对照组各组梗死容积百分比比较差异均有统计学意义(P <0.01)。
2.4 组织病理学变化 A组(≤1.5h针刺组)可见神经纤维排列略紊乱,少量核固缩(见图1);B组(≤1.5h溶栓组)可见神经细胞肿胀、少量核固缩、间质水肿、灶性出血(见图2);C组(≤1.5h体针组)坏死较A组明显,神经细胞显著减少,核固缩(见图3);D组(1.5~2h针刺组)可见小灶性坏死,神经胶质增生,排列紊乱(见图4);E组(1.5~2h溶栓组)可见局部坏死伴少量出血及炎细胞浸润,神经纤维疏松,神经胶质增生,排列紊乱(见图5);F组(1.5~2h体针组)可见坏死较C组明显,神经细胞显著减少,核固缩(见图6);G组(2~3h针刺组)可见坏死较A、D组明显并伴中等炎细胞浸润(见图7);H组(2~3h溶栓组)神经细胞肿胀,灶性坏死,伴炎细胞浸润,少量核固缩,间质水肿,灶性出血(见图8);I组(2~3h体针组)坏死较C、F组明显并伴中等炎细胞浸润(见图9);J组(缺血对照组)见到明显梗死灶位于大脑皮质及基底节区,大片坏死组织中见神经元和胶质细胞肿胀或消失,核固缩或核膜破裂,结构消失,均质化改变,梗死灶周围半暗带区见大量炎细胞浸润、核固缩浓染的细胞,血管内皮肿胀(见图10);K组(假手术组)无梗死灶,神经元及神经纤维结构形态正常,间质致密无水肿。均在HE染色后用光学显微镜(×400)进行观察。
表1 各组TUNEL凋亡细胞计数表达观察(±s)(个/400倍)

表1 各组TUNEL凋亡细胞计数表达观察(±s)(个/400倍)
与同时点体针组比较*P<0.01;与缺血对照组比较△P<0.01;针刺组与1.5~2h亚组比较☆P <0.01;与2 ~3h亚组比较▲P <0.01;针刺与溶栓组比较★P <0.05
组别 例数24h 72h发病≤1.5h针刺溶栓体针发病1.5~2h针刺溶栓体针发病2~3h针刺溶栓体针缺血12 12 12 12 12 12 12 12 12 12 22.38 ±2.30 21.91 ±3.44 45.57 ±2.57 35.67 ±3.34 36.08 ±4.54 49.89 ±2.38 47.33 ±1.58 55.40 ±2.14 55.91 ±2.63 56.20 ±2.97 32.31 ±4.72*△☆▲31.76 ±4.26*△50.50 ±2.33△45.28 ±3.54*△▲47.31 ±2.40*△54.96 ±2.68△53.35 ±3.36*△★68.08 ±3.77 67.37 ±4.48 67.97 ±4.09
表2 TTC染色后各组梗死容积百分比比较(±s)(%)
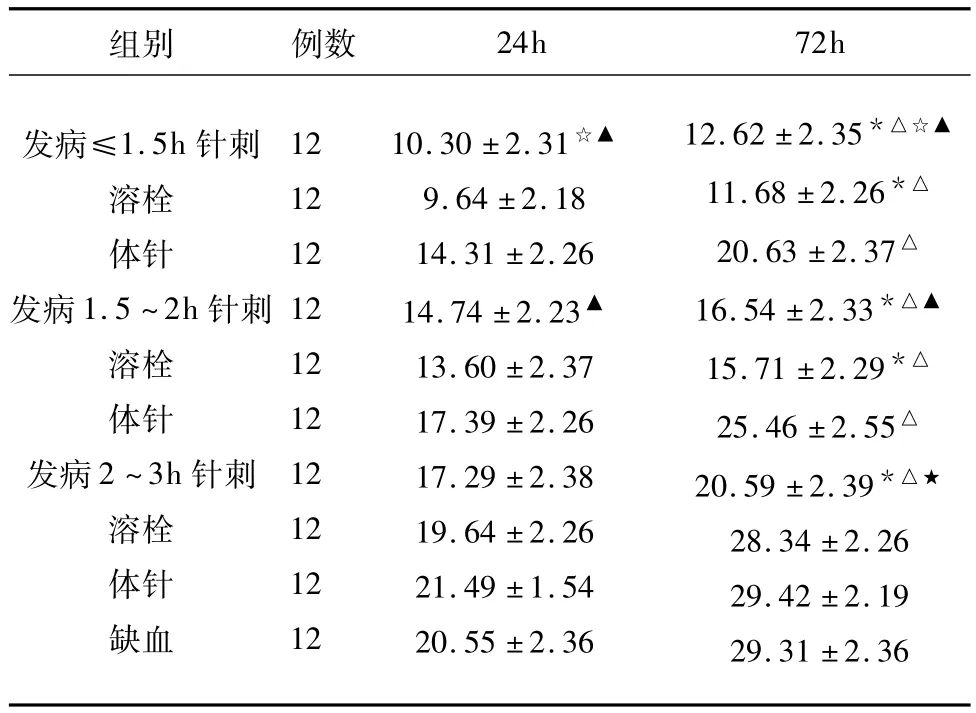
表2 TTC染色后各组梗死容积百分比比较(±s)(%)
与同时点体针组比较*P<0.01;与缺血对照组比较△P<0.01;针刺组与1.5~2h亚组比较☆P <0.01;与2 ~3h亚组比较▲P <0.01;针刺与溶栓组比较★P <0.05
组别 例数24h 72h发病≤1.5h针刺溶栓体针发病1.5~2h针刺溶栓体针发病2~3h针刺溶栓体针缺血12 12 12 12 12 12 12 12 12 12 10.30 ±2.31☆▲9.64 ±2.18 14.31 ±2.26 14.74 ±2.23▲13.60 ±2.37 17.39 ±2.26 17.29 ±2.38 19.64 ±2.26 21.49 ±1.54 20.55 ±2.36 12.62 ±2.35*△☆▲11.68 ±2.26*△20.63 ±2.37△16.54 ±2.33*△▲15.71 ±2.29*△25.46 ±2.55△20.59 ±2.39*△★28.34 ±2.26 29.42 ±2.19 29.31 ±2.36
3 讨论
本研究利用SD大鼠制作的大脑中动脉血栓栓塞性脑梗死动物模型对通脑活络针刺法治疗急性脑梗死的机制进行了研究,证实了通脑活络针刺法对急性脑梗死大鼠具有治疗和脑保护作用。
通脑活络针刺法中双侧太阳穴是额、颞、蝶骨汇集的翼点,此处是人体颅骨骨质最薄处。后顶穴是婴儿期后囟骨化前的位置。从风池穴进针,针尖对准对侧下眼眶,正是瞄准了调节大脑前后循环的Willis’环[11]。百会位居高端,有统领百脉、平冲降逆的作用。通脑活络针刺法的诸多穴位在颅顶形成一个立体网络,我们在这些主穴上施加较强针感,通过循经传感作用,可能缓解梗死始动期血流动力学的紊乱,恢复半暗带的血供,降低凋亡细胞计数及大鼠急性脑梗死时的梗死容积,逆转脑梗死进程。
脑缺血后神经元死亡是一个极其复杂的病理过程。研究结果表明缺血后神经元死亡主要表现为坏死和凋亡两种形式,分别涉及主动和被动细胞死亡机制。在脑缺血急性期,神经元坏死与凋亡并存,细胞坏死位于缺血中心区,细胞凋亡主要出现在缺血半暗带;而在脑缺血的迟发性神经元死亡期,则以细胞凋亡为主,凋亡可能决定了最终梗死体积。TTC与完整的线粒体氧化酶系反应,诱发产生深红色、光酶脂溶性的Formazan而使正常组织染色,缺血组织的线粒体损伤,不能诱导染色反应而呈白色,容易鉴别[12]。本实验采用目前已被国内外学者普遍采用的TTC作为梗死区域的检测标记[13,14],观察的脑梗死灶呈苍白色与MCA支配的脑区域一致,未缺血部分呈红色,证实模型制作成功。本实验所观察到针刺治疗可明显缓解和减轻脑梗死的病理过程。脑缺血区组织病理学变化如同以往作者的报道,大脑中动脉供血区的大脑皮质和尾壳核的外侧区明显增厚,脑室扩大,神经元肿胀和坏死。此类变化持续到脑缺血3d,此时出现大量神经元死亡,Garcia等[15]对此渐进性的病理变化作了详尽的观察,并认为这是由脑缺血发展成脑梗死的病理过程。
从上述实验结果可以得出以下结论:(1)在有效时间窗内(小于2h),针刺组与溶栓组在降低梗死容积百分比、降低凋亡细胞计数方面,差异无统计学意义(P>0.05);(2)在2~3h时间段以内,通脑活络针刺组对上述指标的改善优于缺血对照组(P<0.05),而溶栓组和缺血对照组比较差异无统计学意义(P>0.05),说明通脑活络针刺法较溶栓治疗延长了治疗时间窗,同时提示通脑活络针刺疗法的疗效和时间窗相关;(3)溶栓治疗超过2h则无明显效果,且明显增加出血率,今后可进一步扩大样本量对大鼠溶栓时间窗进行研究;(4)本实验中对梗死容积百分比、凋亡细胞计数的观察时点只设在24h、72h,若另设48h、7d为观察时点,则更有利于观察上述指标的动态变化,将更为详尽的阐释急性脑梗死的病理生理变化;(5)今后研究的重点可进一步扩大针刺干预的时间至4h、5h、6h等,以进一步为通脑活络针刺法治疗急性脑梗死的时间窗问题上提供更为详实的实验依据;(6)通脑活络针刺法可能通过在一定范围内下调凋亡细胞的表达,保护缺血再灌注损伤中的脑组织,从而达到脑缺血后神经功能修复与重建的作用。
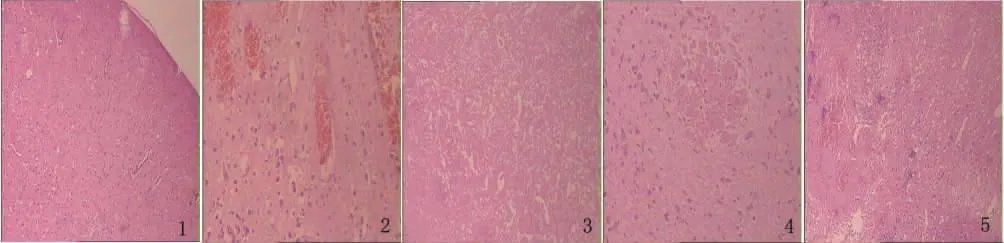
图1 神经纤维排列略紊乱,少量核固缩;图2 神经细胞肿胀,灶性出血;图3 神经细胞减少,核固缩;图4 小灶性坏死,神经胶质增生;图5 局部坏死伴少量出血
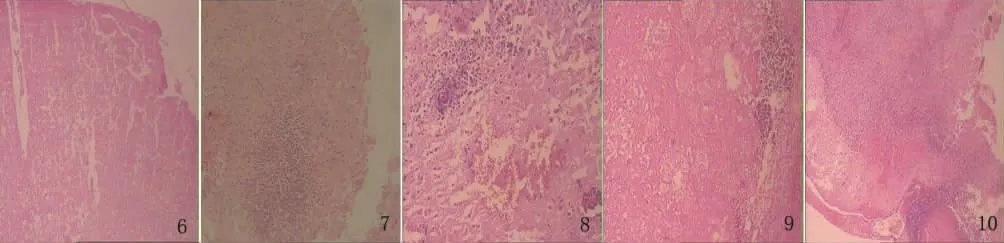
图6 神经细胞显著减少,核固缩;图7 坏死较明显并伴中等炎细胞浸润;图8 灶性坏死、间质水肿伴灶性出血;图9 坏死明显并伴炎细胞浸润;图10 大量炎细胞浸润、核固缩
[1]Zhou NN,Zhu XF,ZhouJM,etal.2-Mcthoxestradiol induces cell cycle arresl and apoptosis of nasopharyngeal carcinom a cells[J].Acta Phamacologica Sinica,2004,25(1):1515-1520.
[2]李继英,彭宇竹,杨 芳,等.通脑活络针刺法治疗超早期,急性期脑梗死临床观察[J].中国中西医结合杂志,2003,23(10):736-739.
[3]李继英,赵 杨,张臻年,等.通脑活络针刺疗法对急性期脑梗死患者BI,NIHSS评分的影响[J].中国中西医结合杂志,2011,31(1):28-31.
[4]李继英,赵 杨,张臻年,等.通脑活络针刺法与常规疗法治疗急性脑梗死的疗效比较[J].临床神经病学杂志,2010,23(6):469-471.
[5]Bednar MM,Mcauliffe T,Raymond SJ,etal.Tissue plasminogen activator reduces brain injury in rabbitmodel of thromboembolic stroke[J].Stroke,1990,21(12):1705-1709.
[6]Sereghy T,Overgaard K,Boysen G,etal.Neuroprotection by excitatory amino acid antagonist augments the benefit of thrombolysis in embolic stroke in rats[J].Stroke,1993,24(11):1702-1707.
[7]Zea Longa E,Weinstein PR,Carlson S,etal.Reversiblemiddle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(6):84-91.
[8]Belayev L,Alonso OF,Busto R,etal.Middle cerebralartery occlusion in the rat by intraluminal suture[J].Stroke,1996,27(6):1616-1623.
[9]Swanson RA,Morton MT,Tsao-Wu GT,etal.A semiautomated method for measuring brain infarct volume[J].J Cereb Blood Flow Metab,1990,10(2):290-293.
[10]Bederson JB,Pitts LH,Germano SM,etal.Evaluation of 2,3,5-triphenyltetrazoliamchloride as a stain for detection and qualification of experimental cerebral infarction in rats[J].Stroke,1986,17(6):1304-1308.
[11]黄如训,梁秀龄,刘焯霖,等.临床神经病学[M].北京:人民卫生出版社,1996.255-256.
[12]Fotmazan K,Puschmann S,Schaper J,etal.The mechanism of the tetrazolium reaction in identifying experimentalmyocardial infarction[J].Virchows Arch,1981,393(7):287-297.
[13]Bedeison JB,Pitts LH,Getmano SM,etal.Evaluation of 2,3,5-triphenyltetrazolium chloride as a stein for detection and quantification of experimental cerebral infarction in rats[J].Stroke,1986,17(6):1304-1308.
[14]Goldlust EJ,Paczynski RP,He YY,etal.Autom ated measurement of infart size with scanned image of triphenylt etrazolium chloridestained rat brains[J].Stroke,1996,27(4):1657-1662.
[15]Garcia JH,Liu KF,Ye ZR,etal.Incomplete infarct and delayed neuronal death after transientmiddle cerebral artery occlusion in rats[J].Stroke,1997,28(1511):2303-2309.
