用于氨氮检测的三维微纳氨气传感芯片及系统研究
2012-09-19卞贺明佟建华孙楫舟韩泾鸿夏善红中国科学院电子学研究所传感技术国家重点实验室北京100190
卞贺明 边 超 佟建华 孙楫舟 张 虹 韩泾鸿 夏善红(中国科学院电子学研究所传感技术国家重点实验室 北京 100190)
②(中国科学院研究生院 北京 100190)
1 引言
氨氮是水体中的常见物质,当水中氨氮浓度较高时,对水生生物和人类健康都会造成危害。氨氮一直是水质分析和监测的重点。氨氮指水体中氨气和铵离子的总和,氨气和铵离子的比例受 pH值和水温控制。目前氨氮检测的常见方法有分光光度法、离子选择电极法、氨气敏电极法。分光光度法是使特定试剂与氨氮发生显色反应,通过吸光度变化来测定氨氮,但易受浊度影响,且所用试剂难免受水中一些物质的影响而失效[1]。离子选择电极法测定氨氮时,需使用多个传感器分别检测铵离子、pH值和水温以确定氨氮的含量,且钠、钾等离子会严重干扰铵离子传感器的检测[2]。电位型氨气敏电极法是使用 pH值电位传感器来识别全部转化为氨气的氨氮对溶液 pH值的改变,进而确定氨氮浓度。但该方法一般需要较长的响应时间,且漂移较严重[3,4]。
安培型气体传感器探测气态被测物时,其电极可不与被测样品直接接触。如果使用这种传感器来实现对氨氮的检测,可像氨气敏电极法一样有效克服离子干扰;同时与电位型氨气敏电极相比,氨到达电极表面即发生电化学反应产生电流,无需太长的平衡时间,因此其响应速度较快。Chou等人[5]报道了利用微电极传感器来检测液体中挥发出的甲醛的研究,但使用安培型氨气微传感器对氨氮进行检测的研究尚未见报道。近年来,有关安培型气体传感器微型化的研究受到了很多关注[5-10],与传统制造工艺相比,微型化的批量制造工艺可以有效降低生产成本。此外,传感器的微型化还可降低化学试剂的使用量,提高检测设备的便携性。然而,目前这些微传感器大都集中于 Clark电极型的结构,Clark电极型的传感器结构简单,便于微型化,但其灵敏度、稳定性等方面的性能逊色于基于气体扩散电极的传感器。基于扩散电极的传感器的特定结构意味着:如果要在芯片上实现其结构和功能,就需要构建电极及引线的多层互联结构。Achmann等人[8]报道了基于气体扩散电极的微传感芯片。但此芯片采用低温共烧陶瓷作为多层立体器件的主体材料,加工温度较高,达 800℃-900℃。常用的聚合物透气膜难以承受如此高的加工温度,而Achmann等采用的陶瓷膜材料又会影响传感器的整体性能。如能使用低温工艺实现基于气体扩散电极的微传感芯片制备,将有效减少制备过程中工艺及材料所受的限制,以便提高微传感芯片的性能。
本研究设计并制备了一种多层结构的安培型氨气微纳传感芯片,该芯片采用微纳加工工艺制备。基于MEMS技术制作芯片,选择纳米铱作为传感器的敏感材料,使用 AgCl浆制备参比电极,利用聚合物键合工艺在较低温度下实现了微传感器多层结构的封装。传感器具有较高的灵敏度,并具有良好的抗干扰性。另外,构建了以此安培型氨气微纳传感芯片为敏感单元的氨氮检测系统,实现了对氨氮的检测。
2 氨氮检测原理
在含有氨氮的水体中,氨气和铵离子共存,其离解反应是可逆的,由式(1)表示[11]。
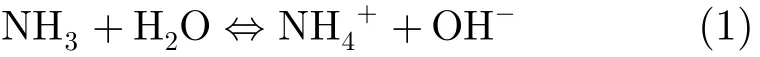
维系这种平衡的关系为
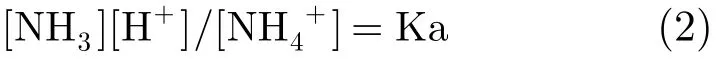
式中Ka为酸离解常数,且在室温为25℃时其值为10-9.25。根据式(2),将氨气和铵离子的浓度关系表述为由溶液pH值约束的形式。
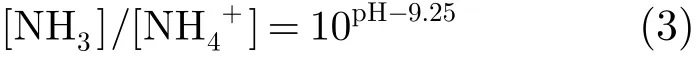
由式(3)可见,当样品溶液pH值>12时,溶液中绝大多数的氨氮将以氨气的形式存在。此时,以一定的流速向溶液中通入空气,氨气就立即会向气相环境中析出。当氨气被输送至氨气微传感器时(微传感芯片的原理图如图1所示),氨气将透过传感器的聚四氟乙烯膜(PTFE),接触到传感器的铱黑工作电极,并在工作电极表面发生式(4)所示的电催化氧化反应,相应地在环状的Ag/AgCl对电极表面发生式(5)所示的还原反应。为维持参考电势的稳定,在芯片上单独制作了Ag/AgCl参比电极。由于电流的变化量与水中氨氮的浓度成正比,所以可利用氨气微传感器来实现对氨氮的检测。
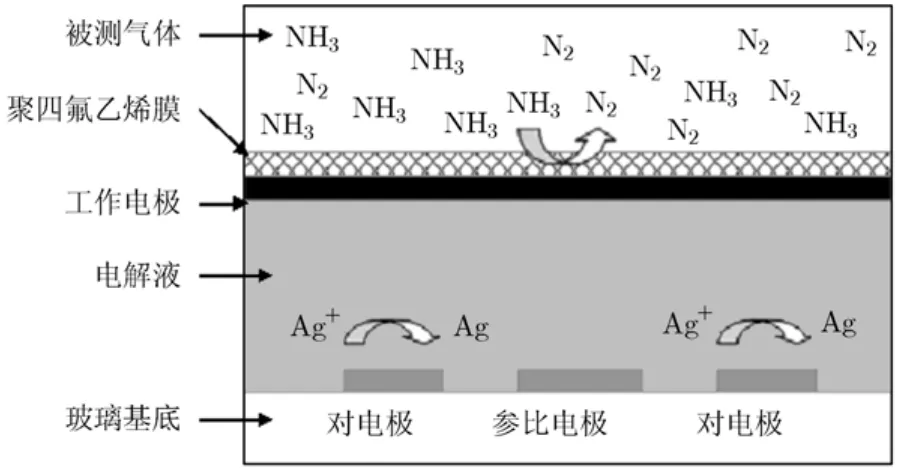
图1 氨气微传感芯片的原理图

3 实验部分
3.1 仪器与试剂
Gamry reference 600电化学分析仪(美国Gamry公司);电子天平(德国Sartorius公司);超纯水机(北京盈安美诚科学仪器有限公司);玻璃瓶、聚四氟乙烯导管等(北京大祥塑料制品有限公司)。
聚四氟薄膜,孔径约为1 μm(北京龙吟国际贸易有限公司);铱黑,粒径约为8~10 nm (上海河森电气有限公司);氯化银浆(徐州英剑纳米科技有限公司);氯化铵、氢氧化钠、甲醇、乙醇、丙酮等(分析纯,国药集团北京化学试剂公司);微型气泵(格兰登福托玛斯气动系统有限公司公司);实验用水为超纯水(实验室自制,>15 MΩ cm)。
3.2 氨气微纳电极传感芯片的设计与制备
氨气微纳电极传感芯片的结构设计如图2所示,其结构由4部分组成:微池结构层A和B,膜电极C及聚碳酸酯上盖D。其中,结构层A和B均为带有SU-8微池的玻璃片。A层的微池内有在铂连接线表面覆盖Ag/AgCl膜的参比电极和对电极;B层设有工作电极的连接线;膜电极C为传感芯片的工作电极,由聚四氟薄膜和铱黑构成;D层为带孔的聚碳酸酯上盖。4部分通过键合工艺可形成仅有电解液进出通道的腔体。向腔体内注入电解液即构成完整的微传感芯片。检测时,氨气透过上盖中间的孔接触到工作电极发生反应,产生电流信号。氨气微纳电极传感芯片的具体制备过程如下:(1)首先用玻璃洗液将玻璃基底材料清洗干净;(2)在玻璃基底上正胶光刻出电极连接线(如图2左侧的A,B两层),溅射30 nm Cr/300 nm Pt的电极材料,使用lift-off工艺形成电极;(3)使用SU-8胶在A,B两层玻璃片上形成所需的微池结构;(4)使用氧等离子体清洁A,B两层玻璃片表面,并在A层的铂连接线表面滴涂 Ag/AgCl浆,形成圆形及环形的Ag/AgCl微电极,80℃烘烤 30 min;(5)制作膜电极C,制备过程类似于文献[12]中的报道。将一定量的铱黑与聚四氟乳液加入1 mL去离子水中,超声混合10 min,然后将混合物沉积在聚四氟薄膜上。自然晾干,在250℃的条件下烘烤1 h;(6)在各结构层边缘刷涂环氧树脂胶薄层,将传感器的微池结构层A,B,膜电极C及聚碳酸酯上盖D按图中顺序排列,然后压紧固定,置于60℃烘箱加热30 min;(7)将器件冷却至室温,焊接电极导线,注入 KCl电解液,用直径2 mm的橡胶塞将电解液的注入及流出口密封。制备完成的微传感器芯片如图3所示。
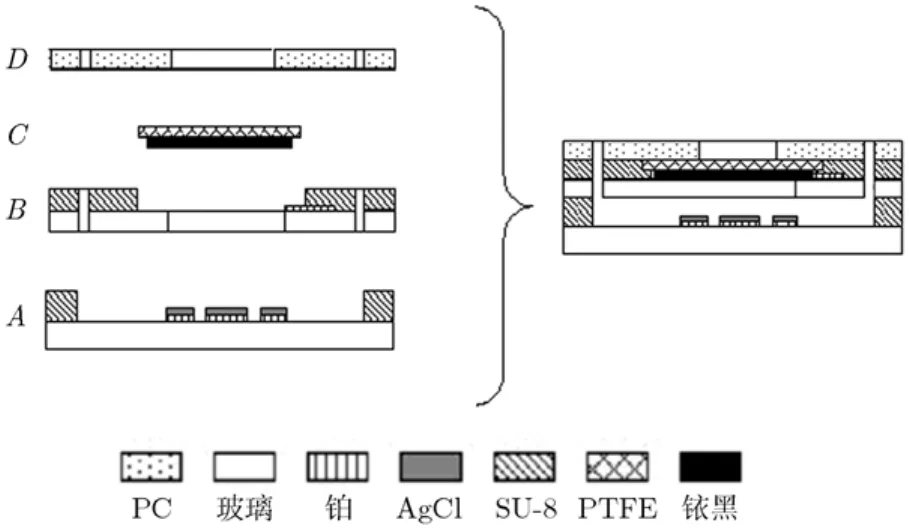
图2 氨气微传感芯片的结构示意图
如上所述,氨气微纳电极传感芯片的三维结构采用多层结构来实现其结构和功能。多层结构器件一般需要利用键合工艺实现封装。然而,传统的键合工艺存在着一些不足,例如键合温度较高、对键合表面的要求高、可实施键合的材料种类有限等。粘性键合工艺可有效降低键合温度、拓展键合工艺的使用范围[13]。本研究中采用一种无溶剂的环氧树脂胶来实现多层器件的键合,在降低键合温度的同时,无溶剂的胶也避免了环氧树脂自身组分对工作电极催化性能的影响。

图3 氨气微传感芯片
3.3 氨氮检测系统设计
图4是依据上述检测原理设计的氨氮测试系统结构示意图。系统主要包括:微型气泵,流量为500 mL/min;反应腔,实现被测溶液与NaOH溶液混合;检测腔,腔体内包含微传感芯片;电化学分析仪,用于采集并记录实验数据;以及装有0.1 mol/L稀H2SO4的烧杯,吸收氨气,防止其污染空气。其中,系统的气体流路各部分使用聚四氟乙烯管连接,各管路接口处均设置开关阀,以便保证系统气路的密封性。检测腔中微传感器的三电极通过导线与电化学分析仪相连。为排除气流对传感器电流信号的影响,系统设计了另一条不含氨氮样品的空白溶液气路,此气路包含一个与反应腔结构、大小均一致的空白溶液腔,用此气路的信号作为传感器背景电流信号。测试时,通过一个三相阀实现两条气路的切换。
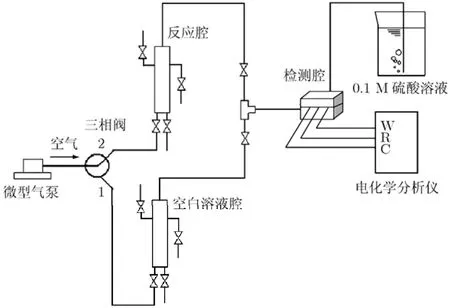
图4 氨氮检测系统结构示意图
使用上述系统测试的实验步骤如下:
(1)使用注射器向空白溶液腔内注入8 mL去离子水和2 mL 0.5M的NaOH溶液;
(2)三相阀转向位置 1,将空气通向空白溶液,待传感器信号稳定进行后续操作;
(3)将8 mL一定浓度的氨氮样品溶液与2 mL 0.5 M的NaOH溶液注入反应腔,静置2 min,待溶液混合均匀,三相阀转向位置 2,空气通向反应腔,将析出的氨输送至检测腔;
(4)电流达稳态后,三相阀转向位置 1,将空气通向空白溶液气路;
(5)将反应腔内溶液排出,注入 8 mL去离子水和2 mL NaOH溶液,三相阀转向位置2,用空气清洗检测腔及气路;
(6)清洗完毕,三相阀转向位置 1,将空气重新通向空白溶液气路;
(7)待传感器信号回到基线,即可重复上述步骤(2)至步骤(7),检测其他样品。
3.4 实验方法
参比电极的电势稳定性对安培型气体传感器输出信号的稳定具有至关重要的作用。因此在传感器进行整体测试之前,先对片上参比电极的性能进行测试,包括微电极表面的形貌测试(SEM)以及电化学稳定性测试,使用电化学分析仪(美国 Gamry reference 600)测量片上参比电极与饱和甘汞电极间的电势差,以此来评估自制参比电极的电势稳定性。
为获得明显的响应信号,且防止电解液发生水解,本研究的测试中对微传感芯片施加+700 mV的偏置电压,并待背景电流稳定后开始测试。所有测试均在室温下进行(25±1℃)。
4 结果与讨论
4.1 工作电极的材料选择及形貌分析
相关研究表明,在铂、铱、金等金属中,铂对氨的电化学催化氧化能力十分突出[14]。但铂的电催化氧化能力过强,以铂为工作电极对许多种无机和有机气体均会产生响应。例如,Lee等人[15]曾报道过使用铂钌为工作电极检测甲醇的电化学微传感器。De Vooys等人[14]的研究表明,铱与铂对氨的电催化氧化能力相近,但铱的选择性优于铂,以其为工作电极材料检测氨,具有较好的抗干扰性。
图5所示为纳米铱制备的工作电极表面形貌的SEM照片。由电极的微观形貌可看出,电极微观结构中粒径约为8~10 nm纳米铱之间存在着尺寸为几十至几百纳米的孔隙,且孔隙很多。孔隙的存在利于氨扩散至电极表面发生反应,产生电流。

图5 工作电极表面形貌的SEM照片
4.2 Ag/AgCl微电极的性能测试结果
4.2.1 Ag/AgCl微电极的形貌及成分分析使用扫描电子显微镜(SEM)对Ag/AgCl微参比电极的表面微观形貌进行了观察(图6)。由图6(a)可以看出Ag/AgCl层尽管银浆颗粒大小不同,但总体上分布比较均匀且致密,在1 M的KCl溶液中浸泡24 h,未见浆料脱落,表明浆料可稳定附着在电极引线表面,从而保证了微参比电极物理结构的稳定性。EDX分析(图6(b))表明电极材料的成分确实含Ag和Cl。
4.2.2 Ag/AgCl微电极的电化学性能为了评估微参比电极的稳定性,在1 mol/L KCl溶液中使用电化学分析仪测试微参比电极与饱和甘汞电极的电势差,测试持续16 h,记录测试曲线如图7所示。由图可见,微参比电极的电势十分稳定,16 h内最大的电势漂移量仅有1.5 mV。因此,芯片所采用的微参比电极可满足为传感器提供稳定参考电势的需要。

图6 Ag/AgCl微电极形貌及成分分析

图7 微参比电极稳定性测试曲线
4.3 氨氮检测的时间响应特性
图8为氨氮检测的时间响应曲线,由图可见,0.5 mg/L,1 mg/L和5 mg/L的氨氮达90%响应的时间分别为6 min,4.5 min和4 min,经统计达90%响应的时间大都在3-6 min之间。此前报道的安培型微传感芯片,使用陶瓷材料作为透气膜,响应时间需要 6-14 min[8]。可见透气性良好的聚四氟乙烯薄膜有效保证了传感器的响应速度。
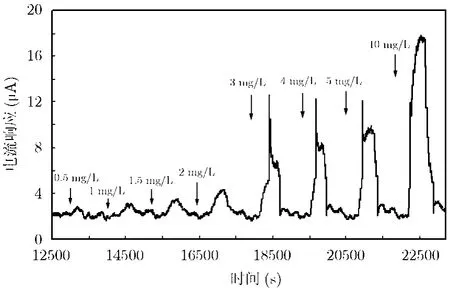
图8 氨氮检测的时间响应曲线
本研究中的传感器恢复时间也较短,表明氨气撤除后,残余在电解液中的氨气迅速被电化学反应消耗掉,从而也证明了纳米铱对氨良好的电催化氧化性质。由图8所示,每次检测后出现的电流起伏是在管路清洗过程中出现的,表明残余在管路中的氨气可引起电流的改变。从而,证明了检测后管路清洗的必要性,可避免残留气体干扰下一次的检测结果。
观察曲线可发现,在较高浓度范围内(3-10 mg/L),响应电流会在短时间内出现突增,然后逐渐达到稳态。分析原因认为,当电极表面的氨气浓度出现突增的情况,传感器的电极体系需要一定的时间来重新构建电化学反应的平衡态。
4.4 氨氮检测的浓度响应特性
根据微传感器对0.5~10 mg/L氨氮被测液的电流响应值,可绘制出氨氮浓度与传感器电流响应之间的关系(图9)。在图9中选取响应电流与基线电流的差值(即净电流值)来指示不同浓度氨氮的电流响应值。在0.5~10 mg/L的浓度范围内传感器的响应与氨氮浓度成良好的线性关系,线性相关系数为0.995,灵敏度为 1.62 μA/(mg/L)。
4.5 重复性和选择性
使用微传感器对2 mg/L的氨氮样品进行了连续6次测试,相对标准偏差为5.73%,体现出较好的重复性。
本研究采用将被测液中氨氮转化成氨气进行检测的方法,避免了被测液中的离子干扰。潜在的干扰来源于被测液中的酸性物质和可挥发的有机物。在样品溶液预处理时,加入强碱溶液,就是为了中和被测液中酸性物质,将有效地避免酸性气体的干扰,因此对传感器选择性考察重点在含有挥发性有机物的溶液。研究中选取了甲醇、乙醇、丙酮3种常见的有机物为测试对象,使用去离子水配制与 2 mg/L氨氮浓度等摩尔浓度 (1 .43 × 1 0-4M)的甲醇、乙醇、丙酮溶液,测量这些干扰物溶液所对应的电流值,测量结果如图10所示。干扰率RF%=ib/ia(ia:氨氮的响应电流值;ib:干扰物的响应电流值)。各干扰物的干扰率分别为丙酮 5.2%、甲醇 4.6%、乙醇6.9%。结果表明,干扰物未产生明显的响应信号,各物质对电流响应不构成显著干扰。从而证明了纳米铱作为工作电极材料,具有良好的选择性。
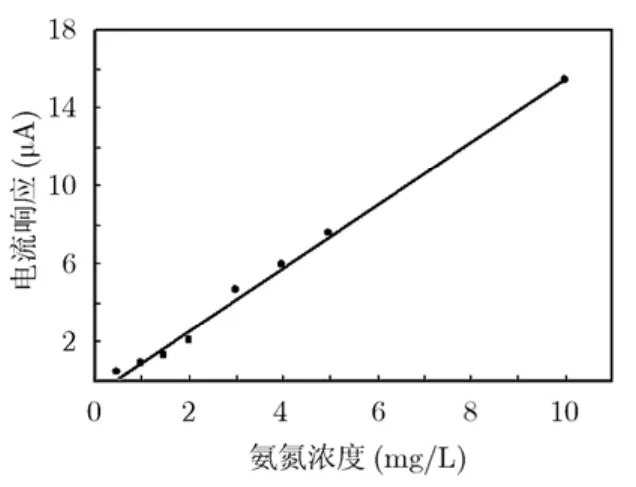
图9 氨氮浓度与传感器电流响应的关系
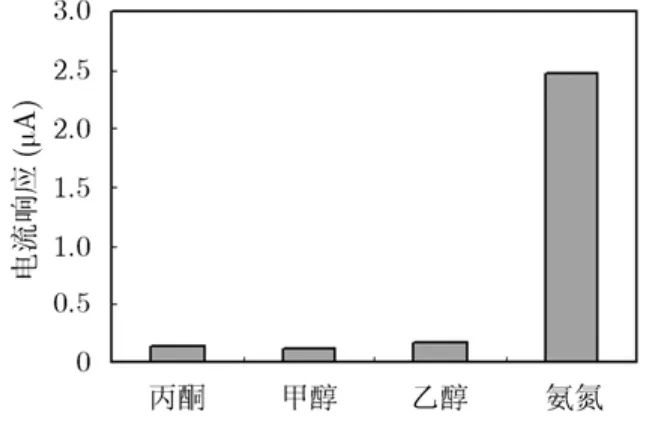
图10 相同摩尔浓度 (1.43 × 1 0-4 M)的丙酮、甲醇、乙醇与氨氮响应电流值的比较
5 结论
本文提出一种具有多层微结构的安培型氨气三维微纳传感芯片,尚未见报道。文中给出了传感器的设计、制备方法及其以此微传感器构建的氨氮检测系统,探索了使用安培型氨气微传感器检测氨氮的方法。对微传感器的时间响应特性、浓度响应特性、重复性和选择性进行了测试和分析。测试结果表明,纳米铱电极对氨具有良好的电催化氧化能力,且对多种有机气体表现出较强的抗干扰性。简单可靠的 Ag/AgCl微参比电极制备工艺为微传感器偏置电压的稳定提供了保证。通过对微结构的设计、敏感材料及键合工艺的选取,制备的安培型氨气微传感芯片实现了对不同浓度氨氮的准确区分,重复性较好,其在氨氮检测方面具有很好的应用前景。
[1]蔡淑珍,邓金花,傅妍芳,等.应用便携式比色计测定水中氨氮[J].现代仪器,2010,16(1):77-79.Cai Shu-zhen,Deng Jin-hua,Fu Yan-fang,et al..Determination of ammonia-nitrogen in water by portable colorimeter[J].Modern Instruments,2010,16(1):77-79.
[2]Hamlaoui M L,Kherrat R,Marrakchi M,et al..Development of an ammonium ISFET sensor with a polymeric membrane including zeolite[J].Materials Science and Engineering,C,2002,21(1/2):25-28.
[3]郑伟,刘文耀,金月寒,等.便携式海水氨氮自动分析仪的研制[J].分析仪器,2002,(2):6-9.Zheng Wei,Liu Wen-yao,Jin Yue-han,et al..Development of a portable seawater ammonia-nitrogen analyzer[J].Analytical Instrumentation,2002,(2):6-9.
[4]刘文耀,郑伟,孙振东,等.基于三电极复合探头的氨氮在线测量[J].天津大学学报,2001,34(2):133-136.Liu Wen-yao,Zheng Wei,Sun Zhen-dong,et al..Online method of measuring ammonia-nitrogen in the ocean using three-electrode combined probe[J].Journal of Tianjin University,2001,34(2):133-136.
[5]Chou C H,Chang J L,and Zen J M.Effective analysis of gaseous formaldehyde based on a platinum-deposited screen-printed edge band ultramicroelectrode coated with Nafion as solid polymer electrolyte[J].Sensors and Actuators,B,2010,147(2/3):669-675.
[6]Park J,Pak Y K,and Pak J J.A microfabricated reservoir-type oxygen sensor for measuring the real-time cellular oxygen consumption rate at various conditions[J].Sensors and Actuators,B,2010,147(1):263-269.
[7]Deng X,Wang F,and Chen Z.A novel electrochemical sensor based on nano-structured film electrode for monitoring nitric oxide in living tissues[J].Talanta,2010,82(4):1218-1224.
[8]Achmann S,Hammerle M,Kita J,et al..Miniaturized low temperature co-fired ceramics (LTCC)biosensor for amperometric gas sensing[J].Sensors and Actuators,B,2008,135(1):89-95.
[9]Pacheco B D,Valério J,Angnes L,et al..Fast batch injection analysis of H2O2using an array of Pt-modified gold microelectrodes obtained from split electronic chips[J].Analytica Chimica Acta,2011,696(1/2):53-58.
[10]Wang P,Liu Y,Abruna H D,et al..Micromachined dissolved oxygen sensor based on solid polymer electrolyte[J].Sensors and Actuators,B,2011,153(1):145-151.
[11]Hiroaki S and Yasuaki M.Microfabricated flow system for ammonia and creatinine with an air-gap structure[J].Sensors and Actuators,B,2004,98(1):101-111.
[12]Lopez de Mishima B A and Mishima H T.Ammonia sensor based on propylene carbonate[J].Sensors and Actuators,B,2008,131(1):236-240.
[13]Pang C,Zhao Z,Du L D,et al..Adhesive bonding with SU-8 in a vacuum for capacitive pressure sensors[J].Sensors and Actuators,A,2008,147(2/3):672-676.
[14]De Vooys A C A,Koper M T M,Van Santen R A,et al..The role of adsorbates in the electrochemical oxidation of ammonia on noble and transition metal electrodes[J].Journal of Electroanalytical Chemistry,2001,506(2):127-137.
[15]Lee M S,Sohn J,Shim J,et al..Miniaturized electrochemical methanol sensor without gas diffusion backings[J].Sensors and Actuators,B,2007,124(2):323-328.
