盐度和温度对大菱鲆幼鱼抗氧化酶活性的影响
2012-09-19郭黎马爱军王新安黄智慧于宏杨志
郭黎,马爱军,王新安,黄智慧,于宏,杨志
(1.中国水产科学研究院黄海水产研究所农业部海洋渔业资源可持续利用重点开放实验室,山东青岛266071;2.上海海洋大学水产与生命学院,上海201306;3.烟台开发区天源水产有限公司,山东烟台264003)
大菱鲆Scophthalmus maximus是原产于欧洲的著名海水养殖品种,具有生长迅速、肉味鲜美、耐低氧、食物转化率高等优点[1-2]。中国水产科学研究院黄海水产研究所于1992年“跨洋引种”将其引入中国,1999年突破了大规模育苗的关键技术。目前,大菱鲆已成为中国北方地区主要养殖品种[3-4]之一,但养殖环境条件的局限性影响了大菱鲆养殖业的大规模推广。温度和盐度作为两个主要的环境因子,在鱼类生长繁育过程中起着非常重要的作用,为此,开展大菱鲆温度和盐度胁迫的研究,对其良种选育和疾病防治具有重要的意义。
养殖密度、光照[5]、水温[6]、溶解氧[7]、盐度[8]等环境条件的变化直接影响鱼体内活性氧含量及抗氧化酶的活性,使机体产生应激反应以适应外界环境的改变,但若长期处于应激状态,必然导致鱼体免疫防御能力和抗病力下降,影响幼鱼正常生长[9]。由于抗氧化酶具有消除机体氧自由基的功能,对增强吞噬细胞防御能力和机体免疫功能有重要作用[10]。因此,研究鱼体抗氧化酶活力对了解并提高机体的免疫机能具有重要意义。当前大菱鲆养殖模式很容易受到如地下水资源量的局限、海水水质的下降、地下海水温度的升高以及不同地区地下水盐度的不同等影响[11]。本研究中,作者以大菱鲆幼鱼为研究对象,初步研究了温度和盐度交互作用对大菱鲆幼鱼行为活动、摄食、存活情况以及体表黏液、血液、鳃和肝脏抗氧化酶活力的影响,以期为大菱鲆幼鱼耐温、耐盐选育,养殖推广,以及病害防治工作提供基础资料。
1 材料与方法
1.1 材料
试验用大菱鲆幼鱼饲养于烟台市天源水产养殖公司,个体质量为 (80.6±6.3)g,均为人工繁育的健康幼鱼。
1.2 方法
1.2.1 试验设计 试验设置5个温度水平:17、20、23、25、28℃,设置5个盐度水平:5、10、20、30、40,温度和盐度共25个组合,每个组合分别设置3个重复。试验在玻璃水槽中进行,每个水槽盛海水约300 L,放养30尾鱼。
试验鱼在玻璃水槽中暂养一周后开始试验,暂养与试验期间,每天9:00投喂饵料,持续充气,每天换水1次。海水正常盐度为30,低盐度海水由地下海水与淡水配制而成,高盐度海水由地下海水与海水晶配制而成。从常温 (13℃)开始24 h升到17℃,然后以每16 h升高1℃的速度升高至试验设定水温。采用静水法充气培养,用自动恒温加热器控温,观察试验鱼在各盐度中的高温胁迫行为及死亡情况。
1.2.2 样品的制备 达到设定温度48 h后,从每个水槽中随机取3尾鱼,用一次性注射器 (2.5 μL)从大菱鲆幼鱼尾静脉取血,血液置于1.5 mL离心管中,4℃下静置4 h后,以12 000 r/min离心30 min,取上清液,即为血清样品;用蒸馏水清洗大菱鲆幼鱼体表,用一次性塑料吸管 (3 μL)轻轻刮取鱼体表面黏液,置于1.5 mL离心管中,即为黏液样品;剪取鱼鳃丝和肝脏,用预冷蒸馏水洗净,滤纸吸干,置于1.5 mL离心管中,即为鳃丝和肝脏样品。所取样品均置于冰箱 (-20℃)中以备用。
1.2.3 酶液的制备 血清样品直接进行酶活测定;取黏液样品与 PBS(包含 NaCl 8 g,KCl 0.2 g,Na2HPO41.42g, KH2PO40.27g, pH 7.4)以1∶2的体积混合,充分震荡,用高速冷冻离心机在4℃下以12 000 r/min离心30 min,取上清液测定酶活;取肝脏和鳃丝样品,每克组织加9倍体积的生理盐水 (体积分数为0.86%),用玻璃匀浆器冰浴匀浆,再将匀浆液在4℃下以12 000 r/min离心30 min,取上清液测定酶活。
1.2.4 酶活的测定 由上海生物工程技术服务有限公司采用通过精炼的Brodford方法测定样品的总蛋白含量;使用试剂盒 (购自南京建成生物工程研究所)测定样品的超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)和谷胱甘肽过氧化物酶 (GPX),测定步骤按试剂盒说明书进行。
1.3 数据处理
采用SPSS 16.0软件进行数据处理和分析,用Duncan氏法进行多重比较。试验数据用平均值±标准误差(mean±S.D.)表示,P<0.05为差异显著。
2 结果
2.1 不同温度和盐度下大菱鲆幼鱼的摄食和死亡情况
从表1可见:盐度对大菱鲆幼鱼的摄食及存活有一定的影响,在温度为17℃和20℃的条件下,大菱鲆能够在低盐和高盐的环境中存活并保持较好的食性,且盐度为40时大菱鲆的摄食和存活情况比盐度为5时好。在盐度为20和30的条件下,大菱鲆能够耐受28℃的水温并保持较低的死亡率;在盐度为5和40的条件下,温度为23℃时大菱鲆摄食变差并开始死亡,28℃时开始大量死亡。根据死亡情况来判断,大菱鲆在高盐和低盐条件下对高温的耐受力,要比在适宜盐度条件下约低5℃。通过观察大菱鲆幼鱼的摄食以及死亡情况,发现在温度为17、20℃与盐度为20、30的组合条件下,大菱鲆幼鱼的摄食、存活情况要显著好于高温和低盐、高温和高盐组合 (P<0.05)。
2.2 抗氧化酶活性的测定
2.2.1 大菱鲆幼鱼肝脏中抗氧化酶的活性 由方差分析可知,温度、盐度以及温度与盐度的交互作用,对大菱鲆幼鱼肝脏SOD、CAT、GP-X活力影响均显著 (P<0.05)。从表2可见:当温度一定时,大菱鲆幼鱼肝脏的SOD、CAT、GP-X活力在其他各盐度中时均高于在对照组盐度30时,且在盐度为5时均较高。当盐度一定时,肝脏的SOD与GP-X活力受温度变化的影响没有表现出明显的规律性,SOD活力在17℃时最高,且显著高于其他各组 (P<0.05),在20℃时较低;CAT活力随着温度的升高呈先升高后降低的趋势,在23℃时最高 (除盐度为30组外),且显著高于其他各组(P<0.05);GP-X活力在20℃和28℃时较高,而在17℃时最低,且显著低于其他各组 (P<0.05)。
在温度与盐度交互作用条件下,SOD活力在17℃与盐度为5和40的组合中较高;在20℃、盐度为5的组合中最低;CAT活力在23℃、盐度为5和10的组合中较高,在17℃、盐度为30及28℃、盐度为30的组合中较低;GP-X活力在28℃、盐度为5及20℃、盐度为10的组合中较高,在17℃所对应的各盐度组合中活力均较低。
2.2.2 大菱鲆幼鱼鳃中抗氧化酶的活性 由方差分析可知,温度、盐度以及温度和盐度的交互作用,对大菱鲆幼鱼鳃中SOD、CAT、GP-X活力影响均显著 (P<0.05)。从表3可见:当温度一定时,鳃中SOD、CAT、GP-X活力在盐度为30时相对偏低。当盐度一定时,鳃中SOD活力变化波动较大,20℃组均显著高于其他各组 (P<0.05);CAT活力没有表现出明显的规律性变化,仅在17℃时活力最低;而GP-X活力在17℃时最高,且
显著高于其他各组 (P<0.05)。

表1 大菱鲆幼鱼在不同温度和盐度下的摄食情况以及死亡数Tab.1 The ingestion and mortality of juvenile turbot under different temperature and salinity
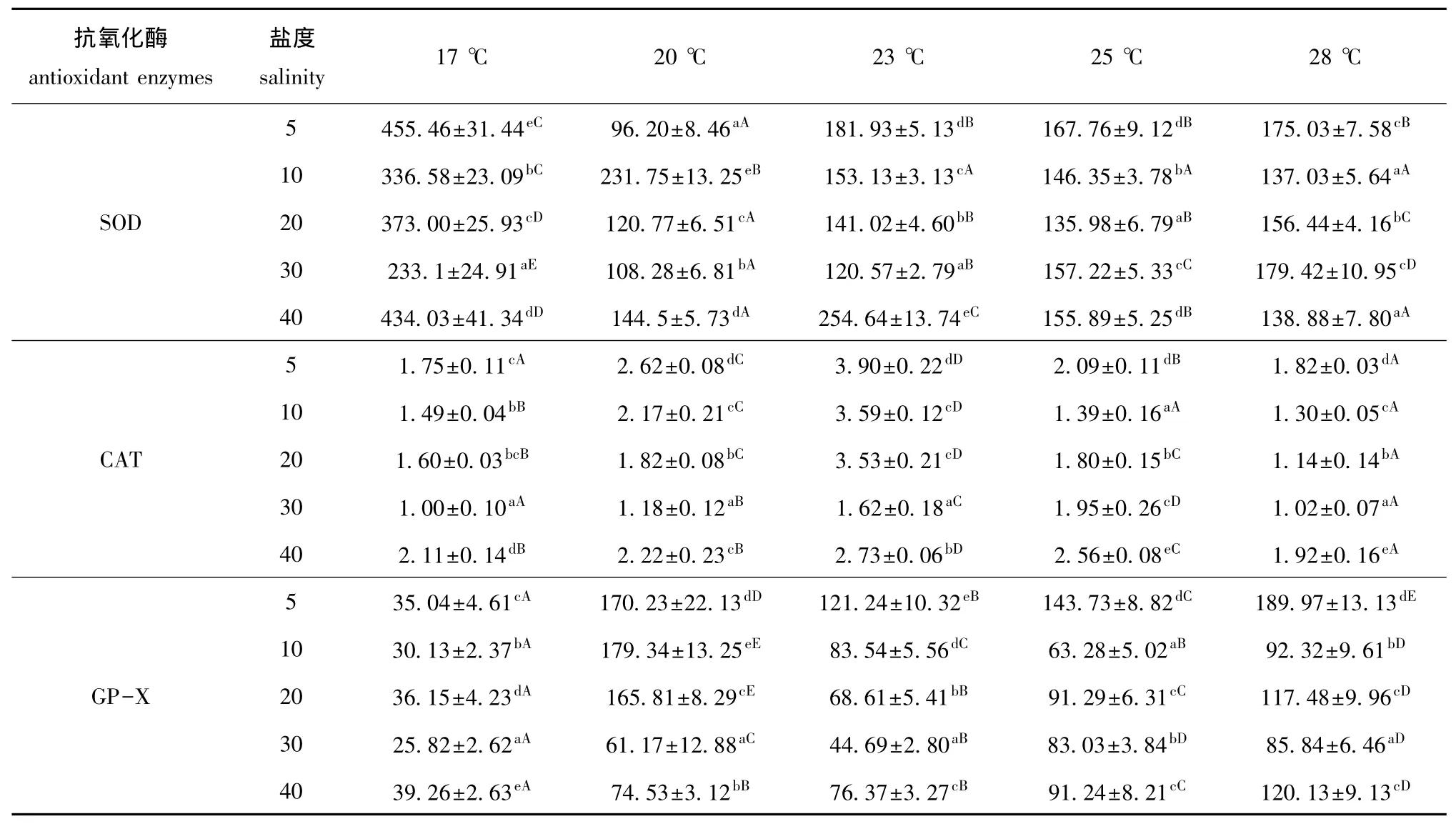
表2 不同温度和盐度下大菱鲆幼鱼肝脏中SOD、CAT、GP-X活力的测定结果Tab.2 Activities of SOD,CAT and GP-X in the liver of juvenile turbot under different temperature and salinity U/mg

表3 不同温度和盐度下大菱鲆幼鱼鳃中SOD、CAT、GP-X活力的测定结果Tab.3 Activities of SOD,CAT and GP-X in the gills of juvenile turbot under different temperature and salinity U/mg
在温度与盐度交互作用的条件下,鳃中SOD活力在20℃、盐度为20的组合中最高,在23℃、盐度为30的组合中最低;CAT活力在28℃、盐度为30的组合中最高,在17℃、盐度为30的组合中最低;GP-X活力在17℃、盐度为5的组合中最高,在28℃、盐度为20的组合中最低。
2.2.3 大菱鲆幼鱼血清中抗氧化酶的活性 由方差分析可知,温度、盐度以及温度和盐度的交互作用,对大菱鲆幼鱼血清中SOD、CAT、GP-X活力影响均显著 (P<0.05)。从表4可见:当温度一定时,大菱鲆幼鱼血清中SOD活力随着盐度的升高呈先升高后降低再升高的趋势,在盐度为5时较低;CAT活力在盐度为5时最高,在盐度为30时较低;而GP-X活力受盐度变化的影响没有表现出明显的规律。盐度一定时,血清中SOD活力在17℃时较高,在28℃时较低;CAT活力随着温度的升高呈先升高后降低的趋势,在25℃时最高,28℃时较低;GP-X活力随着温度的升高基本呈现出先降低后升高再降低再升高的折线变化趋势,在23℃与28℃时较高,在20℃时较低。
在温度与盐度交互作用的条件下,血清中SOD活力在28℃、盐度为30的组合中最高,在28℃、盐度为5的组合中最低;CAT活力在25℃、盐度为5的组合中最高,在28℃、盐度为40的组合中最低;GP-X活力在23℃、盐度为40,28℃、盐度为5,28℃、盐度为40的组合中较高,在17℃、盐度为30的组合中最低。
2.2.4 大菱鲆幼鱼黏液中抗氧化酶的活性 由方差分析可知,温度、盐度以及温度和盐度的交互作用,对大菱鲆幼鱼黏液中SOD、CAT活力影响均显著 (P<0.05)。从表5可见:温度一定时,黏液中SOD的活力随着盐度的变化没有明显的规律性,在盐度为40时相对偏高;CAT活力在盐度为30时最低,且随着盐度由30起降低或升高而均升高,在盐度为5时最高,且显著高于其他各组 (P<0.05)。盐度一定时,黏液中SOD、CAT活力没有明显的变化规律。
在温度与盐度交互作用的条件下,SOD活力在20℃、盐度为40时最高,在28℃、盐度为10和30的组合中活力较低;CAT活力在23℃、盐度为5的组合中最高,在28℃、盐度为30的组合中最低。
通过计算得到的GP-X值基本为负值,分析原因可能是黏液中GP-X的活力太低,难以检测出。

表4 不同温度和盐度下大菱鲆幼鱼血清中SOD、CAT、GP-X活力的测定结果Tab.4 Activities of SOD,CAT and GP-X in the serum of juvenile turbot under different temperature and salinity U/mL

表5 不同温度和盐度下大菱鲆幼鱼黏液中SOD、CAT活力的测定结果Tab.5 Activities of SOD and CAT in the mucus of juvenile turbot under different temperature and salinity U/mg
3 讨论
3.1 温度和盐度对大菱鲆幼鱼摄食行为、活动状况以及存活情况的影响
盐度发生变化时,鱼类必然要经历渗透调节等一系列过程,这需要消耗大量的能量,从而加速了体内新陈代谢,增大了鱼体的能量消耗[12]。温度主要对鱼类代谢反应速率起控制作用,从而影响鱼类的活动和生长。温度的升高可以导致机体耗氧量的增加,增大鱼体的能量消耗[9,13]。如果长期处于高温低盐或者高温高盐状态,必将导致鱼体能量收支失衡,使鱼体抵抗力下降,容易引起死亡。本试验结果表明,在溶解氧充足的情况下,大菱鲆幼鱼在盐度为20~30的海水中可以耐受28℃的水温而保持较低的死亡率;当水温不超过20℃时,大菱鲆幼鱼可以长时间耐受盐度为5和40的海水;4种组合 (水温为17、20℃与盐度为20、30)条件下,大菱鲆幼鱼的摄食、存活情况要显著好于其他组合 (P<0.05)。
3.2 温度与盐度对大菱鲆幼鱼抗氧化酶活性的影响
在鱼类抗氧化系统中,SOD、CAT以及GP-X对清除氧化胁迫过程中产生的活性氧自由基起着决定性作用[14-15]。脊椎动物的肝脏是新陈代谢和氧气消耗的主要组织,其中的抗氧化酶活力较高[16],肝脏中SOD的变化最能代表机体抗氧化防御的变化特征[17]。本试验中发现,肝脏中的SOD与CAT活力要高于在相同状态下的血液和鳃中的活力,这与上述结论较相似。
环境条件的变化可引起鱼体抗氧化酶活性的变化,当盐度发生变化时,鱼类必然要经历渗透调节等一系列过程[18]。这些过程需要消耗大量的能量,从而加速了体内新陈代谢,引发体内抗氧化酶的积极响应,以应对自由基对机体的胁迫反应。王晓杰等[19]对许氏平鲉的研究表明,许氏平鲉血液中SOD、CAT活力随海水盐度的降低呈逐渐上升趋势;杨健等[20]对军曹鱼肌肉的研究也得到同样的结果。本试验中得到的结果与之类似,即随着正常海水盐度 (30)的降低或者升高,酶活力呈现升高的趋势,而达到极限盐度时,又出现下降趋势。推测认为:当盐度改变时,大菱鲆幼鱼需要消耗能量来保持机体渗透压平衡,因此,加速了新陈代谢,产生了较多的活性氧自由基,从而导致体内抗氧化酶活力发生适应性变化,以应对自由基对机体的胁迫反应;而当超过极限耐受盐度时,机体生命表征微弱,酶活力也降低。随着盐度的变化,鱼体不仅产生如酶活力等生理生化方面的应激性变化,而且这种应激性反应也表现在基本的生命表征中,如摄食、行为活动及死亡状况等等。因此,结合这些因素,初步判断出大菱鲆幼鱼生存盐度为20~30,而当低于10或高于40时会出现极限反应,甚至造成死亡。
温度也是影响鱼类抗氧化酶活性的环境因素之一,它主要对鱼类代谢反应速率起控制作用[18]。温度的升高可以导致机体耗氧量的增加,促进氧自由基的产生,进而促进抗氧化酶活性的升高[9]。刘松岩等[21]对中华鲟的研究表明,当温度从12℃升高到31℃时,血清中CAT活力呈上升趋势,但变化不显著,而SOD活力变化显著,在26℃时达到最高值。本试验中大菱鲆幼鱼4种组织中SOD、CAT、GP-X活力随着温度的升高有一定的波动性,但整体来说,其活力随着温度升高的变化没有显著的规律。本研究中通过观察发现,各组织中酶活力在23~25℃时均会发生显著的变化,这说明在此温度点发生了应激性的生理生化反应,因此,同样结合鱼体的摄食、行为活动及死亡状况等生命现象,大致推断大菱鲆幼鱼最适生存水温为17~20℃。
3.3 温度、盐度交互作用对大菱鲆的影响
研究表明,温度和盐度对一些海水硬骨鱼类存在交互效应[22-25]。Imsland等[26]研究发现,大菱鲆生长最佳的温度与盐度组合为21.8℃、盐度为18.5,以及18.3℃、盐度为19.0。本研究中通过分析温度和盐度的交互效应发现,两因素交互作用对SOD、CAT和GP-X活力的影响显著,说明鱼体抗氧化酶活力的变化不仅与温度有关,还与盐度有关。根据多重比较结果,并结合大菱鲆幼鱼摄食、行为活动以及死亡状况,初步判断大菱鲆幼鱼的适宜生活水温为17~20℃,适宜生活盐度为20~30,这与以上观点较为接近,同时也与大菱鲆稚鱼适宜的水温为16~18℃,适宜的盐度为25~32[27]的论点相吻合。
本研究结果表明,在温度与盐度的交互作用下,肝脏和黏液中的酶活力变化最为显著,初步判断这是由于肝脏是主要的新陈代谢和氧气消耗的组织,体表黏液则是鱼体与外界直接接触的第一层屏障,最容易受到抗氧化系统的调控,因此,本文作者认为,肝脏和体表黏液系统是鱼体抵抗外界环境变化的主要器官。
[1]雷霁霖.英国养殖大菱鲆简况[J].水产科技情报,1983(2):26-27.
[2]雷霁霖.海水养殖新品种介绍——大菱鲆[J].中国水产,2000(4):89-92.
[3]雷霁霖.大菱鲆(Scophthalmus maximus)引进与驯养试验[J].中国动物科学研究,2001(2):408-413.
[4]马爱军,陈四清,雷霁霖,等.大菱鲆幼鱼几种饲料的分析与对比实验[J].饲料工业,2000,21(7):17-19.
[5]Fitzgerald J P.Comparative analysis of superoxide dismutase activities in a range of temperate and tropical teleost fish[J].Comp Biochem Physiol,1992,101B:111-114.
[6]Stephan G,Guillaume J,Lamour F.Lipids peroxidation in turbot(Scophthalmus maximus)tissue:effect of dietary vitamin E and dietary n-6 or n-3 polyunsaturated fatty acids[J].Aquaculture,1995,130:251-268.
[7]Parihar M S,Dubey A K.Lipid peroxidation and ascorbic acid status in respiratory organs of male and female freshwater catfish Heteropneustes fossilis exposed to temperature increase[J].Comp Biochem Physiol,1995,112C:309-313.
[8]Helene R,Grard B.Fish blood parameters as a potential tool for i-dentification of stress caused by environmental factors and chemical intoxication[J].Mar Environ Res,1996,41(1):27-43.
[9]Martínez-Alvarez R M,Morales A E,Sanz A.Antioxidant defenses in fish:Biotic and abiotic factors[J].Reviews in Fish Biology and Fisheries,2005,15:75-88.
[10]Rudneva I I.Blood antioxidant system of Black Sea elasmobranch and teleost[J].Comp Biochem Physiol,1997,118C:255-260.
[11]黄连光,苏瑜.大菱鲆工厂化循环式节水养殖技术[J].养殖与饲料,2011(5):17-18.
[12]Martínez-Alvarez R M,Hidalgo M C,Domezain A,et al.Physiological changes of sturgeon Acipenser naccarii caused by increasing environmental salinity[J].J Experim Biol,2002,205:3699-3702.
[13]Lushchak V I,Bagnyukova T V.Temperature increase results in oxidative stress in goldfish tissues:1.Indices of oxidative stress[J].Comp Biochem Physiol,2006,143C:30-35.
[14]Boeuf G,Payan P.How should salinity influence fish growth[J].Comp Biochem and Physiol,2001,130C:411-423.
[15]Ansaldo M,Luquet C M,Evelson P A,et al.Antioxidant levels from different Antarctic fish caught around south[J].Polar Biology,2000,23(3):160-165.
[16]Otto D M E,Moon T W.Endogenous antioxidant systems of two teleost fish.the rainbow trout and the black bullhead,and the effect of age[J].Fish Physiol Biochem,1996,15(4):349-358.
[17]Wilhelm-Filho D W,Giulivi C,Boveris A.Antioxidant defenses in marine fish I:Teleosts[J].Comp Biochem Physiol,1993,106C:409-413.
[18]柳学周,徐永江,马爱军,等.温度、盐度、光照对半滑舌鳎胚胎发育的影响及孵化条件调控技术研究[J].海洋水产研究,2004,25(6):1-8.
[19]王晓杰,张秀梅,李文涛.盐度胁迫对许氏平鲉血液免疫酶活力的影响[J].海洋水产研究,2005,26(6):137-142.
[20]杨健,陈刚,黄建盛.温度和盐度对军曹鱼幼鱼生长与抗氧化酶活性的影响[J].广东海洋大学学报,2007,27(4):25-29.
[21]刘松岩,王明学.环境胁迫对中华鲟体内自由基水平和抗氧化酶活力的影响[D].武汉:华中农业大学,2006.
[22]Watanabe T.Importance of docosahexaenoic acid in marine larval fish[J].World Aqua Soc,1993,24:152-161.
[23]Peters D S,Boyd M T.The effect of temperature,salinity,and availability of food on the feeding and growth of the hogchoker,Trinectes maculates(Bloch and Schneider)[J].J Exp Mar Biol Ecol,1972,7:201-207.
[24]Malloy K D,Targett T E.Feeding,growth and survival of juvenile summer flounder Paralichthys dentatus,experimental analysis of the effects of temperature and salinity[J].Mar Ecol Prog Ser,1991,72:213-223.
[25]Likongwe J S,Steeko T D,Stauffer Jr J R,et al.Combined effects of water temperature and salinity on growth and feed utilization of juvenile Nile tilapia Oreochromis niloticus(Linneus)[J].Aquaculture,1996,146:37-46.
[26]Imsland A K,Foss A,Gunnarsson S,et al.The interaction of temperature and salinity on growth and food conversion in juvenile turbot(Scophthalmus maximus)[J].Aquaculture,2001,198:353-367.
[27]雷霁霖,门强.大菱鲆人工繁殖与养殖技术讲座[J].齐鲁渔业,2002,19(10):47-48.
