不同壳色菲律宾蛤仔免疫机能的比较研究
2012-09-19丁鉴锋杨霏闫喜武杨凤赵立强张国范
丁鉴锋,杨霏,闫喜武,杨凤,赵立强,张国范
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023;3.中国科学院海洋研究所,山东青岛266071)
在贝类生长过程中,由于受自然条件、生理及遗传等因素的影响,不同群体之间或同一群体中产生了壳色多态性。在对马氏珠母贝Pinctada fucata martensi、海湾扇贝Argopecten irradians和皱纹盘鲍Haliotis discus discus的研究发现,这些海产经济贝类的不同壳色群体在生长速度、成活率和出肉率等方面表现出显著的差异性,尤其重要的是多种贝类的壳色能够稳定遗传[1]。因此,将壳色作为一个明显的表型,应用于遗传育种具有重要的价值。
菲律宾蛤仔Ruditapesp hilippenarum属双壳纲、帘蛤科、缀锦亚科、蛤仔属,是一种广温、广盐性海水养殖品种,中国年产菲律宾蛤仔300万t左右,约占中国贝类产量的30%,占海水养殖总产量的20%,占世界贝类总产量的90% 以上[2]。目前,蛤仔养殖中存在种质资源性状退化、品质下降等问题,而杂交育种是解决这些问题的一条有效途径。菲律宾蛤仔壳色具有较高的多态性,壳色作为质量性状可以稳定遗传。闫喜武等[3-6]研究发现:不同壳色蛤仔生长速度、存活率等性状存在显著差异,通过杂交选育获得了具有特定壳色特征并表现出良好数量性状的蛤仔品系。
本研究中,作者通过对菲律宾蛤仔天然群体中不同壳色蛤仔相关免疫指标进行比较研究,旨在进一步探讨蛤仔壳色与存活率、抗病力等性状的关系,为种质改良提供参考资料。
1 材料与方法
1.1 材料
试验用菲律宾蛤仔采自庄河海区,选取体质量为 (11.34±0.81)g、体长为 (39.85±0.81)mm、健康并具有鲜明壳色特征的野生菲律宾蛤仔作为研究对象,其中斑马蛤群体 (Zb),壳面具有斑马条状花纹;珍珠白群体 (Pw),背景颜色为白色,左壳背部有一条深色放射条带;两道红群体 (Tr),壳面具有两条红色放射条带;两道白群体 (Tw),壳面具有两条白色放射条带;奶牛蛤群体 (Co),壳面具有奶牛黑白色花纹。
1.2 方法
1.2.1 试验设计 从每个群体选取蛤仔40只,置于水槽中暂养7 d,养殖用海水盐度为32,水温为(22±1)℃。暂养期间,连续充气,每天全量更换海水1次,每天投喂螺旋藻粉1次。
1.2.2 血淋巴细胞样品的制备 试验开始时,从各群体中分别取样30只,用无菌注射器 (1 mL)从菲律宾蛤仔围心腔中抽取血淋巴200 μL,放入样品管中 (1.5 mL)并置于冰上。将一个群体每6只蛤仔的血淋巴样品混合后用于后续各种指标的测定,每种指标的测定共设5个重复。
1.2.3 总细胞数的测定 从血淋巴混合样品中吸取30 μL加入到等量的BFC固定液 (包含 NaCl 2%、乙酸钙1%、甲醛4%,均为体积分数)中,固定后将样品加到血球计数板中,在10倍光学显微镜下观察并计数。
1.2.4 血细胞吞噬活性的测定 采用Hannam等[7]的方法。取50 μL血淋巴混合样品加入96孔酶标板中,于4℃下孵育1 h;用100 μL贝类生理盐水 (包含0.02 mol/L HEPES、0.4 mol/L NaCl、0.1 mol/L MgSO4、0.01 mol/L KCl、0.01 mol/L CaCl2,pH 7.4)冲洗2次,洗去未黏附的血细胞;加入 50 μL中性红染过的酵母悬液 (50×107个/mL),于20℃下孵育30 min后,加入100 μL BFC液终止反应;多余的酵母颗粒用生理盐水洗去,加入100 μL酸化酒精 (包含醋酸1%、酒精20%,均为体积分数),置于酶标仪中,读取吸光度值OD550nm。吞噬活性表示方法:每毫克蛋白所吞噬的酵母颗粒数。
酵母标准曲线的制备:取50 μL中性红染色的酵母 (密度分别为 100×107、50×107、25×107、12.5×107、6.25×107个/mL),加入等量酸化酒精,读取吸光度值OD550nm,以酵母密度与吸光度值作标准曲线。
1.2.5 酚氧化酶 (PO)活性的测定 采用Zhang等[8]的方法并加以改进。以L-多巴胺为底物,以胰蛋白酶为诱导因子。取50 μL血淋巴混合样品加入96孔酶标板中,分别加入50 μL CAC缓冲液(包含 0.01 mol/L二甲基胂酸钠、0.45 mol/L NaCl、10 mmol/L CaCl2·6H2O、26 mmol/L MgCl2·2H2O,pH 7.0),混合均匀,于25℃下孵育10 min;加入100 μL L-多巴胺溶液 (将L-多巴胺溶于CAC缓冲液中配成质量浓度为3 mg/mL的溶液),混合均匀后置于酶标仪中,读取吸光度值OD490nm。酶活性定义为:在试验条件下,每分钟吸光度值增加0.001为一个酶活力单位。活性表示方法:每毫克蛋白所具有的酶活力。
1.2.6 溶菌酶 (LYZ)活性的测定 采用Allam等[9]的方法并加以改进。以鸡溶菌酶标准品为标准,取40 μL标准品 (质量浓度分别为40、20、10、5、2.5、1.25、0.6 mg/mL)或者血淋巴混合样品加入96孔酶标板中;分别向各孔中加入160 μL溶壁微球菌溶液 (细菌 OD600nm=0.4,0.06 mol/L磷酸盐缓冲液,pH 6.4);室温下孵育1 h,读取吸光度值OD540nm,采用标准曲线计算血淋巴细胞的溶菌酶活性。活性表示方法:每毫克蛋白所具有的酶活力。
1.2.7 亮氨酸氨基肽酶 (LAP)活性的测定 采用Oubella等[10]的方法。取 100 μL 血淋巴混合样品加入96孔酶标板中,再分别加入75 μL Tris-HCl缓冲液 (0.2 mol/L,pH 8.0),混合均匀后分别加入25 μL 10 mmol/L L-亮氨酸-4-硝基苯胺(用去离子水配制,Sigma公司产品),立即置于酶标仪上,记录20 min内吸光度OD405nm的变化情况,每5 min读数1次。酶活力单位定义为:以每毫克蛋白浓度改变的吸光度值0.001为一个酶活力单位。活性表示方法:每毫克蛋白所具有的酶活力。
1.2.8 超氧化物歧化酶 (SOD)活性的测定 使用碧云天生物技术研究所总SOD活性检测试剂盒,按照试剂盒说明书操作步骤测定血淋巴SOD活性。活性表示方法:每毫克蛋白所具有的酶活力。
1.2.9 总蛋白浓度的测定 使用碧云天生物技术研究所Bradford蛋白浓度测定试剂盒,按照试剂盒说明书操作步骤测定血淋巴总蛋白浓度。
1.3 数据处理
试验数据均用平均值±标准差 (means±S.D.)表示,用SPSS 11.5软件进行单因素方差分析和多重比较。
2 结果
2.1 血细胞总数和血细胞吞噬能力
不同壳色蛤仔血细胞总数和血细胞吞噬能力的测定结果见图1。从图1可见:Tw群体血细胞总数要稍高于其他群体,但各群体间均无显著差异(P>0.05);Zb和Pw群体的血细胞吞噬能力显著高于Co群体 (P<0.05),Tr和Tw群体的吞噬能力也高于Co群体,但差异不显著 (P>0.05)。
2.2 溶菌酶和亮氨酸氨基肽酶活性
不同壳色蛤仔血细胞LYZ和LAP活性的比较结果见图2。从图2可见:Tr和Tw群体蛤仔的血细胞表现出较强的LYZ活性,且显著高于其他3组 (P<0.05),而Zb、Pw和Co群体的LYZ活性彼此均无显著差异(P>0.05);Zb和Pw群体的LAP活性高于其他3组,但差异不显著 (P>0.05),而Tw群体的LAP活性最低,与其他群体差异均不显著 (P>0.05)。
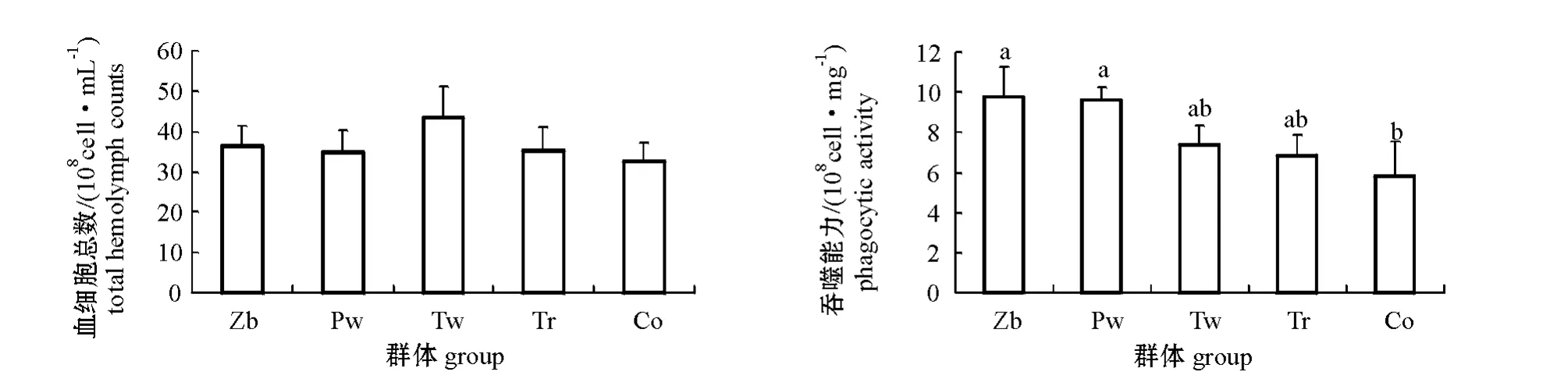
图1 不同壳色菲律宾蛤仔血细胞总数和血细胞吞噬能力的比较Fig.1 Comparison of the total hemolymph counts and phagocytic activity in hemolymph of Manila clam with different shell colours

图2 不同壳色菲律宾蛤仔血细胞LYZ和LAP活性的比较Fig.2 Comparison of the activities of lysozyme and leucine aminopeptidase in hemolymph of Manila clam with different shell colours
2.3 酚氧化酶和超氧化物歧化酶活性
不同壳色蛤仔血细胞PO和SOD活性的比较见图3。从图3可见:Co群体血细胞的PO活性最高,但仅显著高于Tr群体 (P<0.05),Pw群体的PO活性次之,虽高于Zb、Tw、Tr群体,但差异均不显著 (P>0.05);Pw群体血细胞的SOD活性最高,显著高于Tr和Co群体 (P<0.05),但与Zb和Tw群体差异不显著 (P<0.05),Zb群体的SOD活性次之,也显著高于Tr群体,但与Tw、Co群体差异不显著 (P>0.05),Tw群体的SOD活性也较Tr和Co群体高,但差异不显著 (P>0.05)。

图3 不同壳色菲律宾蛤仔血细胞PO和SOD活性的比较Fig.3 Comparison of the activities of phenoloxidase and superoxidase dismutase in hemolymph of Manila clam with different shell colours
3 讨论
贝类呈现不同壳色的因素包括物理性和化学性两方面。化学性因素是指由色素沉积产生的颜色,如黑色素产生黑、灰、褐色,脂类色素 (包括胡萝卜素和卟啉)则可产生红、紫、黄、橙、绿等颜色。物理性因素主要是通过色素细胞上方无色且有凸凹沟纹的蜡质层,或夹在色素间多角形无色的折光细胞,对光的折射而产生不同的颜色。一些软体动物壳表面有规律的微结构对光干涉和衍射可呈现独特的彩虹色,称之为结构性壳色[11]。从已有的研究来看,贝类壳色是可以遗传的,壳色及色素沉积模式都是由简单的孟德尔遗传基础控制,但很多环境因素,如生长环境的盐度、温度和深度,以及对摄食食物色素的被动吸收等均影响壳色的选择,在不同群体之间或同一群体中产生壳色多态性。如泥螺Batillaria attramentaria壳色的多态性与潮汐和环境温度变化有关[12];而对滨螺 Littorina obtusata和Littorina saxatilis的相关研究也表明,环境温度和水环境盐度对壳色显型的选择均具有较高的贡献[13-16],皱纹盘鲍壳色除受遗传基因控制外,还受到食物成分的影响[17]。
贝类的免疫能力同样会受环境因子如温度、盐度、溶氧、食物和污染物等影响[18-21]。环境温度升高能够抑制栉孔扇贝Chlamys farreri和海湾扇贝的免疫能力,从而导致其大规模死亡;将杂色鲍Haliotis diversicolor supertexta从28℃的水中转移到32℃的水中时,会导致其免疫能力降低,从而更易受到弧菌Vibrio parahaemolyticus的感染[22-24];对鸡帘蛤Chamelea gallina的研究发现,温度超过25℃时对其生长产生不利的影响,而温度超过30℃时其免疫能力受到明显的抑制,此时受病原感染的几率会大大增加[25]。Lambert等[26]通过对比夏季高温期低死亡率和高死亡率的太平洋牡蛎Crassostrea gigas家系发现,牡蛎的血细胞数量、形态、呼吸爆发能力以及对病原弧菌的易感性等免疫因子由遗传控制,受到环境因素的影响,并可决定个体在夏季的存活能力。对太平洋牡蛎[19]、贻贝Mytilus galloprovincialis等[27]的研究发现,盐度升高和降低都会影响贝类的免疫能力。Soudant等[28]研究发现,季节变化以及养殖环境能够影响菲律宾蛤仔的生理和免疫参数,并且与蛤仔褐环斑病(Brown ring disease)的流行性有关。
环境因子对贝类壳色和免疫能力都具有选择性,而适应性是自然选择的结果,只有那些有适应意义的性状才在进化中被保留下来,因此,贝类壳色和免疫能力之间可能具有某种相关性。相关的研究结果也提供了一些间接证据:Brand等[29]研究发现:一些壳色的扇贝个体在发育的某一阶段急剧减少,原因可能是由于这一壳色的个体虚弱,对环境的适应能力较低而被淘汰;Bauchau[27]的假说认为,贝类生长是受神经调控,贝壳色素作为一种稳定的信号标记能够被神经末梢识别,并且神经系统对不同色素的识别能力不同,色素分布的形状能够调节贝壳生长过程以获得最佳的结构 (如双壳类贝壳的对称性),而对称性是动物发育稳定的一种标志,因此,色素结构可能是影响贝类发育稳定性的一种机制。有研究[30-31]发现,发育稳定的个体都具有较好的对称性,并且免疫能力和繁殖力都要远高于不对称的个体。因此,不同贝类的壳色可能会通过调节贝类的发育过程影响其免疫能力。闫喜武等[3-6]对菲律宾蛤仔的相关研究发现,斑马蛤和玛瑙黑等壳色群体的子代比两道红群体具有更高的成活率和更强的抗逆性。本研究中发现,斑马蛤的血细胞吞噬能力、PO、LAP和SOD活性均高于两道红,这些参数的差异可能与蛤仔的壳色之间有一定相关性。
一些分子生物学的研究结果也表明壳色与免疫能力之间可能有一定的相关性,Jackson等[32]研究发现,Has-sometsuke的转录物主要形成一些壳上的蓝色和红色斑点,表明基因表达与贝壳的结构之间有直接关系,这种基因表达与壳色的关联性为进一步研究形成壳结构和壳色的分子机制奠定了基础。Kinoshita等[33]对珍珠贝Pinctada fucata外套膜和珍珠囊中壳形成相关基因转录组数据进行分析,发现多种编码凝集素、蛋白酶、蛋白酶抑制因子等的基因序列;Wang等[34]研究发现,皱纹盘鲍体内编码壳形成蛋白perlucin的基因具有典型的C型凝集素结构;Nagai等[35]在合浦珠母贝Pinctada fucata体内发现两种与壳黑色素形成相关的基因—Pfty1和Pfty2,其编码的蛋白可能具有酚氧化酶的活性,这些研究表明,贝类体内的多种免疫基因可能参与贝壳及壳色的形成过程。Guan等[36]采用抑制性消减杂交技术对马氏珠母贝红壳色和非红壳色个体进行了研究,发现多个基因的表达可能与红壳色家系壳色多样性有关。因此,贝类的壳色可能受多个基因调控网络的控制。最新的研究表明,同一基因在不同生物学通路的权重可以不同[37],本研究中采用的蛤仔免疫指标受不同的信号转导途径调控[38],所表现出的差异性是否与壳色决定基因在不同信号转导途径所发挥的作用不同有关,还有待进一步研究。
[1]王庆恒,邓岳文,杜晓东,等.马氏珠母贝4个壳色选系F1幼虫的生长比较[J].中国水产科学,2008,15(3):488-492.
[2]农业部渔业局.中国2008年渔业年鉴[M].北京:中国农业出版社,2009:321.
[3]闫喜武,张跃环,霍忠明,等.不同壳色菲律宾蛤仔品系F2的表型性状[J].水产学报,2010,34(6):701-709.
[4]闫喜武,张跃环,孙焕强,等.菲律宾蛤仔两道红与白斑马品系的三元杂交[J].水产学报,2010,34(8):1190-1197.
[5]闫喜武,张国范,杨凤,等.菲律宾蛤仔莆田群体两个壳色品系生长发育的比较[J].大连水产学院学报,2005,20(4):266-269.
[6]张跃环,闫喜武,霍忠明,等.不同地理群体菲律宾蛤仔生长发育的比较[J].大连水产学院学报,2009,24(1):34-39.
[7]Hannam M L,Bamber S D,Moody A J,et al.Immunotoxicity and oxidative stress in the Arctic scallop Chlamys islandica:Effects of acute oil exposure[J].Ecotoxicology and Environmental Safety,2010,73(6):1440-1448.
[8]Zhang Q,Ma H,Mai K,et al.Interaction of dietary Bacillus subtilis and fructooligosaccharide on the growth performance,non-specific immunity of sea cucumber,Apostichopus japonicus[J].Fish &Shellfish Immunology,2010,29(2):204-211.
[9]Allam B,Paillard C.Defense factors in clam extrapallial fluids[J].Diseases of Aquatic Organisms,1998,33(2):123-128.
[10]Oubella R,Paillard C,Maes P,et al.Changes in hemolymph parameters in the Manila clam Ruditapes philippinarum(Mollusca,Bivalvia)following bacterial challenge[J].Journal of Invertebrate Pathology,1994,64(1):33-38.
[11]管云雁,何毛贤.海产经济贝类壳色多态性的研究进展[J].海洋通报,2009,28(1):108-114.
[12]Miura O,Nishi S,Chiba S.Temperature-related diversity of shell colour in the intertidal gastropod Batillaria[J].Journal of Molluscan Studies,2007,73(3):235.
[13]Sergievsky S O.A review of ecophysiological studies of the colour polymorphism of Littorina obtusata(L.)and L.saxatilis(Olivi)in the White Sea[C]//Proceedings of the Third International Symposium on Littorinid Biology.London:Malacological Society of London,1992:235-245.
[14]Sergievsky S O,Berger V J.Physiological differences of principal shell-colour phenotypes of the gastropod mollusc Littorina obtusata[J].Biol Moria,1984,2:36-44.
[15]Phifer-Rixey M,Heckman M,Trussell G C,et al.Maintenance of clinal variation for shell colour phenotype in the flat periwinkle Littorina obtusata[J].Journal of Evolutionary Biology,2008,21(4):966-978.
[16]Sokolova I,Berger V J.Physiological variation related to shell colour polymorphism in White Sea Littorina saxatilis[J].Journal of Experimental Marine Biology and Ecology,2000,245(1):1-23.
[17]Qin Y,Liu X,Zhang H,et al.Identification and mapping of amplified fragment length polymorphism markers linked to shell color in bay scallop,Argopecten irradians irradians(Lamarck,1819)[J].Mar Biotechnol(NY),2007,9(1):66-73.
[18]Gagnaire B,Frouin H,Moreau K,et al.Effects of temperature and salinity on haemocyte activities of the Pacific oyster,Crassostrea gigas(Thunberg)[J].Fish & Shellfish Immunology,2006,20(4):536-547.
[19]Fisher W S,Wishkovsky A,Chu F L E.Effects of tributyltin on defense-related activities of oyster hemocytes[J].Archives of Environmental Contamination and Toxicology,1990,19(3):354-360.
[20]Delaporte M,Soudant P,Lambert C,et al.Impact of food availability on energy storage and defense related hemocyte parameters of the Pacific oyster Crassostrea gigas during an experimental reproductive cycle[J].Aquaculture,2006,254(1-4):571-582.
[21]Gagnaire B,Thomas-Guyon H,Burgeot T,et al.Pollutant effects on Pacific oyster,Crassostrea gigas(Thunberg),hemocytes:Screening of 23 molecules using flow cytometry[J].Cell Biology and Toxicology,2006,22(1):1-14.
[22]Chen M,Yang H,Delaporte M,et al.Immune responses of the scallop Chlamys farreri after air exposure to different temperatures[J].Journal of Experimental Marine Biology and Ecology,2007,345(1):52-60.
[23]Cheng W,Hsiao I.Change in water temperature on the immune response of Taiwan abalone Haliotis diversicolor supertexta and its susceptibility to Vibrio parahaemolyticus[J].Fish & Shellfish Immunology,2004,17(3):235-243.
[24]Liu S,Jiang X,Hu X,et al.Effects of temperature on non-specific immune parameters in two scallop species:Argopecten irradians(Lamarck 1819)and Chlamys farreri(Jones&Preston 1904)[J].Aquaculture Research,2004,35(7):678-682.
[25]Monari M,Matozzo V,Foschi J,et al.Effects of high temperatures on functional responses of haemocytes in the clam Chamelea gallina[J].Fish & Shellfish Immunology,2007,22(1-2):98-114.
[26]Lambert C,Soudant P,Dégremont L,et al.Hemocyte characteristics in families of oysters,Crassostrea gigas,selected for differential survival during summer and reared in three sites[J].Aquaculture,2007,270(1-4):276-288.
[27]Bauchau V.Developmental stability as the primary function of the pigmentation patterns in bivalve shells?[J].Belgian Journal of Zoology,2001,131(Suppl.2):23-28.
[28]Soudant P,Paillard C,Choquet G,et al.Impact of season and rearing site on the physiological and immunological parameters of the Manila clam Venerupis(=Tapes,=Ruditapes)philippinarum[J].Aquaculture,2004,229(1-4):401-418.
[29]Brand E,Kijima A,Fujio Y.Shell color polymorphism and growth in the Japanese scallop,Patinopecten yessoensis[J].Tohoku Journal of Agricultural Research,1994,44:67-76.
[30]Rantala M J,Koskimìki J,Taskinen J,et al.Immunocompetence,developmental stability and wingspotsize in the damselfly Calopteryx splendens L.[J].Proceedings of the Royal Society of London Series B:Biological Sciences,2000,267:2453-2457.
[31]Møller A P.Developmental stability and fitness:a review[J].The American Naturalist,1997,149(5):916-932.
[32]Jackson D,McDougall C,Green K,et al.A rapidly evolving secretome builds and patterns a sea shell[J].BMC Biology,2006,4(1):40.
[33]Kinoshita S,Wang N,Inoue H,et al.Deep sequencing of ESTs from nacreous and prismatic layer producing tissues and a screen for novel shell formation-related genes in the pearl oyster[J].PloS One,2011,6(6):e21238.
[34]Wang N,Lee Y H,Lee J.Recombinant perlucin nucleates the growth of calcium carbonate crystals:Molecular cloning and characterization of perlucin from disk abalone,Haliotis discus discus[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2008,149(2):354-361.
[35]Nagai K,Yano M,Morimoto K,et al.Tyrosinase localization in mollusc shells[J].Comparative Biochemistry and Physiology Part B:Biochemistry & Molecular Biology,2007,146(2):207-214.
[36]Guan Y,Huang L,He M.Construction of cDNA subtractive library from pearl oyster(Pinctada fucata Gould)with red color shell by SSH[J].Chinese Journal of Oceanology and Limnology,2011,29(3):616-622.
[37]Fang Z,Tian W,Ji H.A network-based gene-weighting approach for pathway analysis[J].Cell Research,2012,22:565-580.
[38]Söderhäll K.Invertebrate immunity[M].USA:Springer,2011:49-53.
