‘神马’切花菊蕾期采后催花液1)
2012-09-18李永华马海燕
李永华 马海燕 李 永
(河南农业大学,郑州,450002)
菊花为草本花卉,菊科菊属,为世界四大鲜切花之一,其品种繁多,花色艳丽。随着鲜切花产业化的发展,鲜切花采后保鲜技术的研究已成为了鲜切花研究的主要内容。采用鲜切花蕾期采收贮藏后催花技术可有效地降低鲜切花的贮运成本和损耗,提高鲜切花的产量和质量,调节季节性鲜切花的供应[1],其中郁金香、百合[2]、唐菖蒲[3]、香石竹[4]切花以及迎春[5]、连翘[6]等切枝在采后催花方面具有一定的研究基础,而针对切花菊蕾期采收后进行催花并没有相关的研究。‘神马’切花菊原产于日本,是日本切花市场上畅销的切花菊品种。由于‘神马’为日本国内不受保护的菊花品种,目前,‘神马’切花菊已成为我国对日合法出口的主要菊花品种[7]。本试验采用常用的保鲜化学试剂作为催花液的成分,筛选最佳催花液组合,为切花菊蕾期采后催花技术研究提供依据。
1 材料与方法
1.1 试验材料
试验材料为‘神马’切花菊,属菊科菊属,由郑州市顺达高新农业技术有限公司提供。采取标准:花蕾初放,蕾径2~3 cm,花枝长70~80 cm,花枝健壮,长势一致,无病虫害,无损伤。
材料处理:用市场上通用的包装纸(报纸)对材料进行包裹,为了保证材料的鲜度和清洁度,材料包装后2 h内运回实验室进行1 h复水,复水时对材料的叶子进行清洗。模拟运输贮藏(短期贮运),放入冰箱中4℃贮藏,贮藏时间为1 d。贮藏处理后取出材料,在水中进行斜口剪切,最后进行瓶插催花试验。
1.2 试验设计与方法
试验在河南农业大学林学院人工气候室进行,室内温度(24±1)℃,湿度80% ~90%,光照为(2000±100)Lx。
1.2.1 正交试验设计
以蔗糖为营养成分,8-羟基喹啉(8-HQ)为杀菌剂,水杨酸(SA)为有机酸成分,氯化钙(CaCl2)为无机盐成分,分别记为A、B、C、D 4因素,每个因素均为3个水平,试验采用4因素3水平正交试验,共9个处理(表1),1个对照(去离子水)。以瓶插的形式,每个处理4个重复,每个重复4枝切花,插于装有250 mL催花液的规格为500 mL的三角瓶中,3 d更换1次催花液,通过试验得到最佳催花液组合。

表1 正交试验设计
1.2.2 验证试验
通过正交试验,得到最佳的催花液组合为处理Ⅰ,以正交试验组合中与最佳催花液组合成分相近的组合为处理Ⅱ,观察得到的最佳组合为处理Ⅲ,去离子水为对照处理(CK),进行验证试验。每个处理5个重复,每个重复4枝切花,插于装有250 mL催花液的规格为500 mL的三角瓶中,3 d更换1次催花液。试验材料生理指标的测定以花瓣为主,每天的10:00之前采取花瓣,采取的部位为花蕾从外到里的第3至第5层的花瓣,进行相应指标的测定。
1.3 测定项目与方法
根据Preece等[8]对菊花开花阶段的研究而建立的菊花开花的6个阶段:阶段1为花蕾出现,但是舌状花完全被苞片覆盖;阶段2为花蕾初放,舌状花露出顶部;阶段3为舌状花紧紧地交迭在一起;阶段4为舌状花的顶部都出现,但是外层花瓣还没有展开;阶段5为外层舌状花展开(6 cm以上);阶段6为花朵完全开放(7 cm以上),从瓶插日起观察花枝的外部形态变化及花蕾开放进程,并做相关记录(从阶段3进行记录)。
1.3.1 正交试验测定指标与方法
花径测定:催花期间每天对各处理分别取12朵开放至最大的花径,通过电子游标卡尺准确量取外层花瓣的最大花径,计算出每个处理每天的平均花径。
催花时间:从催花瓶插日起至花蕾开放达到阶段5,即外层舌状花展开,平均花径≥6 cm时的瓶插时间。
花径日变化量:催花期间相邻2 d平均花径大小之差。
1.3.2 验证试验测定指标与方法
花径测定:同正交试验测定方法。
水分平衡值测定:催花期间每天称取花枝+溶液+瓶的质量,2次连续称量之差即为花枝的失水值;称取溶液+瓶的质量,2次连续称量之差即为花枝的吸水值;吸水值和失水值之差即为花枝的水分平衡值。该指标测定取16枝花的平均值。
花枝鲜质量变化:催花期间每天测定花枝鲜质量,花枝鲜质量(G)=(花枝+催花液+瓶的质量)-(催花液+瓶的质量),花枝鲜质量变化率=(Gn+1-Gn)×100%(式中:Gn为当天的花枝鲜质量;Gn+1为次日的花枝鲜质量,n≥1)。该指标测定取16枝花的平均值。
生理生化指标测定:可溶性蛋白质质量分数采用考马斯亮蓝法测定;可溶性糖质量分数测定采用蒽酮显色法;过氧化物酶(POD)活性采用愈创木酚法测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定[9]。
1.4 数据分析方法
试验数据用EXCEL2003软件进行作图与计算,利用SPSS软件进行方差分析,利用Duncan’s新复极差法进行差异显著性比较。
2 结果与分析
2.1 正交试验
正交试验以花径日变化量为考察指标。催花瓶插期间9个处理的花径平均日变化量分别为:1.124、1.142、1.154、1.181、1.206、1.209、1.267、1.277、1.279 cm。从表 2 直观统计分析,催花液 9个处理中各因素的优劣顺序为:A3>A2>A1,B3>B2>B1,C1>C3>C2,D1>D3>D2。
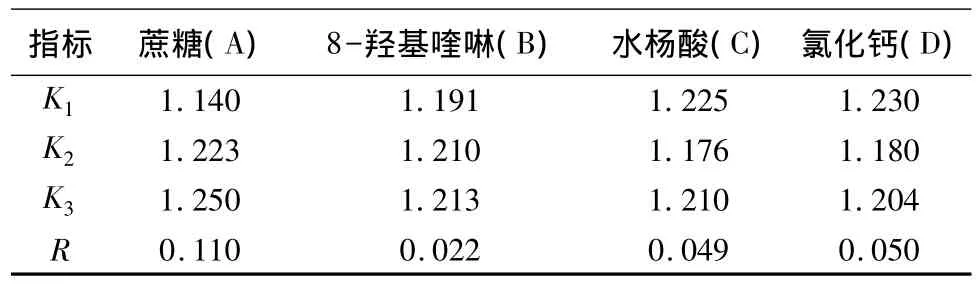
表2 不同催花液对花径日变化量影响的正交试验分析
花蕾直径的大小可以直观地反映催花的效果,从表3的方差分析结果看,A、C、D 3个因素均对花径变化有显著影响(P<0.05),结合表2中极差(R)的大小表明:各因素对花径变化影响的主次效应由大到小的顺序为:A、D、C、B,说明主因素A(蔗糖)能有效的促进花蕾的开放,因素B(8-羟基喹啉)作为杀菌剂成分对花径变化没有显著的影响(P>0.05)。结合表3中的分析结果,得到最佳催花液组合为A3B3C1D1:50 g·L 蔗糖+300 mg·L8-羟基喹啉+75 mg·L-1水杨酸+150 mg·L-1氯化钙。
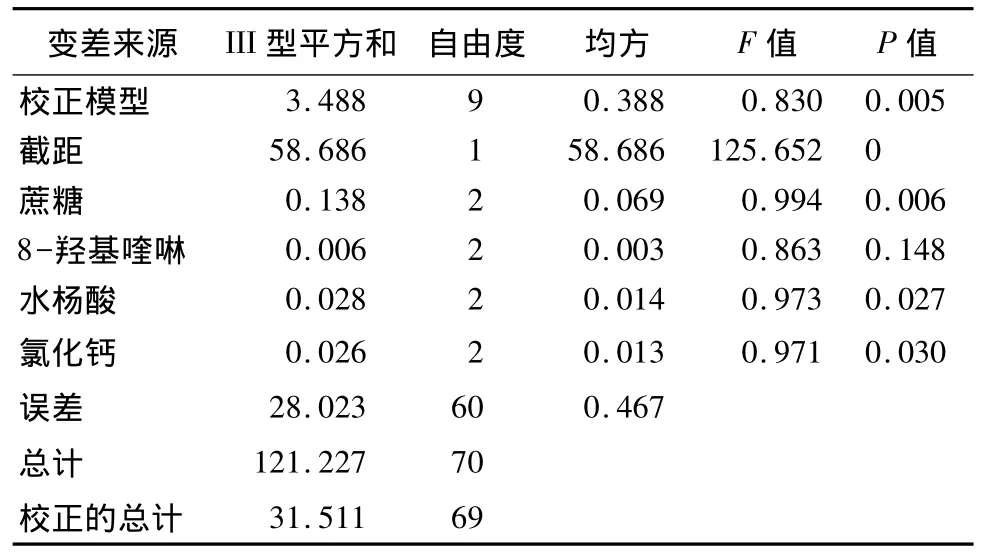
表3 不同催花液对花径日变化量影响的方差分析
从表4可知,在所有的催花液处理中,在瓶插第3 d处理5和处理7的平均花径>6 cm,达到了催花的标准,在瓶插末期处理7的平均花径最大,为10.478 cm,由此确定通过观察得到最佳的催花液组合为处理 7:A3B1C3D2(50 g·L-1蔗糖+100 mg·L-18-羟基喹啉+150 mg·L-1水杨酸+200 mg·L-1氯化钙)。
以正交试验方差分析得到的最佳催花液组合A3B3C1D1(50 g·L-1蔗糖+300 mg·L-18-羟基喹啉+75 mg·L-1水杨酸+150 mg·L-1氯化钙)为处理Ⅰ,以与组合 A3B3C1D1成分相近的催花液组合A3B3C2D1(50 g·L-1蔗糖+300 mg·L-18-羟基喹啉+100 mg·L-1水杨酸+150 mg·L-1氯化钙)为处理Ⅱ,以观察获得的最佳催花液组合A3B1C3D2(50 g·L-1蔗糖+100 mg·L-18-羟基喹啉+150 mg·L-1水杨酸+200 mg·L-1氯化钙)为处理Ⅲ,以去离子水为对照CK,进行验证试验。
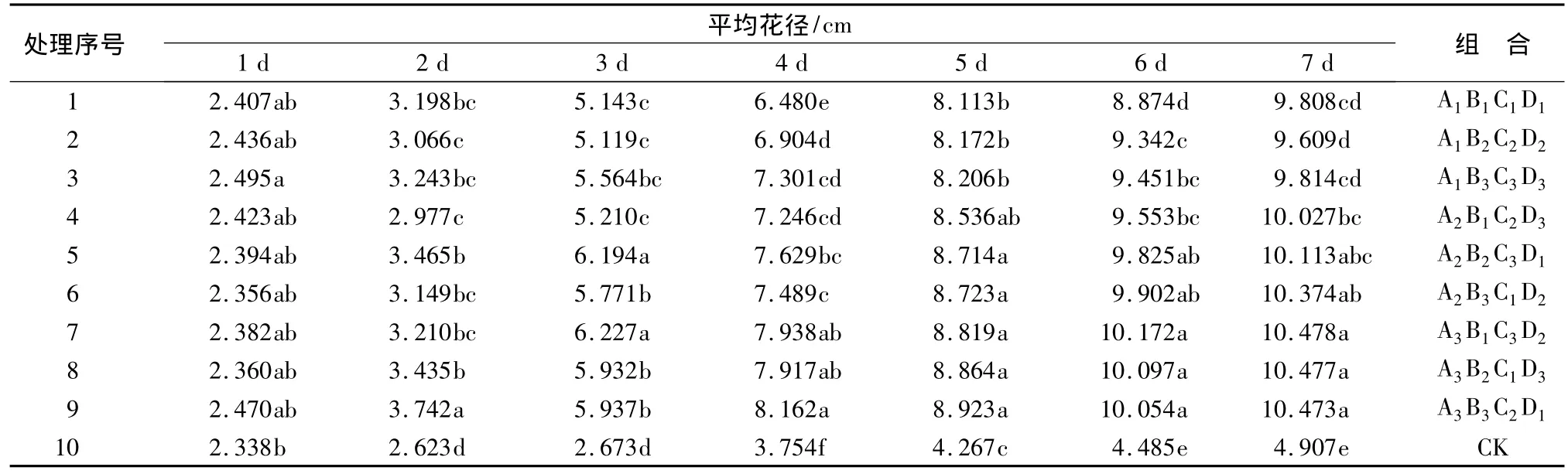
表4 不同催花液对花径大小的影响
2.2 验证试验
2.2.1 催花期间花蕾开放及花枝品质变化的观察
花蕾开放阶段观察:催花瓶插的第1 d,各个处理花蕾外部形态均无变化;催花第2 d,处理Ⅰ花蕾外1层舌状花瓣均展开,处理Ⅱ、Ⅲ只是部分展开,对照CK花蕾舌状花瓣没有展开的迹象;催花第3 d处理Ⅰ花蕾外2层舌状花瓣全部展开且开放,一致达到催花标准(阶段5),处理Ⅱ、Ⅲ部分花蕾外2层花瓣全部展开,对照CK直到催花第7 d花蕾的开放均不明显。
花枝的外部品质观察:从催花瓶插的第1 d到第7 d,处理Ⅰ、Ⅱ、Ⅲ花瓣和叶子饱满,色泽亮丽。对照CK在第4 d部分叶子发黄,第5 d部分叶子萎蔫,第6 d 80%的叶子失水干枯,失去观赏价值。从表5可知,催花第3 d,处理Ⅰ平均花径达到6.960 cm,均高于同一天的其他处理,且差异显著(P<0.05)。催花第7 d,与初始花径相比处理Ⅰ、Ⅱ、Ⅲ花径分别增加了 8.990、8.876、8.825 cm,而 CK 仅增加了2.550 cm,CK 和处理Ⅰ、Ⅱ、Ⅲ之间差异极显著(P<0.05),处理Ⅰ的平均花径最大,为 11.820 cm。由此验证了处理Ⅰ可以明显地促进花蕾的开放。
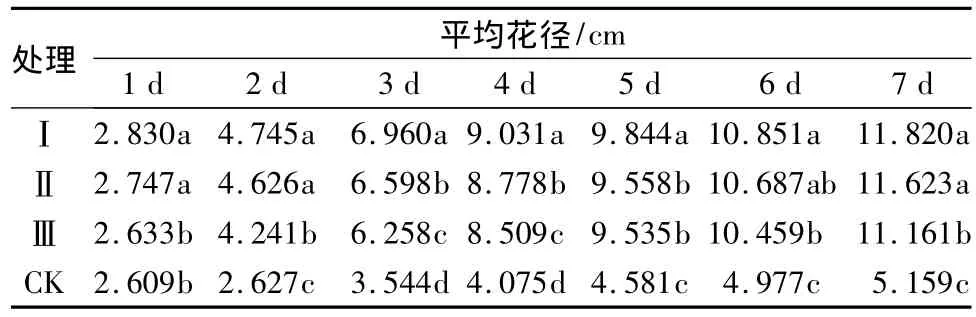
表5 不同催花液处理对切花菊平均花径大小的影响
2.2.2 不同催花液处理对切花菊水分吸收的影响
从图1A可知,CK从催花的第2 d水分平衡值开始下降,在第4 d虽然有所上升,但均低于其他处理,随后持续下降,达到负值,说明对照处理出现失水现象,这与观察结果相符合。处理Ⅰ、Ⅱ、Ⅲ在前4 d水分平衡值均处于上升趋势,且处理Ⅰ高于处理Ⅱ和处理Ⅲ,到了第5 d,3个处理都有所下降,处理Ⅰ在第6 d有所回升,随后呈下降趋势。催花第7 d,处理Ⅰ的水分平衡值最大。
从图1B可知,催花第1 d所有处理的花枝鲜质量变化率大致相同,随后处理Ⅰ、Ⅱ、Ⅲ在瓶插期间花枝鲜质量变化率均呈上升趋势,变化大致相同。CK在第4 d下降,但在第5 d有所上升,随后处于平稳状态,虽然对照处理有失水现象,但在催花期间并没有出现花枝鲜质量变化率0值。处理Ⅰ的花枝鲜质量变化率在催花期间一直高于其他处理。
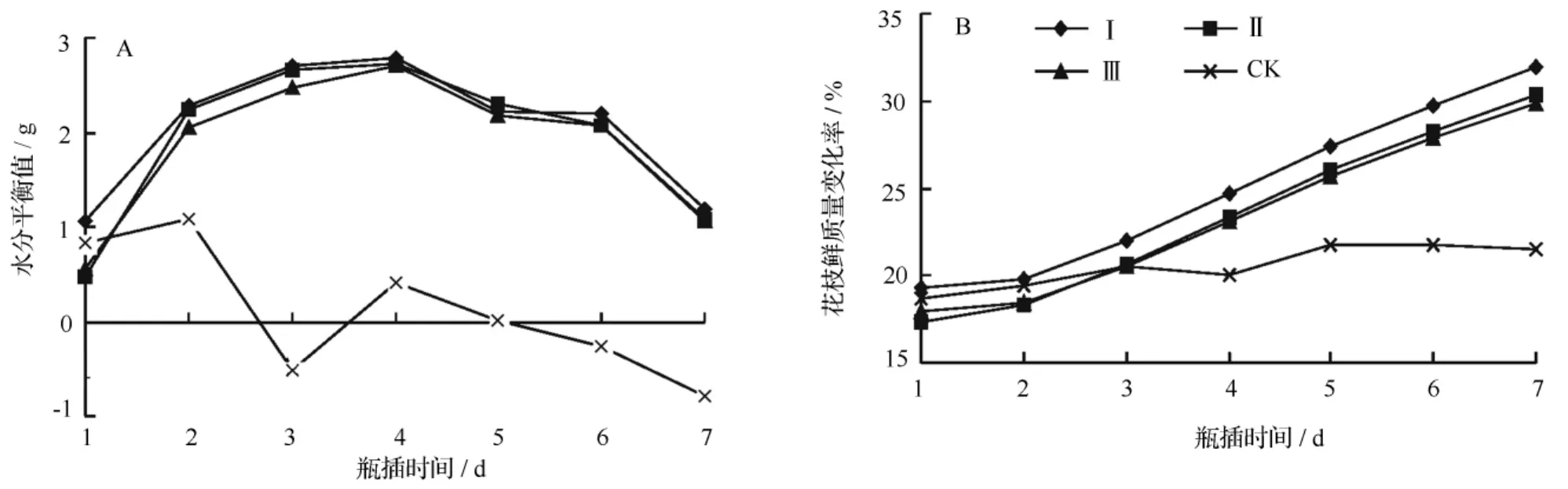
图1 不同催花液处理对切花菊水分平衡值和花枝鲜质量变化率的影响
2.2.3 不同催花液处理对切花菊可溶性蛋白质和可溶性糖质量分数的影响
从表6可知,所有催花液处理在瓶插期间蛋白质的质量分数变化均为先上升后下降趋势,处理Ⅰ、Ⅱ、Ⅲ在催花期间的蛋白质质量分数均高于对照CK,催花第1 d处理Ⅰ、Ⅱ、Ⅲ的蛋白质质量分数分别比 CK 高 4.463、2.798、1.222 mg·g-1,第 3 d 所有处理的蛋白质质量分数达到最大值,处理Ⅰ、Ⅱ、Ⅲ蛋白质质量分数相比,由大到小的顺序为处理Ⅰ、处理Ⅱ、处理Ⅲ,处理Ⅰ的蛋白质最大值为7.125 mg·g-1,与 CK 蛋白质最大值 3.973 mg·g-1相比差异极显著(P<0.05)。催花第7 d,相比于蛋白质质量分数最大值,处理Ⅰ、Ⅱ、Ⅲ蛋白质质量分数分别下降了47.75% 、55.15% 、49.95% ,CK下降了58.55%,处理Ⅰ和处理Ⅱ、Ⅲ之间差异显著,与CK差异极显著(P<0.05)。催花期间各个处理花瓣中可溶性糖的质量分数变化与蛋白质变化相似,处理Ⅰ每天的可溶性糖质量分数均高于其他处理,与CK相比均差异极显著(P<0.05),催花液处理Ⅰ提高了花瓣中可溶性蛋白质和可溶性糖的质量分数,从而促进花蕾的开放。
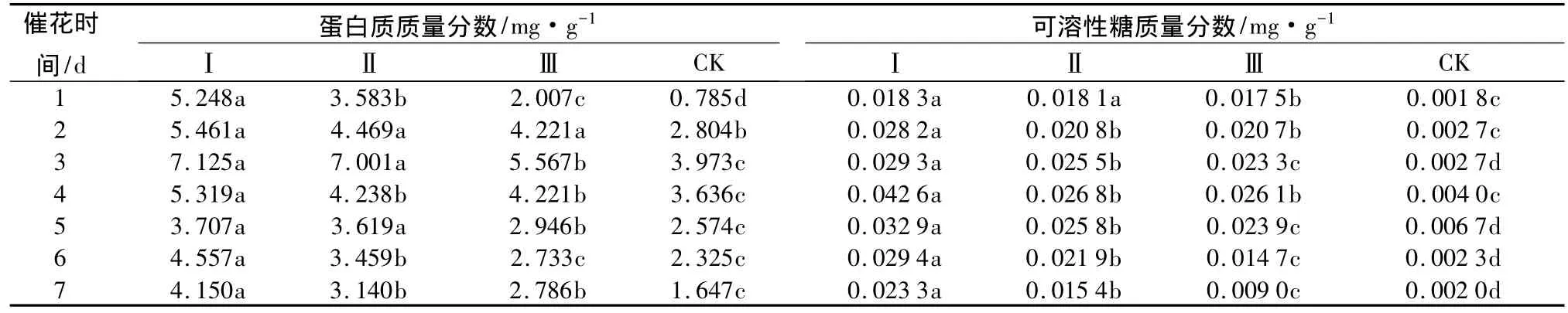
表6 不同催花液处理对切花菊可溶性蛋白质和可溶性糖质量分数的影响
2.2.4 不同催花液处理对切花菊酶活性的影响
过氧化物酶(POD)活性在植物的生长过程中是不断变化的,在植物的幼体发育阶段比较活跃,POD是自由基清除系统中重要的组成成分,它与SOD有协同的作用,可以清除植物体内的自由基[10],在植物体衰老时POD酶活性会降低。由图2A可知,催花期间CK在瓶插的第6 d活性下降,其他处理总体活性均高于对照(CK),处理Ⅰ、Ⅱ、Ⅲ的POD活性整体呈现上升趋势,此期间花蕾由未开放到开放,处于花蕾的发育阶段,通过观察记录得知,处理Ⅰ、Ⅱ、Ⅲ在催花期间无衰败迹象,对照CK在第5 d出现严重的失水、叶子发黄等衰老现象,第6 d其POD活性开始下降,处理Ⅰ、Ⅱ、Ⅲ在第7 d POD活性仍处于上升状态,此时为花蕾的盛花期。催花液处理Ⅰ能够保持较高的POD活性,清除花瓣中的自由基,促进花蕾开放和花期的延长。由图2B可知,处理Ⅰ、Ⅱ、Ⅲ的SOD活性总体都高于对照(CK),其中处理Ⅰ最明显,催花液处理Ⅰ可以明显提高并维持花瓣中SOD的活性,和POD起协同作用,有效地清除自由基。
3 结论与讨论
‘神马’切花菊在蕾期采后通过催花液处理进行催花,均比对照效果好。通过正交试验得出最佳催花液处理Ⅰ(A3B3C1D1)能更好地促进花蕾的开放,其中起主效作用的成分为因素A(蔗糖),这与已研究的唐菖蒲、百合等切花在催花剂中都被作为主要成分[2-4]相符。进一步的验证试验表明,与CK相比,最佳催花液处理Ⅰ可以明显地使花蕾在最短的时期内开放,达到催花标准,处理Ⅱ、Ⅲ虽然也能达到催花标准,但处理Ⅰ的花径比处理Ⅱ、Ⅲ大,另外,处理Ⅰ可以有效地抑制细菌、真菌生成,促进花枝对催花液的吸收,使花枝水分保持平衡吸收,防止出现失水状况,增加花瓣中蛋白质与可溶性糖的质量分数,这与此4种成分作为瓶插保鲜液时在切花百合中得到的研究结果相似[11]。在验证试验中,处理Ⅰ始终保持优良的观赏品质,叶子与花瓣没有衰败迹象,POD酶活性处于上升状态,同时SOD酶活性均高于其他处理,说明2种酶起到协同作用,可以有效地抑制自由基的活性。以上说明了最佳催花液处理Ⅰ在优先达到催花目的的同时,对花枝也有一定的保鲜作用。
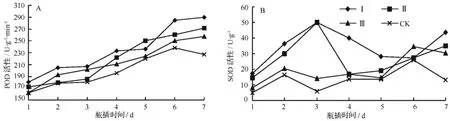
图2 不同催花液处理对切花菊POD和SOD活性的影响
切花保鲜液中的成分包括蔗糖、杀菌剂、有机酸成分、无机盐成分、植物生长调节剂等,各种成分的结合使得保鲜液具有催花、保鲜、提高观赏品质等作用。试验所用的催花液所含的4种成分均为保鲜常用的化学成分,其中蔗糖提供能量来源[12];8-羟基喹啉起杀菌作用,可以防止细菌、真菌侵蚀切花菊花枝[13];水杨酸作为有机酸在保鲜液中主要进行pH值的调节,对切花菊的保鲜起到促进花朵开放,切花吸水,增大花径[14]的作用,对月季切花[15]和梅花切花[16]等有类似保鲜作用;氯化钙有助于保持切花花枝水分平衡,可以增强切花菊的保水能力,减少蛋白质降解,提高SOD、POD活性,这与氯化钙应用于月季切花[17]和玫瑰切花[18]等保鲜的效果一致。蔗糖与8-羟基喹啉已在切花催花液研究中有所应用。而关于水杨酸与氯化钙在催花液中相应的研究与应用还未见到相关报道,最佳催花液处理Ⅰ中4种成分的质量浓度均为‘神马’切花菊蕾期催花的最佳质量浓度,4种成分以最佳质量浓度进行组合能够达到良好的催花效果。
对照处理在没有达到催花的标准时,已经出现失水萎蔫现象,失去了观赏价值,其他处理均能有效的达到催花效果。通过验证试验进一步确定催花液组合 A3B3C1D1(50 g·L-1蔗糖+300 mg·L-18-羟基喹啉+75 mg·L-1水杨酸+150 mg·L-1氯化钙)可以使‘神马’切花菊花蕾在采后3 d达到催花效果,符合市场需求的标准,比露地正常开花提前半个月左右,切花菊蕾期采后进行催花处理技术具有一定的市场应用价值。试验中的催花液处理采用了鲜切花保鲜液中常用的化学成分为主要成分,获得了切花菊蕾期采后催花液的最佳质量浓度,该催花液中不含植物生长调节剂成分,该研究结果为进一步应用植物生长调节剂以及其他新型物质作为催花液的研究提供了基础。
[1]徐刚.切花花蕾采收贮藏催花技术[J].中国农学通报,1994,10(2):49-50.
[2]刘雅莉,王飞,丁勤,等.催花保鲜剂对百合(Lilium)绿蕾催花保鲜生理的研究[J].西北农业大学学报,2000,28(6):89-95.
[3]刘雅莉,王飞,丁勤,等.催花液对唐菖蒲切花水分生理及衰老的影响[J].西北植物学报,2000,20(5):790-795.
[4]姜跃丽,武淑媛,叶桦.香石竹蕾期催花技术研究[J].安徽农业科学,2009,37(21):9941-9943.
[5]王少平,林紫玉,王小军.迎春切枝催花技术初探[J].山东林业科学,2005(5):21-22.
[6]王少平,杜旭明,王珊.连翘切枝催花及保鲜效果研究[J].河南科技学院学报,2005,33(1):47-49.
[7]陈林.日本菊花市场调查与分析[J].农村实用工程技术:温室园艺,2005(3):14-16.
[8]Preece T F,Wileox H J.Stage of growth of the chrysanthemum flower[J].Plant Pathology,1966,15:71-72.
[9]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[10]景红娟,罗红艺,李金枝.含水杨酸和苯甲酸的保鲜剂对非洲菊切花的生理作用[J].华中师范大学学报:自然科学版,2004,38(1):98-100.
[11]彭晓丽,饶景萍,张延龙.外源水杨酸对‘Prato’百合切花瓶插效果的影响[J].园艺学报,2007,34(1):189-192.
[12]谢黎飞,乔爱民.月季切花保鲜的研究进展[J].仲恺农业技术学院学报,1999,12(2):57-62.
[13]夏晶晖.8-羟基喹啉和柠檬酸对切花菊生理效应的影响[J].北方园艺,2010(9):194-195.
[14]郭碧花.SA对黄色菊花切花的保鲜效应研究[J].西华师范大学学报:自然科学版,2009,30(1):97-99.
[15]蔡永萍,聂凡,张鹤英,等.水杨酸对月季切花的保鲜效果和生理作用[J].园艺学报,2000,27(3):228-230.
[16]艾丽皎,王红娟,何定萍,等.水杨酸对梅花切花瓶插保鲜效果的影响[J].西南大学学报:自然科学版,2010,32(8):75-78.
[17]洪法水,赵海泉.CaCl2对月季切花衰老的影响[J].园艺学报,1999,26(1):62-64.
[18]邓显容,余前媛,王志清.玫瑰切花保鲜剂配方的筛选[J].西北农业学报,2008,17(5):330-332.
