槐树幼苗对光强的形态和生理适应1)
2012-09-18王满莲蒋运生梁惠凌柴胜丰王熊军
王满莲 蒋运生 韦 霄 梁惠凌 柴胜丰 王熊军
(广西壮族自治区中国科学院广西植物研究所,桂林,541006)
光是调控植物生长发育的重要因子,也是限制植物生存和生长的主要环境因素,对植物的影响取决于光照强度和光谱成分。植物对不同的光强会做出不同的反应,有关不同光环境下植物的生物量分配、形态特征、光合特性、生长速率的研究已有不少积累[1-2]。一般认为,一旦光强成为植物生长的限制,植物会把较多的生物量分配给叶片,增加光能的捕获和吸收,表现为较高的叶生物量比,同时降低暗呼吸速率和光补偿点以减少能量消耗[3-4]。阳生植物由于有充足的光照辐射满足生长需求,而营养和水分则可能成为植物生长的主要限制因素。因而,为补偿蒸腾作用造成的水分丢失,较多的生物量投向根部,同时通过提高自身潜在的光合能力,增大光补偿点等来适应光强的升高[5]。
槐树(Sophora japonica L.)又名国槐、中国槐、白槐等,为蝶形花科槐属多年生落叶乔木,因其耐旱、耐寒、耐盐碱及适应能力强,具有较高的药用价值,被作为园林绿化和药用树种广泛栽培[6-7]。关于槐树的繁殖与栽培已有大量研究[8-9],但关于光强对槐树当年生播种苗生长和光合特性的影响未见报道。本文比较研究了不同遮阴程度下当年生槐树幼苗的形态结构、生物量分配、光合色素含量和光合特性的差异,探讨槐树幼苗生长和光合特性对生长环境光强变化的响应和适应机制,进而为槐树高产优质栽培和天然更新与自然扩散的研究提供科学依据。
1 材料与方法
试验地设在桂林雁山广西植物研究所试验场,该地自然概况的描述见文献[10]。
2010年3月5日,将槐树种子播种于苗床,幼苗株高均为15 cm左右时(3月31日),选择大小一致的幼苗移栽于装10 L菜园土的花盆中。用黑色尼龙网遮阴,建立相对光强(IR)分别为15%、30%、50%和100%(不遮阴)的遮阴棚4个(简记 IR15、IR30、IR50、IR100)。植株恢复生长后(移栽2周后)进行光照控制试验,每个处理15盆,共60盆。试验期间加强肥水管理,每月施含氮磷钾各15%的芭田复合肥一次(深圳市芭田生态工程股份有限公司生产),随时防治病虫害。试验期间每天将盆随机摆放,以保证不同光处理内各盆获得的光照一致。
约5个月以后(9月1日),选植株主干顶部的成熟叶片,用Li—6400便携式光合作用系统(LI—COR,Lincoln,Nebraska,USA)进行光合测定,每个处理4株,每株1个叶片,空间取向和角度尽量一致(所有叶片都为西向且基本与地面平行)。由于槐树叶片呈裂片状,只能选取叶片顶端光合仪叶室能够容纳的部分进行测定。测定后采下测定部分,用Li—3000型叶面积仪测定叶面积,把面积输入光合仪重新换算光合数据。不同光强下槐树叶片的光合作用—光响应曲线(Pn—PF,D)的测定:测量前将待测叶片在1500 μmol·m-2·s-1光强下诱导30 min(仪器自带的红蓝光源),以充分活化光合系统。使用开放气路,空气流速为0.5 L·min-1,叶片温度25℃,CO2摩尔分数(用 CO2钢瓶控制)400 μmol·mol-1。设定的光强梯度为 1800、1500、1200、1000、800、600、400、200、100、50、20、10、0 μmol·m-2·s-1,测定时每一光强下停留3 min。依据方程Pn=Pmax(1-Coе-ΦPF,D/Pmax)拟合 Pn—PF,D曲线[11]。其中:Pmax为最大净光合速率;Φ为弱光下光化学量子效率;Co为度量弱光下净光合速率趋于0的指标。通过适合性检验,拟合效果良好,然后计算光补偿点(LC,P):LC,P=Pmaxln(Co)/Φ。假定 Pn达到 Pmax的99%的 PF,D为光饱和点(LS,P),则 LS,P=Pmaxln(100Co)/Φ。表观量子效率(AQ,Y)由光响应曲线光强低于150 μmol·m-2·s-1点的线性回归斜率表示[12]。
取光合测定叶片,按文献[13]的方法测定叶绿素和类胡萝卜素含量,并计算单位干叶质量的光合色素质量分数。9月12日,各处理选取8株测定株高、地径(土迹处的直径)、整株叶面积、叶干质量、支持结构干质量和根干质量。其中:株高用卷尺(精确度0.1 cm)测定,地径用游标卡尺(精确度0.01 mm)测量,叶面积用Li—3000型叶面积仪测定。称取的质量部分在80℃条件下烘48 h,电子天平(精确度0.01 g)称量。求出如下参数[5,14]:根生物量比(根质量/植株总质量);叶生物量比(叶质量/植株总质量);支持结构生物量比(支持结构质量/植株总质量);叶面积比(总叶面积/植株总质量);叶根比(总叶面积/总根质量);根冠比(根质量/地上部分质量);比叶面积(总叶面积/总叶质量)。
用独立样本One-ANOVO分析不同光强下槐树各参数的差异,所用软件为 SPSS13.0(SPSS Inc.,USA)。
2 结果与分析
2.1 光强对槐树幼苗植株大小的影响
在IR30~IR100范围内,不同光强下槐树幼苗的地径差异不显著,但均显著大于IR15下的值。槐树幼苗株高对环境光强的变化反应敏感,随着光强的升高,槐树幼苗的株高显著降低(表1)。

表1 不同光强下槐树幼苗的地径和株高
2.2 光强对槐树幼苗生物量及其相关变量的影响
如表2所示,在IR30~IR100范围内,不同光强槐树幼苗的总生物量差异不显著,但均显著大于IR15下的值(图2A)。相对IR50而言,IR15下槐树幼苗的总生物量积累降低了16%。槐树幼苗的生物量分配显著受到光强变化的影响,随着光强的增大,槐树幼苗的根生物量比与根冠比均显著增大,但在低光强范围内(IR15~IR50)增速较缓,随后迅速增大;在IR15与IR30光强下,槐树幼苗的支持结构生物量比差异不显著,但超过该光强范围后,支持结构生物量比则随着光强的增大而显著降低;除了IR30与IR50光强下槐树幼苗的叶生物量比差异不显著外,总体而言,叶生物量比随着光强的增大而显著降低。

表2 不同光强下槐树幼苗的生物量及其分配
2.3 光强对槐树幼苗叶面积及其相关变量的影响
随着光强的增大,槐树幼苗的总叶面积、比叶面积、叶面积比和叶根比均显著降低(表3),强光下单位总生物量和单位根生物量所承载的叶面积明显减少,叶片变厚。
2.4 光强对槐树幼苗光响应相关参数的影响
除了IR15、IR30下槐树幼苗的光补偿点差异不显著外,植株最大净光合速率、光饱和点和光补偿点均随光强的增大而显著增大;IR30~IR100范围内,槐树幼苗的表观量子效率差异不显著,但均显著低于IR15下的值(表4)。

表3 不同光强下槐树幼苗的叶面积及其相关变量
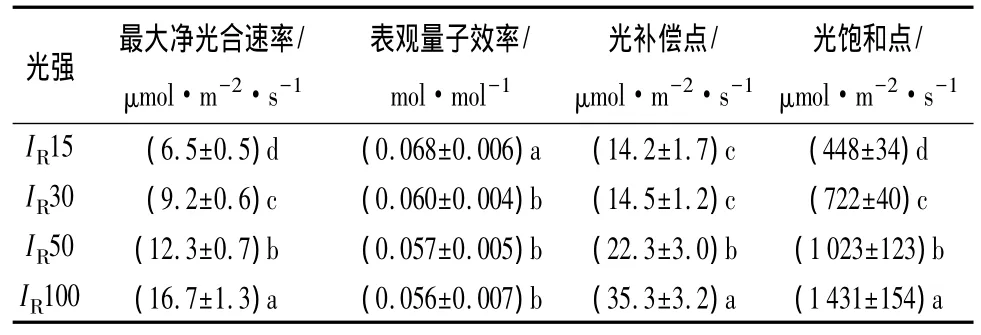
表4 不同光强下槐树幼苗的光合—光响应参数
2.5 光强对槐树幼苗光合色素质量分数的影响
总体而言,槐树幼苗的总叶绿素质量分数和类胡萝卜素质量分数均随着光强的增大而显著降低(除IR30与IR50差异不显著外);叶绿素a/b随着光强的增大而显著增大,IR30~IR100光强范围内,不同光强类胡萝卜素/叶绿素差异不显著,但均显著大于IR15下的值(表5)。

表5 不同光强下槐树幼苗光合色素的质量分数
3 结论与讨论
槐树幼苗对环境光强变化表现出较强的适应性。在相对光强IR30~IR100范围内,槐树幼苗的总生物量积累无显著差异。相对光强低于30%以后,槐树幼苗的总生物量显著降低,但IR15光强下的总生物量积累相对IR50光强而言仅降低了16%(表1),表明槐树幼苗对光强的适应范围较广,较低的光强不利于其生长,但仍能维持较高的生物量积累。槐树幼苗在高光强下和低光强下的适应策略不同。低光强下,植株主要是通过增加捕光组分的投入比,表现为较高的叶生物量投入(表2),增大比叶面积、叶面积比和叶根比(表3),导致植株总叶面积增大,从而提高捕光能力;为支持地上部分的质量增加,支持结构生物量也随光强的降低而增大;同时,植株高度随光强的降低升高,这可使植株在野外条件下尽快摆脱林下低光环境[15]。在高光强下,比叶面积减小,叶片变小、变厚,总叶面积变小,叶片因此而具有相对较小的边界层阻力,空气对流相对较高,以最小的蒸腾速率,达到最大散热的效果,提高水分利用效率,同时降低蒸腾减少了水分丢失[14]。与此同时,高光强下植株会通过提高根生物量比和根冠比、降低叶生物量比和叶根比而保持水分吸收和蒸腾的平衡,保证了体内正常代谢所需的水分。高光强下的植株通过降低捕光系统的投入,一是可以避免过剩光能造成的光抑制和光破坏,二是调节水分供需的平衡。
由于光合作用决定了植物吸收能量的多少和有机物积累的数量,是其它生理过程和生命活动的基础,与植物生长、发育和存活密切相关。对于同一种植物,在高光环境中,植株的光饱和点和最大净光合速率较高;在低光强下,植物的同化速率受到光强的限制,表现为较低的光补偿点和最大净光合速率[16]。随光强的增大,槐树幼苗的最大净光合速率、光饱和点和光补偿点均显著增大(表4)。强光下,植株光合能力较强,光饱和点高,能够利用较高的光强;弱光下,槐树幼苗的光补偿点较低,量子效率较高,使其仍能维持较高的净光合积累,对弱光也表现出一定的适应性,也就是说,槐树幼苗在光合特性方面对光强的适应性也较强。
叶绿素是光合作用的光敏催化剂,与光合作用密切相关,其含量和比例是植物适应和利用环境因子的重要指标[17]。植物对叶绿素a/b的调节是提高光合能力和调节光能捕获的一种重要的途径。弱光下叶绿素a/b的降低可增加光能吸收,强光下叶绿素a/b较高,可降低光能吸收减少光抑制,有利于光合能力的提高[4]。槐树幼苗在光合色素方面对光环境的变化表现出较强的适应性。弱光下,通过提高总叶绿素质量分数和降低叶绿素a/b增加光能吸收,以减少光能不足的限制。强光下则相反,降低总叶绿素质量分数和提高叶绿素a/b,减少了光能吸收和降低了光抑制。类胡萝卜素是活性氧的有效猝灭剂,同时,其中的叶黄素成分又与热耗散能力直接相关[17]。尽管槐树幼苗的类胡萝卜素质量分数随光强的增大而降低,但高光强下类胡萝卜素/叶绿素显著升高,表明在强光下的保护能力和抵抗光胁迫的能力加强了,也说明在低光强下用于防御光破坏的类胡萝卜素减少,用于吸收光能的叶绿素增加。
综上所述,槐树幼苗在形态与生理上通过调节同化能力、水分平衡能力和光能截获面积来适应光环境的变化,有利于植株对各种资源的吸收和利用并达到最优化,有利它们适应环境的变化。因此,在第一年的生长季,在光作为唯一环境胁迫因子的情况下,槐树幼苗在光强IR30~IR100范围内的总生物量积累无显著差异。鉴于槐树幼苗对光照强度的反应特点,在造林时可以将其栽植于空阔地上,也可以与其它树种进行混交栽植,或在林分郁闭度较低的林下栽植。
[1]Poorter H,Nagel O.The role of biomass allocation in the growth response of plant to different levels of light,CO2,nutrients and water:a quantitative review[J].Australian Journal of Plant Physiology,2000,27(12):595-607.
[2]何维明,钟章成.攀援植物绞股蓝幼苗对光照强度的形态和生长反应[J].植物生态学报,2000,24(3):375-378.
[3]Boardman N K.Comparative photosynthesis of sun and shade plants[J].Annual Review of Plant Physiology,1977,28:355-377.
[4]徐飞,郭卫华,徐伟红,等.不同光环境对麻栎和刺槐幼苗生长和光合特征的影响[J].生态学报,2010,30(12):3098-3107.
[5]Poorter L.Light-dependent changes in biomass allocation and their importance for growth of rain forest tree species[J].Functional Ecology,2001,15(1):113-123.
[6]王喆之,胡正海.槐树组织细胞培养的研究[J].西北植物学报,1997,17(5):1-6.
[7]孙禄.槐树的栽培及利用[J].特种经济动植物,1998(6):24-25.
[8]李幼平,吴菲.金枝槐高接试验[J].北方园艺,2007(2):124-126.
[9]裴仙娥.乡土树种国槐变种的繁殖与应用[J].宁夏农林科技,2005(3):56.
[10]韦霄,李锋,傅秀红,等.黄花蒿类型引种试验[J].广西科学院学报,1998,14(1):28-31.
[11]Bassman J H,Zwier J C.Gas exchange characteristics of Populus trichocarpa,Populus deltoides and Populus trichocarpa×P.deltoides clones[J].Tree Physiology,1991,8(2):145-159.
[12]李新国,许大全,孟庆伟.银杏叶片光合作用对强光的响应[J].植物生理学报,1998,24(4):354-360.
[13]李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2001,134-137.
[14]Poorter L.Growth responses of 15 rain-forest tree species to a light gradient:the relative importance of morphological and physiological traits[J].Functional Ecology,1999,13(3):396-410.
[15]陶建平,钟章成.光照对苦瓜形态可塑性及生物量配置的影响[J].应用生态学报,2003,14(3):336-340.
[16]刘悦秋,孙向阳,王勇,等.遮荫对异株荨麻光合特性和荧光参数的影响[J].生态学报,2007,27(8):3457-3464.
[17]王俊峰,冯玉龙,李志.飞机草和兰花菊三七光合作用对生长光强的适应[J].植物生理与分子生物学学报,2003,29(6):542-548.
