头孢替坦二钠的体外抗菌活性研究
2012-09-18杨信怡胡辛欣娄人慧刘京芳李聪然张伟新宋坤改母立新陈慧贞游雪甫
杨信怡 胡辛欣 娄人慧 刘京芳 李聪然 张伟新 宋坤改 母立新 陈慧贞 游雪甫*
(中国医学科学院 北京协和医学院 医药生物技术研究所,北京 100050)
头孢替坦,别名双硫唑甲氧头孢菌素,为半合成头霉素类衍生物,药用形式为二钠盐,属注射用二代头孢菌素。头孢替坦二钠最早由日本山之内制药株式会社开发,20世纪80年代在日本上市,后授权瑞典阿斯利康在日本以外的国家上市,国际上注册的商品名有Cefotan和Apatef等[1]。2007年,美国Abraxis制药公司的头孢替坦二钠注射液(仿制药)获FDA批准在美上市。目前,该品种在最新的日本药局方16版和美国药典34版中均有收录,因在我国尚未上市,中国药典无收录。头孢替坦二钠分子量为619.59(C17H15N7Na2O8S4),血浆蛋白结合率高,半衰期长,抗菌谱广,对革兰阴性菌和厌氧菌抗菌活性强,对革兰阳性菌作用较弱,对质粒或染色体介导的β-内酰胺酶十分稳定[2]。随着该品种专利到期,部分国内制药企业开始仿制并进入临床前评价阶段。本研究以2008~2009年从北京地区各医院分离的20种共663株临床常见病原菌为对象,以四种头孢菌素为对照药,对一种国产头孢替坦二钠的体外抗菌活性进行评价。
1 材料与方法
1.1 药物及配制
头孢替坦二钠,批号YJ090701,重庆市庆余堂制药有限公司生产。对照药包括:头孢美唑钠(二代头孢),批号JPA0401,日本第一三共普乐发株式会社生产;头孢唑啉钠(一代头孢),批号K0905556,华北制药股份有限公司生产;头孢哌酮钠(三代头孢),批号0909062,丽珠集团丽珠制药厂生产;盐酸头孢吡肟(四代头孢),批号09050211,悦康药业集团有限公司生产。药物配制时按各自实际活性药物计算。
1.2 培养基和试剂
CAMH肉汤、脑心浸液培养基均为美国BD公司产品。MH琼脂、营养肉汤、中国蓝琼脂培养基均购自中国药品生物制品检定所。
1.3 细菌
受试菌株主要为实验室保存典型菌株及2008-2009年从北京地区医院收集的20种共663株临床分离菌(其中产β-内酰胺酶菌株535株),革兰阳性菌有:金黄色葡萄球菌37株(34株产酶,MSSA 21株、MRSA 16株)、表皮葡萄球菌35株(8株产酶,MSSE 18株、MRSE 17株)、化脓链球菌18株(均不产酶)、肺炎链球菌19株(均不产酶,耐青霉素肺炎链球菌PRSP 8株)、粪肠球菌18株(1株产酶)和屎肠球菌19株(均不产酶)。革兰阴性菌有:大肠埃希菌55株(均产酶,产ESBLs大肠埃希菌26株)、肺炎克雷伯杆菌56株(均产酶,产ESBLs肺炎克雷伯杆菌26株)、铜绿假单胞菌37株(均产酶)、鲍曼不动杆菌37株(均产酶)、奇异变形杆菌37株(22株产酶)、普通变形杆菌37株(36株产酶)、阴沟肠杆菌37株(均产酶)、产气肠杆菌37株(均产酶)、聚团肠杆菌17株(16株产酶)、弗劳地枸橼酸杆菌37株(均产酶)、异型枸橼酸杆菌37株(36株产酶)、雷极普鲁菲登杆菌19株(均产酶)、摩根摩根氏菌37株(33株产酶)和粘质沙雷氏菌37株(均产酶)。细菌β-内酰胺酶采用硝噻吩纸片鉴定,细菌超广谱β-内酰胺酶(ESBLs)鉴定按照CLSI推荐方法进行。
质控菌选用金黄色葡萄球菌ATCC29213、肺炎链球菌ATCC49619、粪肠球菌ATCC29212、大肠埃希菌ATCC25922、ATCC35218(产β-内酰胺酶)、肺炎克雷伯杆菌ATCC700603(产ESBLs)、铜绿假单胞菌ATCC27853。质控菌MIC均在CLSI参考范围内。
1.4 仪器
多点接种器为英国Denley公司产品;自动分装器为美国Oxford公司产品;二氧化碳培养箱为美国Forma公司产品;超低温冰箱为日本Sanyo公司产品;IKA MS2型液体涡漩混合器为广州仪科实验室技术公司产品。
1.5 最低抑菌浓度(MIC)测定
参照CLSI推荐方法,采用平皿二倍稀释法和多点接种器进行MIC测定[3]。药物用CAMH肉汤二倍稀释成各种所需浓度,分别加适量到平皿中,MH琼脂培养基溶化后定量注入含药液的平皿内混匀,药物的终浓度分别为0.03,0.06,0.125,0.25…128 μg/mL,肺炎链球菌、化脓链球菌的培养基中含5%脱纤维羊血。受试菌用营养肉汤或脑心浸液隔夜增菌,试验时,菌液适当稀释,多点接种器接种试验菌(接种量为104 CFU/点)于含药琼脂表面,干燥后置35℃恒温培养18~24h后观察结果,无菌落生长的平皿中所含药物的最小浓度即为MIC。
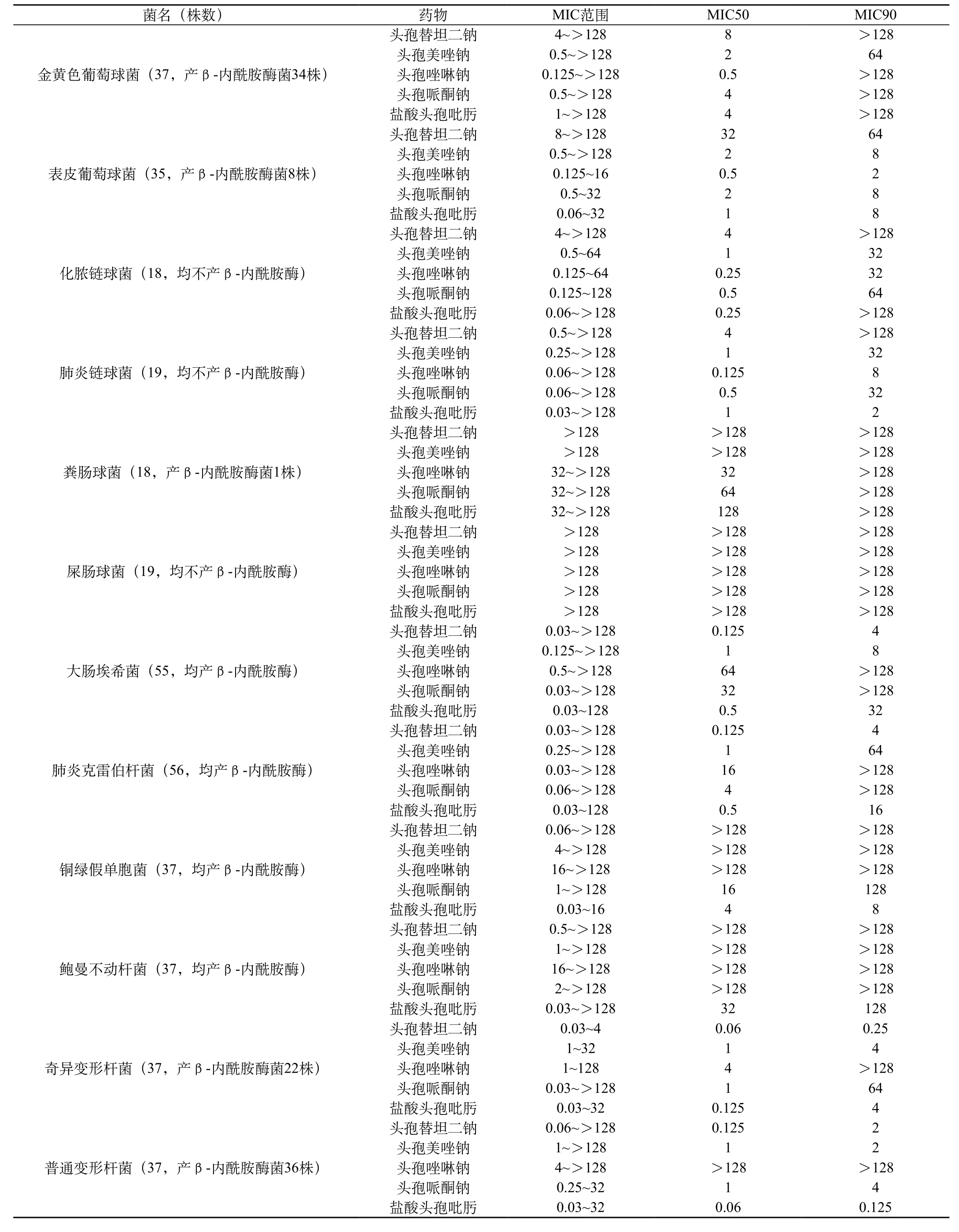
表1 头孢替坦二钠及其对照药对663株临床分离菌的MIC测定(μg/mL)
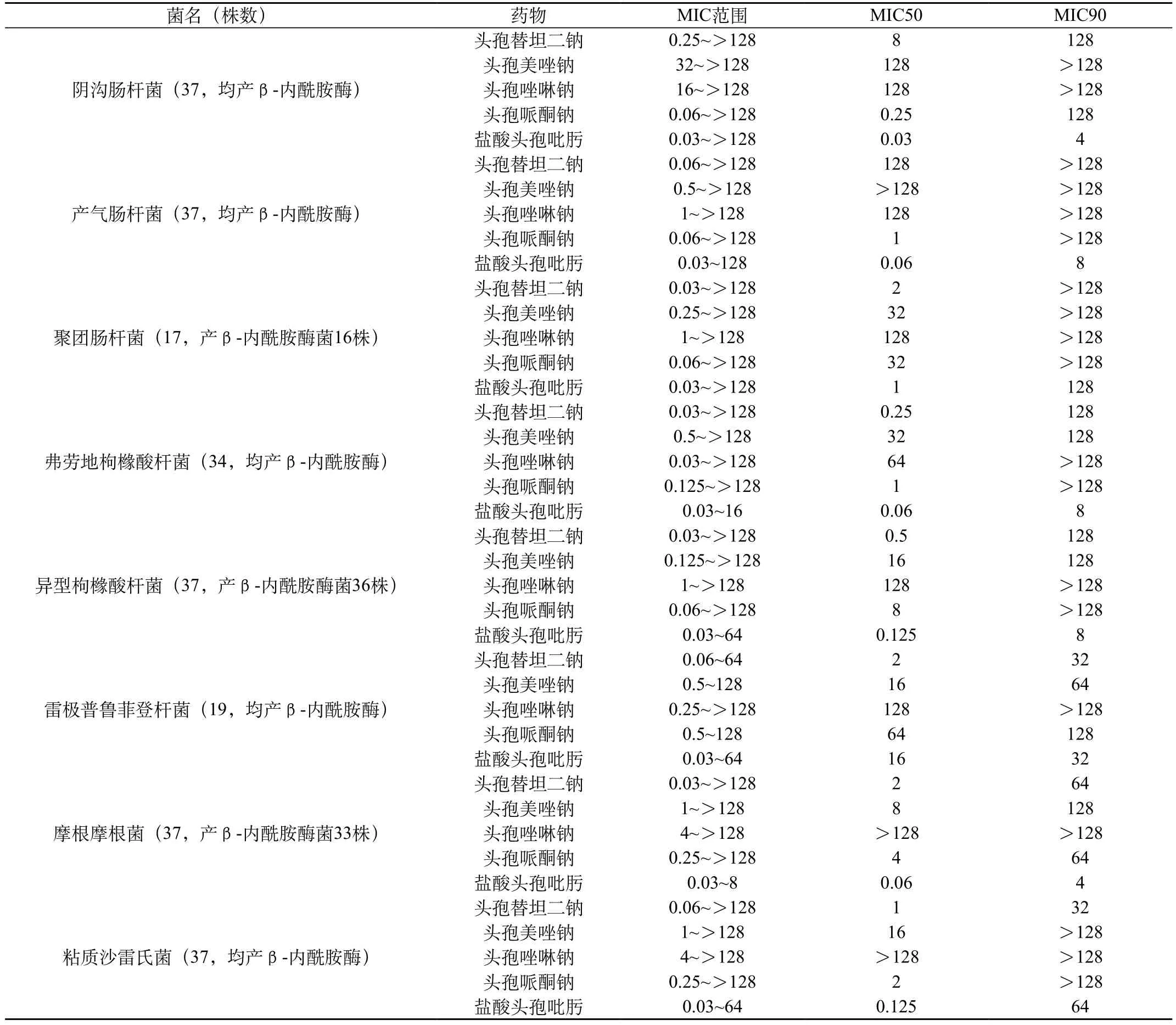
续表1
2 结 果
试验结果表明,头孢替坦二钠为广谱抗菌活性,对663株临床分离菌具有不同程度的抗菌作用,对517株革兰阴性菌普遍具有较强的抗菌作用,对146株革兰阳性菌的抗菌活性较弱。对耐甲氧西林葡萄球菌抗菌活性弱,而对产ESBLs的大肠埃希菌及肺炎克雷伯菌抗菌作用较强,结果见表1~表3。
头孢替坦二钠对37株金黄色葡萄球菌的抗菌活性较弱,MIC50、MIC90值分别为8μg/mL、>128μg/mL,抗菌活性弱于四种对照药。头孢替坦二钠对21株MSSA有一定抗菌作用,MIC50、MIC90值均为8μg/mL,弱于四种对照药;对16株MRSA的抗菌作用弱,MIC50、MIC90值均>128 μg/mL。
头孢替坦二钠对35株表皮葡萄球菌的抗菌活性较弱,MIC50、MIC90值分别为32μg/mL、64μg/mL,对18株MSSE和17株MRSE的MIC50、MIC90值分别为16μg/mL、32μg/mL和32μg/mL、128μg/mL,抗菌活性弱于四种对照药。
头孢替坦二钠对18株化脓链球菌、19株肺炎链球菌有一定抗菌作用,MIC50值均为4μg/mL,抗菌活性弱于四种对照药。头孢替坦二钠对18株粪肠球菌、19株屎肠球菌的抗菌活性弱,MIC50、MIC90值均>128μg/mL。
头孢替坦二钠对55株大肠埃希菌、56株肺炎克雷伯杆菌的抗菌作用强,MIC50、MIC90值均为0.125μg/mL、4μg/mL,抗菌活性优于四种对照药。头孢替坦二钠对26株产ESBLs大肠埃希菌和26株产ESBLs肺炎克雷伯杆菌也有较好抗菌作用,MIC50、MIC90值分别为1.4μg/mL和0.5μg/mL、8μg/mL,抗菌活性强于四种对照药。
头孢替坦二钠对37株奇异变形杆菌的抗菌活性强,MIC50、MIC90值分别为0.06μg/mL、0.25μg/mL,抗菌活性强于盐酸头孢吡肟和头孢美唑钠,明显优于头孢唑啉钠和头孢哌酮钠;头孢替坦二钠对37株普通变形杆菌的抗菌活性较强,MIC50、MIC90值分别为0.125μg/mL、2μg/mL,抗菌活性稍弱于盐酸头孢吡肟,优或远优于另三种对照药。 头孢替坦二钠对37株阴沟肠杆菌的抗菌活性较强,MIC50、MIC90值分别为8μg/mL、128μg/mL,抗菌活性弱于头孢哌酮钠和盐酸头孢吡肟,明显优于头孢美唑钠和头孢唑啉钠。
头孢替坦二钠对17株聚团肠杆菌的抗菌活性较强,MIC50、MIC90值分别为2μg/mL、>128μg/mL,抗菌活性与盐酸头孢吡肟相近,优于另三种对照药。
头孢替坦二钠对37株弗劳地枸橼酸杆菌的抗菌活性较强,MIC50、MIC90值分别为0.25μg/mL、128μg/mL,抗菌活性稍弱于盐酸头孢吡肟,优于另三种对照药。
头孢替坦二钠对37株异型枸橼酸杆菌的抗菌活性较强,MIC50、MIC90值分别为0.5μg/mL、128μg/mL,抗菌活性稍弱于盐酸头孢吡肟,强于另三种对照药。
头孢替坦二钠对19株雷极普鲁菲登杆菌的抗菌活较强,MIC50、MIC90值分别为2μg/mL、32μg/mL,抗菌活性优于盐酸头孢吡肟和头孢美唑钠,明显优于头孢哌酮钠和头孢唑啉钠。

表2 头孢替坦二钠及其对照药对甲氧西林敏感/耐药葡萄球菌的MIC测定(μg/mL)
头孢替坦二钠对37株摩根摩根氏菌抗菌活性较强,MIC50、MIC90值分别为2μg/mL、64μg/mL,抗菌活性和头孢哌酮钠相近,强于头孢唑啉钠和头孢美唑钠,弱于盐酸头孢吡肟。
头孢替坦二钠对37株粘质沙雷氏菌的抗菌活性较强,MIC50、MIC90值分别为1μg/mL、32μg/mL,抗菌活性稍弱于盐酸头孢吡肟,优于另三种对照药。
头孢替坦二钠对37株铜绿假单胞菌、37株鲍曼不动杆菌、37株产气肠杆菌的抗菌活性弱,MIC50、MIC90值均>128μg/mL。
3 讨 论
与已有报道相似,MIC数据显示头孢替坦二钠对革兰阴性菌的抗菌作用较强,对革兰阳性菌的抗菌作用较弱[1]。革兰阴性菌中,头孢替坦二钠除对铜绿假单胞菌、产气肠杆菌和鲍曼不动杆菌抗菌活性较弱外,对其余受试革兰阴性菌均具有较高的抗菌活性。不同细菌的MIC分布情况,可一定程度上为该药今后的临床抗感染选择提供参考。
与对照药比较,头孢替坦二钠对多数受试革兰阴性菌的抗菌活性优于对照的一、二、三代头孢,但稍弱于四代头孢盐酸头孢吡肟,其抗革兰阴性菌的总体表现在受试的头孢菌素中颇为突出。头孢替坦二钠对革兰阳性菌的体外抗菌活性总体较弱,弱于4种对照药。对于MRSA和MRSE,因耐药机制由β-内酰胺类低亲和力的PBP2a介导,所以受试的五种头孢菌素均无明显抗菌活性[4]。
总之,本研究中,头孢替坦二钠对各种产ESBLs 革兰阴性菌的良好抗菌活性令人印象深刻,值得进一步评价其体外、体内抗菌效应,期为我国临床抗感染领域提供又一种用药选择。
[1] Ward A,Richards DM.Cefotetan.A review of its antibacterial activity,pharmacokinetic properties and therapeutic use[J].Drugs.1985,30 (5):382-426.
[2] Sirot D.Extended-spectrum plasmid-mediated beta-lactamases[J].J Antimicrob Chemother,1995,36 (Suppl A):19-34.
[3] CLSI.Methodsfor Dilution Antimicrobial Susceptibility Test for Bacteria That Grow Aerobically: Approved Standard M7-A7.Wayne,Pennsylvania 19087-1898 USA[R].2007.
[4] Truesdell SE,Zurenko GE,Laborde AL.Interaction of cephalosporins with penicillin-binding proteins of methicillin-resistant Staphylococcus aureus[J].J Antimicrob Chemother,1989,23 (Suppl D):13-19.
