小鼠体内生精系统重塑模型的建立
2012-09-18关欣李树春狄茜缪时英王琳芳
关欣 李树春 狄茜 缪时英 王琳芳
小鼠体内生精系统重塑模型的建立
关欣 李树春 狄茜 缪时英 王琳芳
目的建立小鼠体内生精系统重塑模型,为在体研究生精相关基因的功能提供技术方法。方法以白消安(busulfan)40mg/kg腹腔注射后3~5周雄性小鼠为受体小鼠,以稳定表达GFP的精原细胞系GC-1spg为供体细胞,移植入受体小鼠睾丸曲细精管中,观察供体细胞移植后在受体小鼠曲细精管中的定位、增殖和分化情况。结果成功建立小鼠睾丸曲细精管显微注射技术平台,并发现精原细胞系GC-1spg移植回体内环境后,不但能够在受体小鼠曲细精管生存,而且能够定位于相当于精原干细胞所处的niche中增殖、分化,并产生成熟精子。结论我们应用精原细胞系GC-1spg成功地建立了小鼠体内生精系统重塑模型。
精原细胞系精子发生细胞移植
2.实验方法:(1)小鼠睾丸曲细精管显微注射针的制作:拉制显微注射针,针的尖端不要过长,过渡坡度不要过小,以防止注射时断针。将拉制好的注射针尖端断成相应的口径,注射针的尖端外径要求在40~60μm。将断好的针尖端磨制成一定的角度,以方便注射的操作。(2)手术方法和取材方法:采用乙醚吸入的方式进行麻醉,麻醉过程中持续给药,在麻醉初期小鼠会间歇性抽搐,之后会很平静地进入深度麻醉。这时要时刻观察小鼠状态,主要是看小鼠心脏起伏是否规律,以防乙醚过量导致小鼠死亡。将麻醉后的小鼠仰卧于操作台上,固定四肢,用碘酒对腹部皮肤进行消毒,在腹部正中切口,约1.0~1.5cm,用小镊子轻轻夹出一侧睾丸。以小镊子固定睾丸,使睾丸白膜保持一定的张力。在持针器上固定好玻璃穿刺针,Eppendorf压力注射器与持针器相连接,通过Eppendorf显微注射器吸入要注射的细胞悬液备用,在解剖显微镜下将穿刺针刺入睾网,细胞悬液通过睾网以随机的路径充盈曲细精管。注射完毕后将睾丸放回腹腔中靠近阴囊的位置。另一侧睾丸作为对照组。缝合手术切口,缝合处再次以碘酒消毒,小鼠移回笼中继续饲养。因为GC-1细胞移植的受体小鼠需要有尽量少或者根本没有内源性生精干细胞,所以可采用白消安(busulfan)去除内源生精干细胞。将白消安配制成2%的DMSO溶液,剂量:40mg/kg,取4~6周龄雄性小鼠进行腹腔注射。完成注射后4周可以进行细胞移植。
结果
1.建立小鼠睾丸曲细精管显微注射技术平台[1]:完成显微注射后,在镜下可观察到含有台盼兰的稳定表达GFP的GC-1 spg细胞注射液沿着曲细精管的走向充盈。证明细胞悬液成功注射进小鼠睾丸的曲细精管内(图1)。

图1 通过睾网注射后睾丸表面的曲细精管充满注射液体
2.GC-1 spg细胞移植的受体小鼠模型的鉴定:为了提高移植成功率,首先清除受体小鼠内源的生精细胞。使用busulfan处理供体小鼠破坏内源生精细胞,在busulfan处理4周后取小鼠睾丸固定、切片并进行HE染色。镜下观察正常小鼠睾丸曲细精管可见各级生精细胞,管腔内有大量成熟精子;busulfan处理组多数曲细精管内生精细胞缺失,而Sertoli细胞间形成较大空隙,仅仅在曲细精管极少数的地方可见少量成熟精子(图2)。
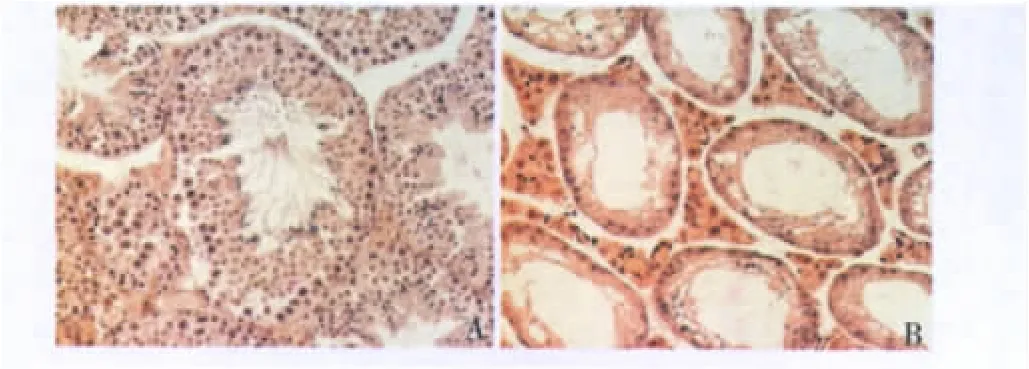
图2 Busulfan处理4周后的小鼠睾丸切片(HE染色) A.正常小鼠睾丸;B.busulfan 40mg/kg,腹腔注射1次,4周后小鼠睾丸
3.稳定表达GFP的GC-1 spg供体细胞的制备:采用Lipo2000转染pRNAT/H1.1-GFP质粒至GC-1 spg细胞。24h后加入600μg/ml的潮霉素筛选稳定表达重组质粒的细胞。约4周后,挑取单细胞克隆于24孔板,待该细胞克隆长满后采用流式细胞仪分选出带有绿色荧光的细胞,用半量潮霉素筛选稳定表达重组质粒的GC-1 spg细胞(图3)。
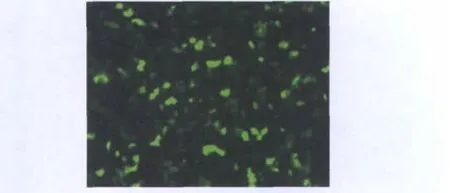
图3 荧光显微镜观察pRNAT/H1.1-GFP稳定表达GC-1 spg细胞
4精原细胞系GC-1 spg移植后在受体小鼠曲细精管内恢复分化能力:将稳定表达GFP的GC-1 spg细胞移植受体小鼠睾丸8周后制备冷冻切片,并以Hoechst33258染细胞核,以罗丹明标记的花生凝集素(TRITC-conjugated peanut agglutinin,PNA)染精子顶体,在激光共聚焦显微镜下观察,明显可见带有红色荧光顶体的精子,证明GC-1 spg细胞在受体睾丸内已经生成成熟精子(图4)。
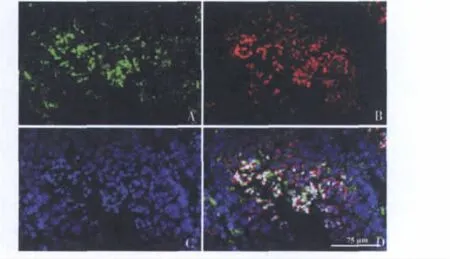
图4 稳定表达GFP的GC-1 spg细胞移植8周后的小鼠睾丸切片图
讨论
精原细胞系GC-1 spg是一株永生化的细胞系,它介于B型精原细胞和前细线期精母细胞之间,其某些特性与早期的精原细胞相同[1]。该细胞系建立于1992年并一直在体外研究中应用,但没有研究表明该细胞系能够在体外分化并产生成熟精子[2~6]。我们通过精原干细胞的移植方法,把精原细胞系GC-1 spg移植回睾丸曲细精管内,研究该细胞在体内环境中是否能够恢复分化能力。研究结果显示,精原细胞系GC-1 spg不但能够在受体小鼠曲细精管中生存,而且能够增殖和分化为成熟精子。
在体内环境中能够维持自我增殖的能力是由于GC-1 spg细胞具有永生化的特征;通过我们的探索,还发现了在体内环境中GC-1 spg细胞还能够重新获得分化的能力。精子发生的维持依赖于精原干细胞的自我更新以及不断分化的能力,而分化能力的维持依赖细胞所处的睾丸特殊的微环境——niche。niche能够提供维持精原干细胞生存、增殖和分化潜能所必须的因子及相关的相互作用蛋白质。niche紧邻睾丸曲细精管的基膜,是由Sertoli细胞包绕形成的腔室,同时Sertoli细胞通过分泌一些特殊的因子调控niche中的生殖细胞,而Sertoli细胞与生精细胞之间的接触是精子发生所必须的[7,8]。当我们把GC-1 spg细胞移植到受体小鼠睾丸中,受体睾丸的曲细精管就为GC-1 spg细胞提供了适宜分化的niche,使得GC-1 spg细胞分化出成熟的精子。我们的研究同时进一步证明了niche对精子发生的重要性。
2002年,为了治疗雄性不育以及制造转基因动物,Brinster[9]创建了体外生殖细胞的移植技术。然而从原代分离的生精干细胞的生长和传代都非常困难,并且操作比较复杂,最终导致成功率低。针对Brinster的经验和教训,我们采用了相对稳定的GC-1 spg永生化细胞系作为转基因新途径的载体,使得精原干细胞移植技术能够更加简便和稳定。但是这种技术方法也存在不足,白消安破坏了小鼠内源性的生精干细胞,但是它的毒性较大,可能会抑制小鼠的骨髓造血功能,严重时将导致小鼠死亡。如果白消安的用量不足,残存的生精干细胞恢复生长和分化,将对观察结果产生一定的干扰。因此,白消安的使用剂量需要因动物种系、周龄等具体情况进行细致的摸索。
1Hofmann MC,Narisawa S,Hess RA,et al.Immortalization of germ cells and somatic testicular cells using the SV40 large T antigen[J].Exp Cell Res,1992,201:417-435
2Gomez M,Manzano A,Navarro-Sabate A,et al.Specific expression of pfkfb4 gene in spermatogonia germ cells and analysis of its 5'-flanking region[J].FEBS Lett,2005,579:357-362
3Giampietri C,Petrungaro S,Coluccia P,et al.FLIP is expressed in mouse testis and protects germ cells from apoptosis[J].Cell Death Differ,2003,10:175-184
4Wang Y,Song W,Li SC,et al.GC-1 mRHBDD1 knockdown spermatogonia cells lose their spermatogenic capacity in mouse seminiferous tubules[J].BMC Cell Biol,2009,10:25
5Li SC,Qiao Y,Di Q,et al.Interaction of SH3P13 and DYDC1 protein:a germ cell component that regulates acrosome biogenesis during spermiogenesis[J].Eur J Cell Biol,2009,88(9):509-520
6Teng Y,Wang Y,Fu J,et al.Cyclin T2:A novel miR-15a target gene involved in early spermatogenesis[J].FEBS Lett,2011,585 (15):2493-2500
7McLean DJ.Spermatogonial stem cell transplantation and testicular function[J].Cell and Tissue Research,2005,322:21-31
8Oatley MJ,Racicot KE,Oatley JM.Sertoli cells dictate spermatogonial stem cell niches in the mouse testis[J].Biol Reprod,2011,84(4): 639-645
9Brinster RL.Germline stem cell transplantation and transgenesis[J].Science 2002,296:2174-2176
(收稿:2011-12-27)
(修回:2012-03-01)
Establishment of An in vivo Remodeling Model in Mouse Spermatogenetic System.
Guan Xin,Li Shuchun,Di Qian,Miao Shiying,Wang Linfang.National Laboratory of Medical Molecular Biology,Institute of Basic Medical Sciences,CAMS and PUMC,Beijing 100005,China
ObjectiveTo establish a remodeling model in mouse spermatogenetic system for the study of spermatogenesis-related gene function in vivo.MethodsMale mice were treated 3-5 weeks with busulfan(40mg/kg)as recipient mice.GC-1 spg cells stably expressing GFP were prepared as donor cells.GC-1 cells were injected into the seminiferous tubules of recipient mouse testis,and then the localization,proliferation and differentiation of donor cells in mouse testis were observed.ResultsThe mouse testis microinjection platform was established successfully,and we observed that stable GC-1 cells could survive,proliferate and differentiate into mature sperms in the seminiferous tubules of recipient mouse testis after transplantation.Conclusionwe successfully established an in vivo remodeling model in mouse spermatogenetic system by application of spermatogonial cell line GC-1 spg.
Spermatogonial cell line;Spermatogenesis;Cell transplantation
精原细胞增殖分化形成精子是一个复杂而有序的过程,它经过初级精母细胞、次级精母细胞、圆形精子细胞,最终分化成为成熟的精子。由于精子发生的过程高度复杂并依赖于体内微环境,所以迄今为止并不能够在体外模拟精子的发生,探索研究精子发生的新方法是急待解决的难题之一。本研究利用永生化精原细胞系GC-1 spg(spg是以pSV-neo转染后获得的一株永生化的精原细胞系)初步建立了小鼠体内生精系统的模型,发现GC-1细胞系移植入小鼠睾丸曲细精管后可以继续发育成成熟精子。该模型的建立和完善将为在体研究生精相关基因的功能提供新的技术方法。
材料与方法
1.实验材料:精原细胞系GC-1 spg购自ATCC(www.atcc.org)。DMSO为Sigma公司产品,NP-30拉针器、MF-900断针器、EG-400磨针器均为NARISHIGE公司产品、解剖显微镜(LEICA)、显微注射器为Eppendorf公司产品等。实验用BALB/c小鼠购自中国医学科学院实验动物研究所。动物常规饲养和实验的手术操作、术后护理在中国医学科学院基础所实验动物中心完成。
国家“973”重大研究计划项目(2006CD944002)
100005北京协和医学院(清华大学医学部)基础学院/中国医学科学院基础医学研究所医学分子生物学国家重点实验室
王琳芳,电子信箱:wang.linfang@imicams.ac.cn
