N-(末端三甲基硅甘氨酸肽)邻苯二甲酰亚胺的光诱导单电子转移成环反应*
2012-09-17李晶华唐慧慧金英学
王 欣 ,李晶华,唐慧慧,金英学
(哈尔滨师范大学)
0 引言
肽具有重要的生理活性、药理活性和其他性质而广泛受到关注[1-3].特别是环肽以其特殊结构以及对酶降解的稳定性,在药学方面得到越来越多的重视和应用.环肽类化合物虽然广泛分布在自然界中,然而含量低,分离提取困难.化学合成是获取环肽类化合物的主要手段,但是环肽类化合物的合成难度较大,这使环肽类化合物的应用受到限制.目前化学合成环肽的方法主要有液相法和固相法.液相法应在高度稀释的条件下进行,纯度虽然较高,但合成效率低.固相法虽不需高度稀释条件,但反应繁琐难度大.Kanoka[5-7],Yoon[8-11]等报道了光诱导电子转移反应合成环化物的方法.在同一分子内引入电子受体和给体,光致激发态发生电子转移生成双端位自由基,自由基偶合成环.此方法区域选择性好,产率较高.笔者曾利用此法合成了一系列大环化合物[12-14].该文以甘氨酸为起始物,构建了以线性甘氨酸二肽、三肽连接的分子内给受电子体系,在甲醇中进行光反应合成了环甘氨酸肽.
1 实验部分
1.1 仪器与试剂
Varian-300核磁共振谱仪(TMS为内标);70 eV Hitachi VG-7070质谱仪;所有的溶剂均经纯化;甘氨酸、2-乙氧基-1-乙氧碳酰基-1,2-二氢喹啉(2-Ethoxy-1-ethoxy-carbonyl-1,2-dihydroquinoline EEDQ)、二叔丁基二碳酸酐(t-Boc酸酐)、三氟乙酸(TFA)均购自Alderich公司.
1.2N-(t-Boc)甘氨酸(1)的制备
将甘氨酸(2.25 g,30 mmol)溶于 100 mL 水中,0 ℃ 下搅拌溶解.加入三乙胺(12.6 g,90.0 mol),在 25 ℃ 搅拌 15 ~20 min,加入 t-Boc 酸酐(6.84 g,30.0 mol),在 25 ℃ 搅拌反应8 h.反应混合物用2 mol/L HCl酸化至pH=2,用乙酸乙酯萃取,有机层用饱和NaCl水洗,无水MgSO4干燥,浓缩,得白色固体,粗产率94%.无需纯化直接在下一步使用.
1.3 N-(t-Boc)-N'-(三甲基硅甲基苄基)甘氨酰胺(2)的制备
将1(0.88 g,5.0 mmol)溶于 30 mL 的干燥的 CH2Cl2中,加入 EEDQ(1.86 g,7.5 mmol)搅拌30 min,在0℃下滴入三甲基硅甲基苄基胺(1.1 mL,5 mmol),室温搅拌10 h.反应混合物用2 mol/L HCl酸化,用CH2Cl2萃取,有机层用5%NaCl溶液洗涤,无水MgSO4干燥、过滤、浓缩得化合物2,粗产率95%,无需纯化直接用于下步反应.
1.4 N’-三甲基硅甲基-N’-苄基甘氨酰胺(3a)的制备
将化合物2(1.75 g,5 mmol)溶于 20 mL 的干燥的CH2Cl2中加入20 mL的三氟乙酸,室温搅拌4 h.反应混合物用Na2CO3饱和溶液中和,用CH2Cl2萃取,有机层用10%NaCl溶液水洗,有机层用无水MgSO4干燥,浓缩得淡黄色油状物3a,粗产率92%;产物无需分离纯化直接用于下一步反应.
1.5 N'-三甲基硅甲基 -N’-苄基-甘-甘酰胺(3b)的制备
把 3a(1.25 g,5.0 mmol)溶于 30 mL 的CH2Cl2中,加入 EEDQ(1.86g,7.5 mmol),搅拌30 min,在 0℃ 下滴入 10 mL 含 2(1.75 g,5.0 mml)的CH2Cl2溶液,室温搅拌8 h,反应混合物用2 mol/L HCl处理至pH=2,用CH2Cl2萃取,有机层用10%NaCl溶液洗涤,有机层用无水MgSO4干燥,浓缩 ,剩余物(4)溶于20 mL的CH2Cl2中,滴入20 mL的三氟乙酸,室温搅拌4 h.反应混合物用Na2CO3的饱和溶液中和,用CH2Cl2萃取,有机层用10%NaCl洗涤,无水MgSO4干燥,浓缩得黄色油状物化合物3b,粗产率90%,无需纯化进入下一步反应.
1.6 N-(末端三甲基硅甲基甘氨酸肽)邻苯二甲酰亚胺(5)的制备
把 3(2.5 mmol:3a 0.62 g;3b 1.02 g)溶于30 mL的 CH2Cl2中,加入三乙胺(1.30 mL,7.5 mmol)搅拌15 min,加入邻苯二甲酰甘氨酸酰氯(0.56 g,2.5 mmol),室温搅拌 3 h.反应结束后用CH2Cl2和水萃取,有机层用10%NaCl水洗,无水 MgSO4干燥,浓缩,硅胶柱(洗脱剂V乙酸乙酯/V正己烷=5∶1)分离得到黄色油状物.
5a 产率 80%.1H NMR(CDCl3)δ:0.03(s,9H,SiMe3),2.91(s,2H,CH2SiMe3),4.10(s,2H,CH2CON(CH2Ph)CH2SiMe3),4.40(s,2H,CON(CO)CH2),4.43(S,2H,CH2Ph);
13C NMR(CDCl3)δ:-1.2,38.6,40.2,41.1,52.0,123.2,126.1,127.3,1274,128.9,131.8,134.0,135.1,165.8,166.6,167.6;FAB-MS m/z 437.26(M+).
5b 产率80%.1H NMR(CDCl3)δ:0.03(s,9H,SiMe3),2.89(s,2H,CH2SiMe3),4.02(s,2H,CH2CON(CH2Ph)CH2SiMe3),4.23(s,2H,CH2CONHCH2CON(CH2Ph)CH2SiMe3),4.32(s,2H,CON(CO)CH2),4.44(S,2H,CH2Ph);13C NMR(CDCl3)δ:-1.2,38.4,39.9,41.1,41.3,52.1,123.2,126.3,127.4,128.6,132.3,134.0,135.2,165.6,166.5,166.7,167.6;FAB-MS m/z 494.18(M+)
1.7 N-(末端三甲基硅甲基甘氨酸肽)邻苯二甲酰亚胺(5)的光反应
将5a(0.5g),5b(0.5g)分别置于光反应器内,分别加入200 mL甲醇溶剂,通入氮气鼓泡30 min,然后在保持通氮气条件下分别用紫外光(波长 大于290 nm)照射1 h,停止反应,反应液减压浓缩,残余物分别用硅胶柱层析(洗脱剂V乙酸乙酯/V正己烷=1∶1)分离得产物 6a,6b.
6a无色油状物,产率45%;1H NMR(CDCl3)δ:3.27(d,J=12.4 Hz,1H,C(OH)CH),4.01(d,J=12.4 Hz,1H,C(OH)CH),4.55(s,2H,NCH2CO),4.65(s,2H,CH2Ph),7.12 ~7.78(m,9H,Ar);13C NMR(CDCl3)δ:41.0,51.1,54.1,83.5,123.1,126.1,127.4,127.5,128.1,128.2,129.6,131.4,134.5,135.8,162.5,163.1;FAB-MS m/z 366.1(M++1).
6b无色油状物,产率 38%;1HNMR(CDCl3)δ:3.43(d,J=12.7 Hz,1H,C(OH)CH),4.11(d,J=12.7 Hz,1H,C(OH)CH),4.35(s,2H,NCH2CONHCH2),4.38(s,2H,NCH2CO),4.59(s,2H,CH2Ph),7.12 ~ 7.78(m,9H,Ar);13C NMR(CDCl3)δ:41.0,51.1,51.3,53.6,123.3,26.0,127.4,127.6,127.7,128.2,130.2,131.1,135.0,135.8,162.3,162.5,163.1;FAB-MS m/z 422.2(MI++1).
2 结果与讨论
2.1 光反应底物的合成
光反应底物N-(末端三甲基硅甲基甘氨酸肽)邻苯二甲酰亚胺(5)的合成方法见文献[10].将甘氨酸溶于水中,在室温下滴入含等摩尔t-Boc酸酐,室温搅拌8 h,得到氨基被保护的甘氨酸1,粗产率达94%,无需纯化直接进行下一步反应.产物1溶于二氯甲烷中,加入2倍的三乙胺,用1.2倍量的EEDQ作缩合剂,滴入N-(三甲基硅甲基)苄胺,反应10 h得到N端保护的甘氨酸胺2,粗产率达95%,无需纯化直接用于下一步反应.化合物2溶解在二氯甲烷溶液中,于室温下用三氟乙酸酸化去t-Boc保护基,得到脱保护的甘氨酰胺3a,粗产率92%,无需纯化可直接用于下步反应.将化合物3a溶于二氯甲烷中,加入2倍量的三乙胺,以1.2倍量EEDQ为缩合剂,与2缩合得到t-Boc保护的二肽4,粗产物97%,此粗产物不经纯化直接在三氟乙酸酸化下得到脱保护的二肽3b,粗产率92%,无需纯化直接用于下一步反应.最后3a和3b分别与邻苯二甲酰亚胺基乙酰氯发生酰化反应得到目标产物5a和5b,硅胶柱层析进一步分离提纯(如图1所示).
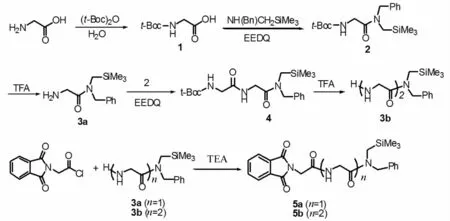
图1 化合物5a,5b的合成
2.2 光反应机理
光反应所用光源为中压汞灯,在光源外套上Pyrex滤光管,使透过滤光管的光波长 λ>290 nm.将光反应底物5a、5b分别置于光反应器中,加入适量甲醇溶剂,持续通入氮气流30 min后,在保持通氮气流条件下,紫外光照射,每隔15 min薄层分析跟踪反应,反应 1 h底物大约90%转化时终止反应,浓缩反应液,残余物用硅胶柱层析分离得环化物6a和6b.反应机理如图2所示.化合物5光致激发态的羰基发色团与邻近氮原子发生SET,生成分子内双离子自由基7,离子自由基7在链上发生分子内单电子传递(ISET)生成双端位离子自由基8,离子自由基8的末端基团SiMe3在极性溶剂甲醇的溶剂化效应的辅助下很容易离去,生成双端位自由基9,最后自由基偶合成环肽化合物6.
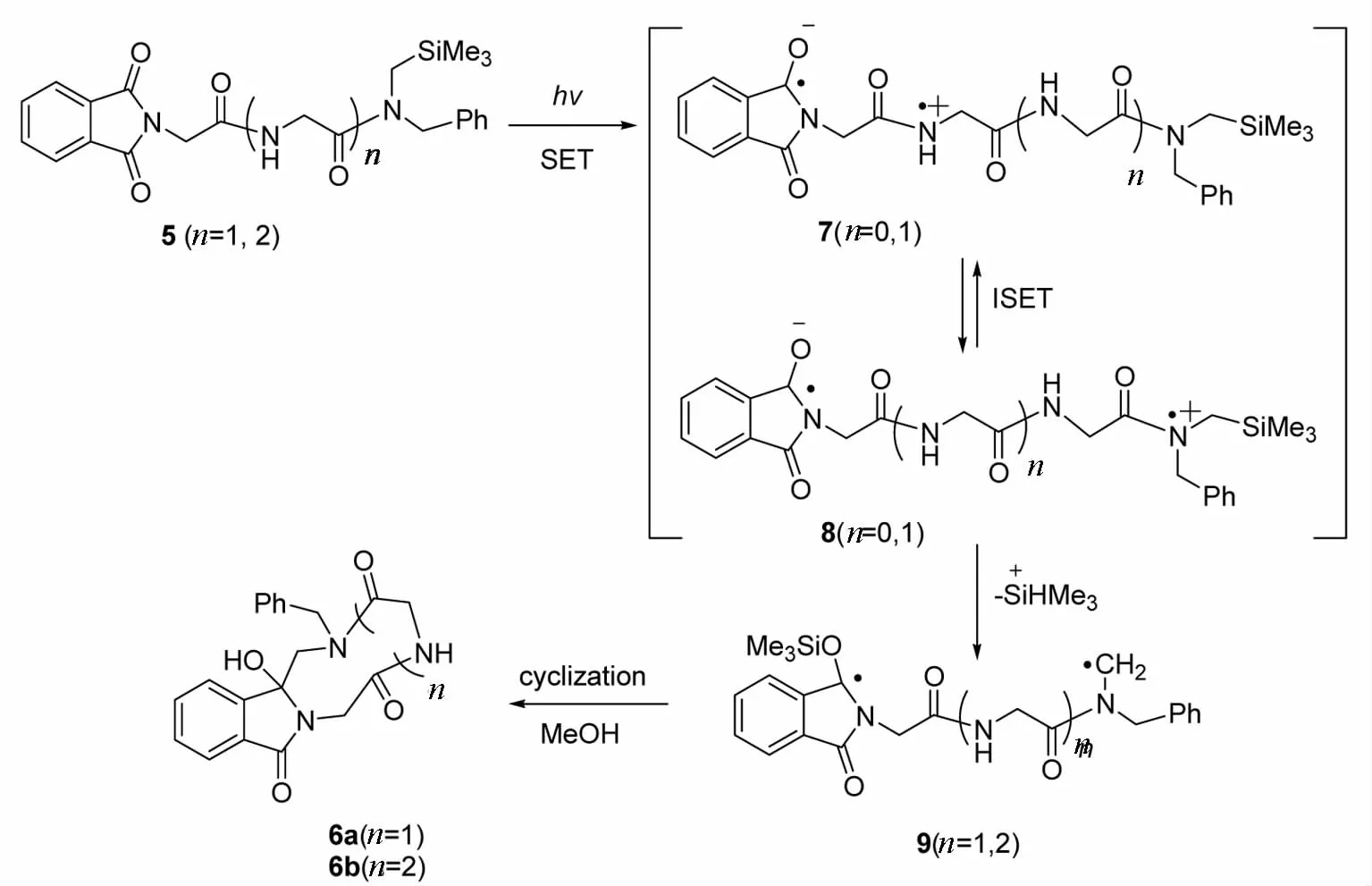
图2 化合物5的光反应机理
3 结论
合成了2个新的N-(末端三甲基硅烷基甘氨酸肽)邻苯二甲酰亚胺衍生物,在甲醇溶液中进行光反应以很高的区域选择性和较好产率得到了新的环甘氨酸肽.利用光反应可以制备一系列新的环肽化合物.
[1] Glannis A,Kolter T.Peptide Mmetics for Receptor Ligsnds:Discovery,Developent and Medicin[J].Angew Chem Int Endl,1993,32(5):1244-1267.
[2] Ranganathan D,Hardas V,Madhuasudanan K P.Synthesis of Trishomocubane Amino Acid Derivatives[J].Angev Chem Int Ed Engl,1996,35(4):1105-1107.
[3]Lawrenced S,Jiang T,Levettm.Self-assembling,Supramolecular Complexes[J].Chem Rev,1995,95:2229-2260.
[4] Kanaoka Y,Migita Y,Koyama K,et al.Photochemistry of the phthalimide systemⅣ.Photocyclization of N-alkylphthalimides to benzazepinone lactams:Unusual two-fold norrish typeⅡ reactions[J].Tetrahedron Lett,1973,50(14):1193-1196.
[5] Kanaoka Y,Koyama K,Flippen J L,et al.Photochemistry of the phthalimide systemⅣPhotocyclization of N-alicyclic phthalimides.Synthesis of multicyclic benzazepine systems[J].J Am Chem Soc,1974,96(10):4719-4721.
[6] Machida M,Takechi H,KanaokaY.Photochemical Synthesis of Multicyclic Fused Imidazo-lidines,Hydropyrazines,and Hydro-1,4-diazepines[J].Synthesis,1982,50(2):1078-1080.
[7] Yoon U C,Mariano P S.Mechanistic and Synthetic Aspects of Amine- Enone Single Electron-Trasfer Photochemistry[J].Acc Chem Res,1992,25(2):233-240.
[8] Yoon U C,Mariano P S.The Synthetic Potential of Phthalimide SET Photochemitry[J].Acc Chem Res,2001,34(3):523-533.
[9] Yoon U C,Jin Y X,Oh S H,et al.Comparison of Photomacrocyclization Reactions of Trimethylsilyl-and Tributylstannyl Terminated Phthalimido – and Maleimido-polyethers[J].Journal of Photochemistry and Photobiology A:Chemistry,2002,150(1):77-84.
[10] Yoon U C,Jin Y X,Oh S W,et al.A Synthetic Strategy for the Preparation of Cyclic Peptide Mimetics Based on SETPromoted Photocyclization Processes[J] J Am Chem Soc,2003,125(20):10664-10671.
[11] Yoon U C,Kwon H C,Hyung T G,et al.The Photochemistry of Polydonor-Substituted Phthalimides:Curtin-Hammett-Type Control of Competing Reactions of Potentially Interconverting Zwitterionic Biradical Intermediates[J].J Am Chem Soc,2004,126(4):1110-1124.
[12] Jin Yi X,Tan G H,Liu S S,et al.Photoinduced Cyclization Reactions of N-(ω-teributyltinalkyl)phthalimides[J].Chin J Synth Chem,2008,16(2):153-157.
[13] Jin Y X,Tan G H,Wang T C,et al.Photoinduced Cyclization Reactions of Phthalimide Derivatives N-Linked Two Electrondonating Chains by Single Electron Transfer[J].Chin J Org Chem,2010,30(4):595-600.
[14] Jin Y X,Yuan W,Qu F Y,et al.Photoinduced Single Electron Transfer Cyclization Reactions of N-(ω-tributylstannylpolyethoxyether)phthalimides[J].Acta Chim Sinica,2011,69(20):2407-2412.
