大豆果胶类多糖组成特性及空间结构的初步解析
2012-09-17郭晓飞刘俊山朱丹实
刘 贺 郭晓飞 刘俊山 李 君 朱丹实
(渤海大学化学化工与食品安全学院 辽宁省食品安全重点实验室辽宁省高校重大科技平台“食品贮藏加工及质量安全控制工程技术研究中心”,锦州 121013)
大豆种皮因含有丰富的果胶类多糖而备受关注[1]。国内外诸多学者对大豆皮多糖产生浓厚兴趣,已在多糖提取工艺的优化及初步理化性质分析方面做了大量工作。周艳红等[2]对从大豆皮中提取果胶多糖的工艺条件进行了研究,通过单因素法和正交试验,得到草酸铵浓度为0.6%,料液比为1∶35,萃取时间为2 h,萃取温度为100℃,提取率可达6%。Proctor课题组采用酸法提取大豆皮果胶并探讨了乙醇沉淀方法对果胶纯度和产率影响,果胶的提取率达到15%左右,半乳糖醛酸质量分数在60%~85%左右[3-4]。本课题组前期在大豆果胶多糖提取工艺的优化并采用果胶甲酯酶对大豆皮果胶浸提液进行脱酯处理的基础上,利用均匀设计方法考察酶解温度、酶解时间、pH和酶的加入量对果胶产品酯化度和果胶提取率的影响,获得了具有统计学意义的二次回归方程[5],利用其凝胶性能将保加利亚乳杆菌包埋,考察不同凝胶组成对菌株的包埋率及其在人工胃液中的存活情况以及在人工肠液中的释放情况,结果表明,果胶凝胶包埋保加利亚乳杆菌,可以有效保护益生菌,并在人工肠液中将其释放,果胶质量分数及氯化钙浓度对包埋效果有影响,体现在二者交联形成网络结构的差异,网络结构越致密,包埋率及益生菌在人工胃液中的存活率越高,而释放率则越低[6]。刘贺等[7]考察色素在低甲氧基大豆皮果胶和壳聚糖复合凝胶中的扩散行为,结果表明,一级动力学方程较好地描述了色素在复合凝胶溶胀状态下的扩散过程。并利用均匀设计方法获得了表观速率常数及扩散系数的多元二次回归方程,合理地表征了各因素对动力学参数的影响情况,扩散动力学参数反映了凝胶网络结构的特征。但目前尚缺乏大豆果胶类多糖结构方面的研究。
为获得大豆果胶类多糖更为丰富的信息,从而为明晰大豆果胶类多糖结构与凝胶特性之间的关系奠定理论基础,本研究首先对多糖进行凝胶层析分离,进而开展对多糖层析分离,对各组分多糖的一级结构进行初步探讨,并利用光散射(LS)和透射电镜(TEM)对各组分进行分子质量及空间结构信息分析。
1 材料与方法
1.1 试验材料
大豆果胶类多糖,实验室制备,总糖82.36%,蛋白质 5.21%,水分 6.84%,灰分 5.59%。DEAE -Sepharose FF、标准分子质量的Dextran、标准单糖:美国pharmacia公司。
1.2 仪器与设备
HL-2B恒流泵、BSZ-100自动部份收集器:上海青浦沪西仪器厂;SZ-93A自动纯水蒸馏器:上海亚荣生化仪器厂;Waters600高效液相色谱仪:美国Waters公司;DionexICS-5000离子色谱仪:美国戴安公司;T6700傅里叶红外光谱:美国NICOLE公司;H-800透射电子显微镜:日本理学公司;DAWN HeleosII多角度光散射检测仪:美国怀雅特技术公司。
1.3 试验方法
1.3.1 大豆果胶类多糖的分离
称取50 mg大豆果胶类多糖溶解于25 mL 0.02 mol/L pH 6.0的磷酸缓冲液中,采用DEAE Sepharose FF阴离子凝胶对多糖进行分离纯化,色谱柱为1 cm×60 cm,柱床高度约 45 cm,先用 0.02 mol/L pH 6.0的磷酸缓冲液洗脱,再用含有0~1 mol/L NaCl的0.02 mol/L pH 6.0的磷酸缓冲液进行梯度洗脱,平均流速2.5 mL/min,每2 min接收1管,利用苯酚硫酸法(490 nm)和紫外吸收法(280 nm)跟踪检测多糖和蛋白,得洗脱曲线,收集洗脱峰、旋转蒸发、浓缩、透析、干燥得到多糖组分[8],分别记为SHPPN(SHPP-中性组分)和SHPP-A(SHPP-酸性组分)。
1.3.2 单糖组成分析
多糖溶于4 mol/L的TFA中,110℃烘箱中水解6 h,反复加入甲醇利用氮吹仪使之吹干,用去离子水稀释20倍,通过高效离子色谱分析其单糖组成。色谱柱为Carbopac PA20 column(150 mm×3 mm);流速:0.5 mL/min;进样量:25 μL;检测器:脉冲安培检测器,金电极;前20 min NaOH溶液浓度为4 mmol/L,之后为160 mmol/L进行洗脱[9]。
1.3.3 尺寸排阻色谱法(SEC)和激光光散射(LS)联用分析
SHPP-N和 SHPP-A溶于0.2 mol/L NaNO3中,过0.22 mm微滤膜后,利用尺寸排阻色谱法(SEC)和激光光散射(LS)联用测定SHPP-N和SHPP-A的相对分子质量和构象参数,用标准相对分子质量的Pullulan(7.0×104和2.0×106)校正。色谱柱为 TSKgel G4000 PW XL 7.8 ×300,样品池为 K5,流速0.5 mL/min,淋洗液为 0.2 mol/L NaNO3(折光指数 n=1.334),RI检测器和 LS 检测器联用[10]。
1.3.4 傅里叶红外光谱(FT-IR)分析
样品测试前空白校正,扣除空气中CO2和湿度对样品测定的干扰,空白扫描32次以上,分辨率为1 cm-1,扫描范围400~4 000 cm-1。然后对干燥、研磨后的多糖样品进行IR扫描。
1.3.5 透射电镜(TEM)分析
取SHPP-N和SHPP-A分别配制成10 μg/mL的分散液,经0.22 μm微孔滤膜过滤,把多糖溶液涂在碳膜的铜网上,自然干燥后经磷钨酸负染色后,用TEM观察多糖的分子形貌[11]。
2 结果与讨论
2.1 SHPP的组成及初步分离纯化
试验所用原料为微波辅助从大豆种皮中提取得到的果胶类多糖[12-13]。从所带电荷来看,果胶类多糖一般包含中性糖组分及酸性糖组分。图1为大豆种皮多糖溶液的洗脱曲线,DEAE-Sepharose FF为阴离子琼脂糖凝胶,兼具有电荷效应和分子筛效应,可把组分依电荷和分子质量进行分离,经层析分离后,SHPP分为两个组分,即SHPP-N和SHPP-A(图1),前者占33.46%,后者占66.54%。并且第一个组分无紫外吸收,第二个组分有紫外吸收,并且酸性糖部分与紫外吸收峰值基本吻合。同时采用福林酚法对多糖的蛋白含量进行测定,表明SHPP-A中蛋白质质量分数为7.16%,糖蛋白使多糖与蛋白值以共价键形式结合紧密结合在一起,在图1中SHPP-A与蛋白质洗脱曲线的重合表明它们之间的紧密联系,初步分析其为一种糖蛋白。郑建仙等[14]采用NaClO3和 HOAc对大豆细胞壁物质进行提取,获得一种含羟脯氨酸的糖蛋白(PRF3),采用DEAE-Sephadex A-50对提取物进行分离,并利用化学方法其精细结构进行解析,表明其主链为半乳糖,支链为阿拉伯糖。SHPP-A与PRF3在提取方法和原材料上存在差异,但从组成上看,二者存在一些共性与联系。
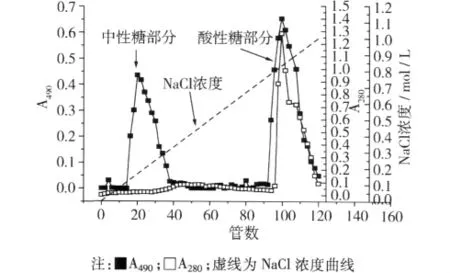
图1 SHPP在DEAE-Separose FF凝胶下洗脱曲线
2.2 SHPP-N和SHPP-A的单糖组成
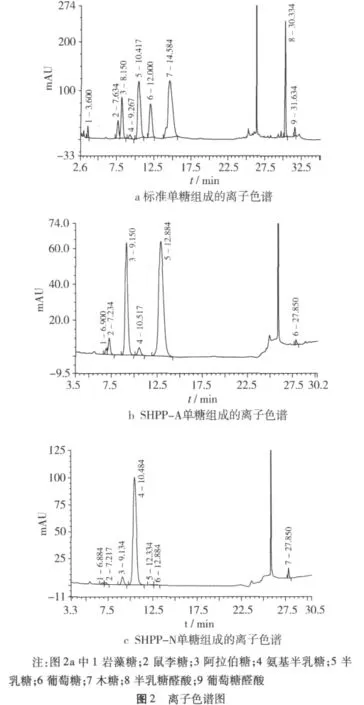
利用离子色谱对SHPP-N和SHPP-A单糖组成进行分析,图2a~图2c分别为12种标准单糖、SHPP-A和SHPP-N离子色谱图。SHPP-N和SHPP-A单糖组成的物质的量比如表1所示,经过DEAE-Sepharose FF分离后,SHPP-A中半乳糖醛酸质量分数达40%,而SHPP-N以甘露糖为主,二者的半乳糖含量比较接近。赖富饶等[15]采用热水浸提豆皮水溶性多糖,利用DEAE-cellulose对粗多糖进行分离,得到SHP-3,利用气相色谱测定其糖醛酸质量分数为26.71%,鼠李糖∶果糖∶阿拉伯糖∶木糖∶甘露糖∶半乳糖∶葡萄糖的物质的量比分别为3.55∶0.44∶11.58∶1.745∶5.12∶1.12,且没有紫外吸收,其结构与SHPP-A组成存在显著差异,从组成上来看,其为一种类似瓜尔胶的半乳甘露聚糖。
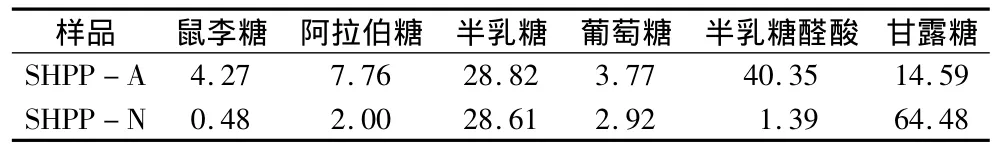
表1 SHPP-N和SHPP-A单糖物质的量比
2.3 红外分析
利用FT-IR可以对大分子结构进行初步表征,图3为SHPP-A和SHPP-N的FT-IR图谱,2 500~3 700 cm-1为O—H伸缩振动的强吸收峰,由分子间和分子内的氢键所引起,2 930 cm-1为C—H的伸缩和弯曲振动,在2 700~3 000 cm-1它与O—H重叠在1 000~2 000 cm-1为果胶类多糖的特殊吸收峰,1 740 cm-1为果胶类多糖自由羧基的吸收峰[16];SHPP-A在1 100~930 cm-1有3个吸收峰,表明SHPP是以吡喃环为主,SHPP-A在889 cm-1和833 cm-1吸收峰表明既有β-型糖苷键又有α-型糖苷键[17,18];且在 1 418 cm-1有蛋白质高级结构 β折叠所引起的红外吸收,表明SHPP-A还有一定量的蛋白,与DEAE-Sapharose FF紫外吸收呈现出一致性。相比之下SHPP-N在876.6 cm-1附近的吸收峰表明SHPP-N为β-糖苷键结构,且不含蛋白吸收峰。从DEAE-Sepharose FF对多糖进行分离,并利用紫外跟踪检测的结果来看,SHPP-A与蛋白质结合在一起,IR结构分析验证了上述试验结果。
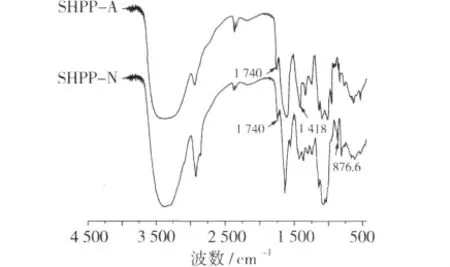
图3 SHPP-A和SHPP-N的红外吸收
2.4 多糖的分子质量及分子尺寸
SEC与LS联用技术主要是利用RI和LS两个检测器对高分子分级、检测,可对高聚物分子质量分布和均方旋转半径(<s2>1/2)进行测定,Berth利用Sepharose 2B和Sepharose 4B对商业桔皮果胶进行分离,分别采用光散射法和固有黏度法对各组分相对分子质量进行测定[19];表2为SEC-LS联用所测得的相对分子质量和分子尺寸参数,高分子一般呈现出多分散性,Mw为重均相对分子质量,Mn为数均相对分子质量,Mz为Z均相对分子质量;表2所示为SHPP-N和SHPP-A的相对分子质量分布参数,SHPP-N的相对分子质量分布指数为1.756,呈现一定的多分散性,而SHPP-A的相对分子质量分布指数为 1.092,呈现单分散齐聚物的特性,表明经DEAE-Sepharose FF凝胶分离后,相对分子质量呈现均一性。均方旋转半径表示高聚物在溶液中平均尺寸,可以反映高聚物伸展状态的构象;从表2中可以看到SHPP-N和SHPP-A的分子尺寸较为接近,SHPP-A的部分伸展程度大于AHPP-N。

表2 SHPP-N和SHPP-A相对分子质量与分子构象参数
2.5 TEM 分析
TEM利用电子聚焦成像的高分辨率和高放大倍数的光学仪器[20]。可对生物大分子结构进行解析,戴玲等[21]利用TEM对丹皮多糖结构进行研究,表明丹皮多糖以球状和圈状为主,可进一步聚集为链状和网状。图4a为SHPP-A的TEM成像图,多糖链有数百纳米的长度,多糖链之间通过氢键等次级键形式交联在一起形成聚集体,呈纤维状,Humblet-Hua利用卵清蛋白和果胶的聚电解质作用的制备微胶囊壁材,TEM对其结构分析表明它的几何尺寸与SHPP-A较为相似,但呈现出球状结构[22]。图4b为SHPP-N在水溶液中呈现的杆状结构,SHPP-N分子没有聚集现象,分子几何尺度的伸展较小,这与SEC-LS联用对SHPP-N和SHPP-N构象参数测定的结果较为吻合。

3 结论
SHPP-N以中性糖为主,SHPP-A是以酸性糖为主的糖蛋白。SHPP-N和SHPP-A重均相对分子质量分别为2.293×105和4.094×105。SHPP-N的相对分子质量分布指数为1.756,呈现一定的多分散性,而 SHPP-A的相对分子质量分布指数为1.092,呈现单分散齐聚物的特性,相对分子质量分布较为均一。初步推测SHPP-N和SHPP-A空间构象为杆状,并且SHPP-A分子以次级键交联,较SHPP-N更具柔性和伸展性。因此酸性多糖具有更好的透明度,应用前景更为广泛。
[1]H E Snyder,Tw Kwon.Soybean utilization[M].New York:Van Nostrand Reinhold,1987
[2]周艳红,金征宇.大豆皮果胶多糖的提取工艺研究[J].食品工业科技,2004,25(3):76 -78
[3]U Kalapathy,A Proctor.Effect of acid extraction and alcohol precipitation conditions on the yield and purity of soy hull pectin[J].Food Chemistry,2001,73(4):393 -396
[4]Ravin Gnanasambandam,A Proctor.Preparation of soy hull pectin[J].Food Chemistry,1999,65(4):461 -467
[5]刘贺,郭晓飞,刘昊东,等.大豆皮果胶酶法脱酯参数研究[J].食品工业科技,2010,32(5):273 -275
[6]刘贺,郭晓飞,胡洋,等.利用大豆皮果胶凝胶包埋保加利亚乳杆菌的初步研究[J].乳业科学与技术,2011,34(2):51-54
[7]刘贺,王雪,郭晓飞,等.果胶-壳聚糖复合凝胶网络色素扩散动力学[J].食品科学,2011,32(09):72-75
[8]冯涛,顾正彪,金征宇.凉粉草胶的初级结构与流变性质的研究[J].天然产物研究与开发,2008,19(6):933 -938
[9]Xinlin Wei,Fangfang Mao,Xuan Cai,et al.Composition and bioactivity of polysaccharides from tea seeds obtained by water extraction[J].International Journal of Biological Macromolecules,2011,49(4):587 -590
[10]陈海华.亚麻籽胶的功能性质结构及其应用[D].无锡:江南大学,2005
[11]史黎黎,章双,胡先明.两亲性茯苓多糖纳米微球的制备及药物负载性能研究[J].时珍国医国药,2009,20(6):1506-1508
[12]刘贺,朱丹实,何余堂,等.一种大豆种皮果胶类凝胶多糖的制备方法:中国,201110400583.3[P],2012 -06 -28
[13]刘贺,郭晓飞,高虹妮,等.微波辅助提取大豆皮果胶工艺参数优化[J].食品与发酵科技,2010,46(5):37-40
[14]郑建仙,耿立萍.大豆糖蛋白的结构研究[J].化学学报,1997,55(3):306 -312
[15]赖富饶,吴晖,李晓凤,等.豆皮水溶性多糖组分SHP-3的物化性质研究[J].天然产物研究与开发,2011,23(1):76-81
[16]R Gnanasambandam,A Proctor.Determination of pectin degree of esterification by diffuse reflectance Fourier transform infrared spectroscopy[J].Food chemistry,2000,68(3):327 -332
[17]RH Walter.The chemistry and technology of pectin[M].New York:Academic Press,1991
[18]张维杰.糖复合物系列化研究技术[M].杭州:浙江大学出版社,1999
[19]G Berth.Studies on the heterogeneity of citrus pectin by gel permeation chromatography on Sepharose 2 B/Sepharose 4 B[J].Carbohydrate Polymers,1988,8(2):105 -117
[20]周玉,武高辉.材料分析测试技术[M].哈尔滨:哈尔滨工业大学出版社,2007
[21]戴玲,沈业寿,庄永龙,等.丹皮多糖分子的电子显微镜观察[J].电子显微学报,2006,25(5):405-407
[22]Knp Humblet- Hua,G Scheltens,E Van Der Linden,et al.Encapsulation systems based on ovalbumin fibrils and high methoxyl pectin[J].Food Hydrocolloids,2011,25(4):569-576.
