UPLC-MS/MS测定鲜切康乃馨和柃木中农药多残留
2012-09-17陈先锋湛嘉钟莺莺顾建锋俞雪钧彭锦峰冯睿王松青崔俊霞
陈先锋 湛嘉 钟莺莺 顾建锋 俞雪钧 彭锦峰 冯睿 王松青 崔俊霞
(宁波出入境检验检疫局 浙江宁波 315012)
1 前言
我国是鲜活植物出口大国。据海关最新统计数据显示,2011年1至10月,我国花卉出口额已达1.57亿美元,常见的品种包括菊花、康乃馨、百合、月季。此外,在日本用做敬祭祖先供品的铃木、杨桐的鲜切叶出口已占有日本70%-80%的市场份额。然而,鲜活植物极易携带线虫、昆虫等病虫害[1],检疫风险大,属高风险出口产品,须经过严格的除害处理,其中农药浸泡处理一直是最直接有效而且能保持产品外观品质的常用方法之一[1-3]。但农药的使用会带来新的问题。虽然日本、欧美等发达国家也尚未对进口的鲜切花等鲜活植物产品提出明确的农药等有毒有害物质的残留限量要求,但随着这些发达国家对农药等化工品的使用及控制要求的日益严格,以及民众环保意识的提高,德国、日本等国家已经开始关注鲜活植物等产品中农药使用及其残留量。因此,我国鲜切花、鲜切叶、盆景等苗木等产品中的农药等残留问题很有可能成为影响正常出口的潜在隐患,未来有可能成为技术壁垒。
然而,目前除了关于干菊花农残检测方法的报道外[4],关于鲜活植物中的农药残留检测方法报道几乎一片空白。笔者对鲜活植物出口的周边企业农药使用情况进行调查,并收集相关文献[1-3],总结出最典型或影响较大的25种常用农药(见表1),作为代表进行方法学研究,囊括了低毒、中毒和高剧毒的常见农药品种(包含了极性和非极性),旨在为今后出口鲜活植物产品的农药残留控制及有效应对国外有可能成为的相关技术壁垒打下坚实基础。
2 材料与方法
2.1 材料
2.1.1 仪器与试剂
超高效液相系统(ACQUITY UPLC)和三重四极杆串联质谱(XEVO TQ):Waters公司;PL2002型电子天平:梅特勒中国公司;冷冻离心机(3-15k):德国Sigma公司;超纯水器:法国Milliporeco公司;Votexgenie-2型旋涡混合仪:美国Scientific Industries公司;多通道过滤装置(Superb mutli-filter 20-40,用于固定多个过滤器):宁波赛恩斯公司。
标准品依次为:甲胺磷、多菌灵、杀虫眯、氧化乐果、敌敌畏、克百威、定虫眯、乐果、丙线磷、吡虫啉、敌百虫、甲拌磷、硫线磷、噻唑磷、对硫磷、双甲脒、辛硫磷、苯线磷、除虫脲、马拉硫磷、氯氰菊酯、氰戊菊酯、溴氰菊酯、阿维菌素、伊维菌素,均购自Dr.Ehrenstorfer,用乙腈 +二甲亚砜(V/V=9/1)配制1.0 mg/mL,然后各取1 mL,用乙腈定容于25 mL容量瓶中,即为40μg/mL。
D-SPE混合固相萃取填料:240 mg,包括PSA:C18:MgSO4混合比例为4:2:2。
2.1.2 试验材料
康乃馨和柃木分别取自宁波花鸟市场和宁波东荣花艺,分别用塑料袋密封后,置于0℃冰箱中避光保存。
2.2 方法
2.2.1 提取
将鲜切康乃馨和柃木用剪刀剪碎后,用厨用粉碎机粉碎,称取2.50g左右(精确到0.01g)粉碎后的样品,加入乙腈30 mL,组织匀浆1 min,加入1 g MgSO4,超声提取15 min,冷却至4℃以4000 rpm离心10 min,取上清液于1.0 mL到15 mL离心管(a)中。
2.2.2 净化
在离心管(a)中加入乙腈5 mL,加入240±10 mg混合固相萃取填料(2.1),充分混匀后,以12000 rpm离心5 min。在离心管(a)取157μL于15 mL离心管(b)中,加42.8%甲醇溶液(含乙酸铵1.25 mmol/L)1.0 mL,充分混匀后,经过针式过滤器(0.45μm孔径,膜材料为特富龙),进行 UPLCMS/MS测定。
2.2.3 色谱质谱条件
色谱柱为Acquity Waters HSS-T3 C18(2.1 mm x 100 mm,1.8 μm);柱温:40℃;流速:400 μL/min;选择流动相A1:1.25 mmol/L乙酸铵水溶液,流动相B1:甲醇;梯度洗脱程序(以体积百分比记)为:0-6.8 min,100% -0%A1;6.8 -11.5 min,0%A1;11.5 -11.6 min,0 - 100%A1;11.6 -13 min,100%A1;各洗脱时间段中均以流动相B1补足余下的百分数。流路切换:0-1.4 min切换阀打开,色谱柱流出液进入废液,1.4 min后开始质谱采集。
正离子模式下通过多反应监测(MRM)进行数据采集;毛细管电压为3.5 kV;离子源温度:150℃;去溶剂气温度:450℃;去溶剂流速:750 L/h;锥孔流速:50 L/h;碰撞气体:氩气3.3 ×10-3mba。
2.2.4 标准曲线定量
在2种粉碎好的空白鲜切植物样品中,分别加入 0、2.5、12.5、25、50、75、100 μg,按上述前处理后进行测定,以其浓度为横坐标,仪器响应值为纵坐标,分别做基质添加标准曲线。
2.2.5 检测限、回收率和精密度
在2.5 g粉碎好的空白鲜切样品中,加0.25、0.5、1、2.5 μg 标准品,按上述前处理,以信号大于10倍基线噪音确定最低定量限。在2.5 g粉碎好的空白鲜切样品中,加 2.5、12.5、25 μg标准品,按上述前处理后进行测定,每个水平重复6次,测定其回收率和精密度。
3 结果与讨论
3.1 UPLC-MS-MS参数优化
3.1.1 离子化的选择
如图1所示,25种化合物中,基本电离方式为[M+H]+,菊酯类和阿维菌素类等电离方式为[M+NH4]+。对于阿维菌素类,还存在[M+Na]+电离方式,响应值比[M+NH4]+相对更强。由于此时锥孔电压很高,本底噪音较小,试验发现,线性(R2在0.997 -0.999)也与[M+NH4]+的线性(R2在0.998-0.999)差异不大,故本实验中采用母离子选择[M+Na]+。然而David(2007)则认为阿维菌素类[M+Na]+响应的线性差,与本文的结论不相吻合[5]。25种农药的保留时间、质谱参数和离子比例见表1。
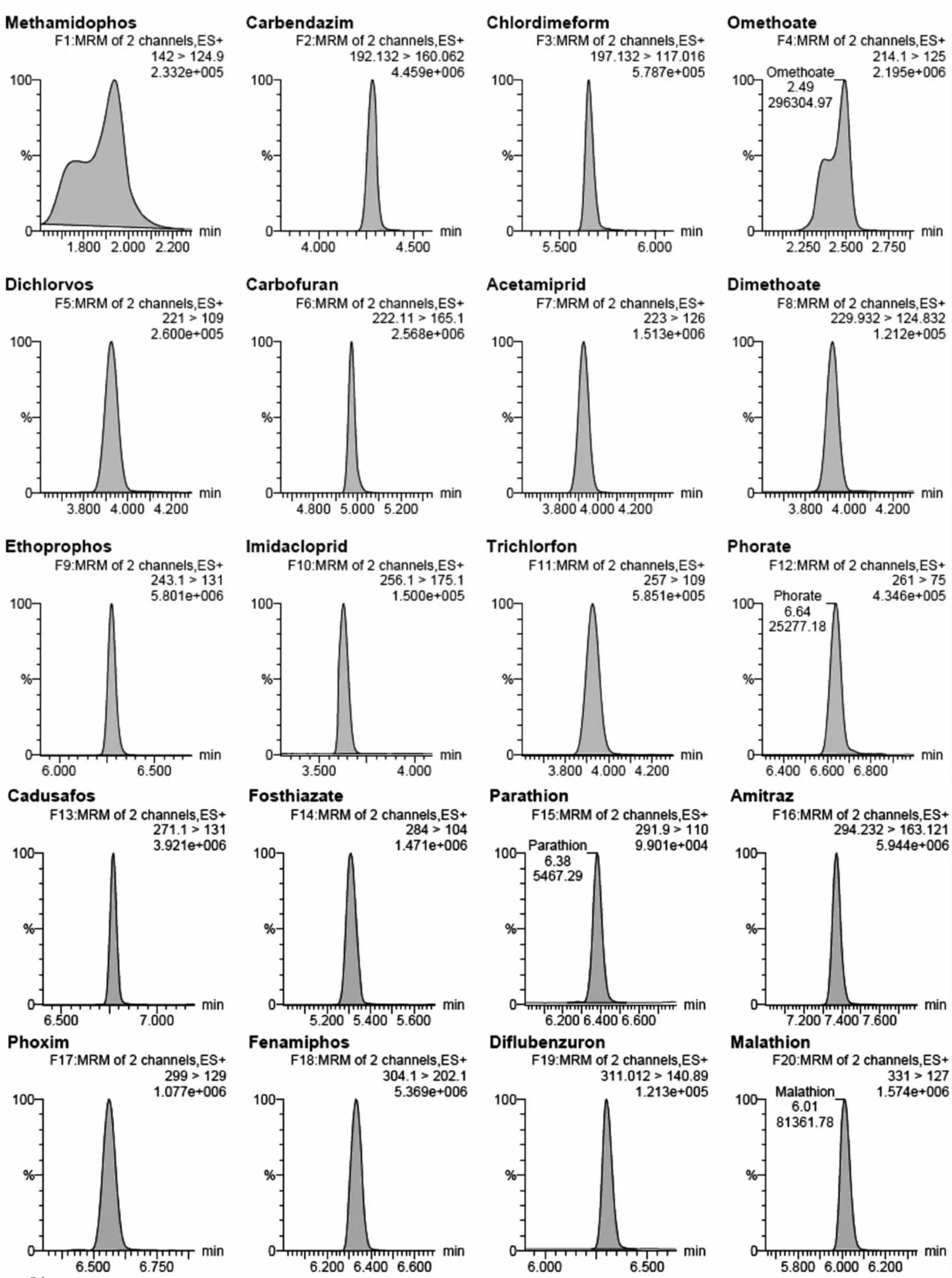
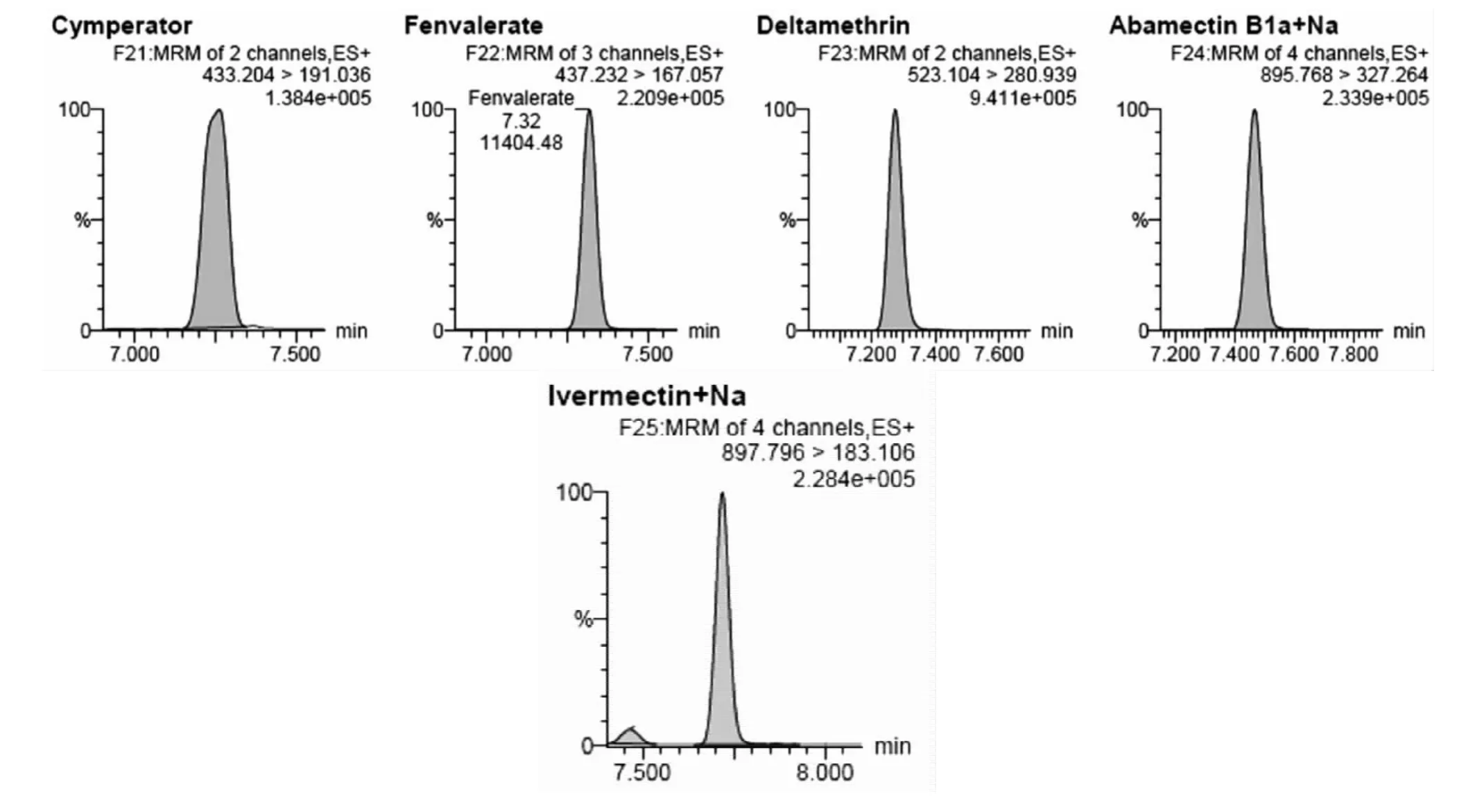
图1 25种农药LC-MS/MS谱图
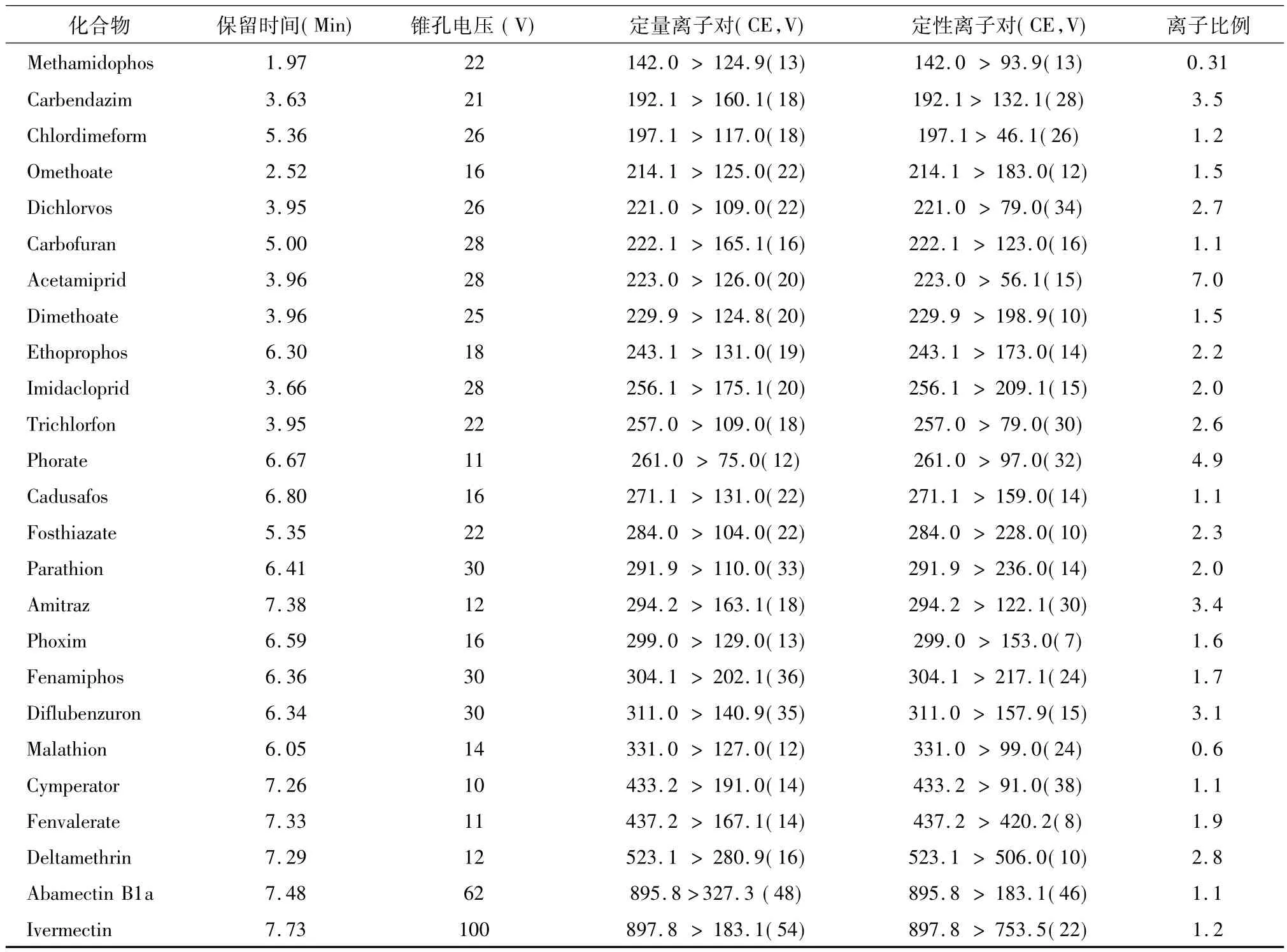
表1 25种农药的保留时间、锥孔电压、定量离子对、定性离子对和离子比例
3.1.2 流动相的优化
根据色谱保留行为和离子化效率来优化流动相。0.1%甲酸水溶液-甲醇、不同浓度的乙酸铵水溶液(0.625、1.25、2.5、5、10 mmol/L) - 甲醇等 7种不同的流动相进行对比。在0.1%甲酸水溶液-甲醇体系中,菊酯类和阿维菌素类响应很低;不同乙酸铵浓度下,对于同一混标(20 ng/mL),起初随着乙酸铵浓度的增加,响应值略微增加,到2.5 mmol/L相应变化不明显,之后随着乙酸铵浓度增加,响应值普遍逐步降低。因此,1.25 mmol/L乙酸铵水溶液-甲醇为最佳流动相。乙腈与甲醇相比虽然可以降低系统压力,但使用甲醇的灵敏度相对更高。
3.1.3 定容液的选择
定容液的选择至关重要,对回收率、色谱峰的形状和离子化效率有较大影响[6]。一方面,定容液的有机溶剂含量过高,保留时间较短的水溶性强的化合物如甲胺磷和氧化乐果等的色谱峰会拓宽,甚至形成双峰,影响灵敏度和线性;另一方面,当有机溶剂含量较低时(低于50%),菊酯类和阿维菌素类等的回收率会显著下降,这是因为这些物质的溶剂度在有机相含量低的溶剂中大大降低,且容易在试管、滤器等地方被吸附。另外,定容液中含有乙酸铵可以促进[M+NH4]+电离方式的菊酯类化合物的离子化效率。因此,本方法选择定容液(水:甲醇:乙腈 =4:3:1,含乙酸铵1.25 mmol/L),有机相约在50%,甲胺磷和氧化乐果尽管会出现极性较弱的化合物双峰现象,但线性仍然较好(R2>0.990),其他种类的色谱峰几乎没有受高含量有机溶剂影响。
3.2 方法学参数
3.2.1 特异性、标准曲线
未经药物处理的空白鲜切康乃馨和柃木各20份中均为检出上述农药,表明该方法的特异性良好。康乃馨中25种农药标准曲线线性相关系数R2的范围均为 0.997-1.000,线性范围在 0-75.4 ng/mL(样品浓度范围0-40 mg/kg)(见表2),柃木中25种农药标准曲线线性相关系数R2的范围为0.997-1.000,线性范围在 0 -75.4 ng/mL(见表2)。超出线性的,用空白样液进行稀释。

表2 鲜切康乃馨和柃木中25种农药的标准曲线、回归系数和线性范围
3.2.2 检测限、回收率和精密度
康乃馨平均添加回收率范围84.7% -1 14.1%,RSD范围2.2% -13.5%(见表3);柃木平均添加回收率范围78.2% -115.8%,RSD 范围1.1% -15.7%(见表4)。在两种基质中,超过90%的平均回收率在70% -110%范围,回收满意,80%以上RSD数据均不高于10%,精密度良好。
虽然基质的复杂性不同,对定量检测限差别不大,当添加水平为0.5 mg/kg时,所有农药离子对S/N均大于10。由于鲜切植物并非用来食用,建议将检测限和最大残留限量一律定在0.5 mg/kg。
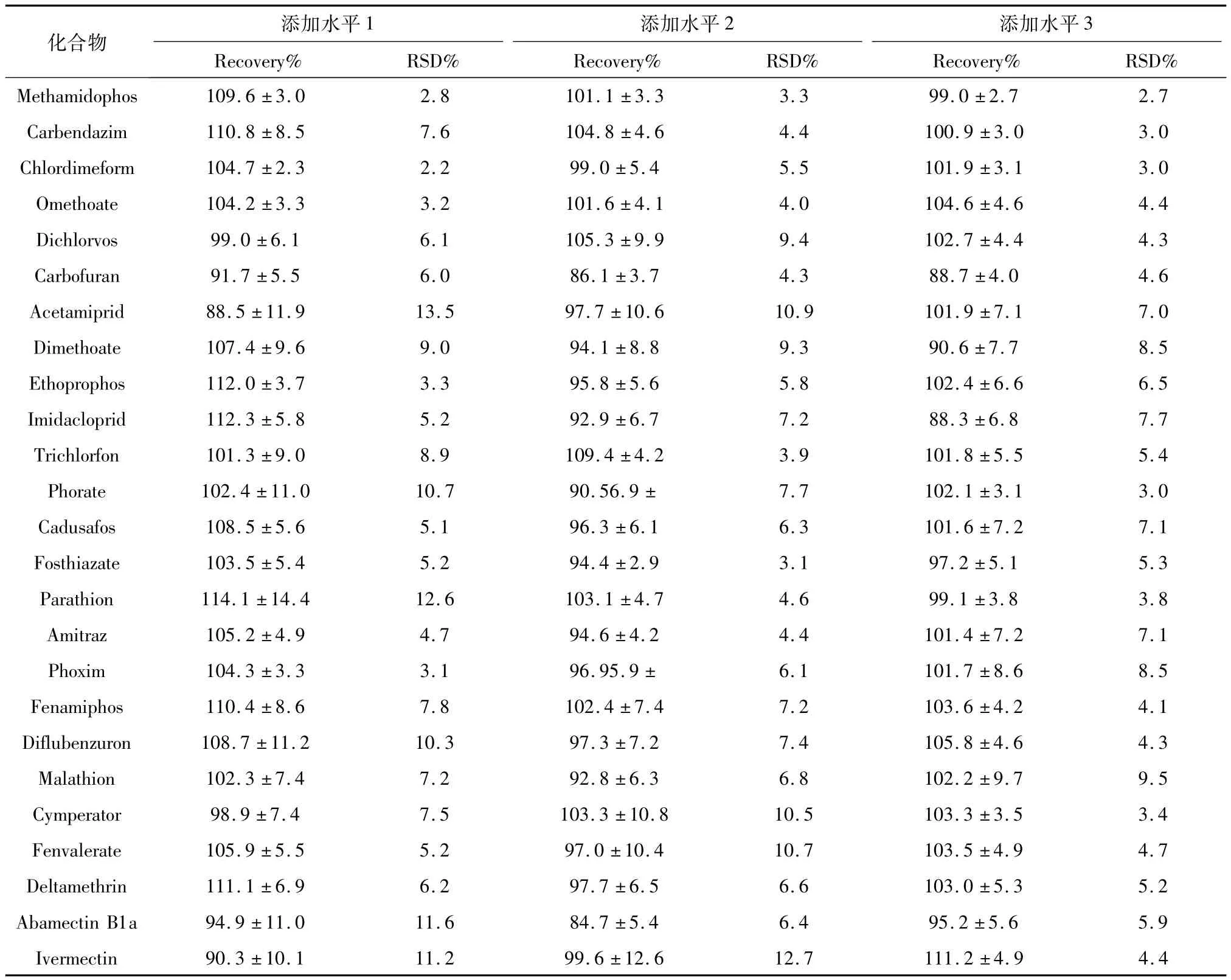
表3 鲜切康乃馨中25种农药标准曲线和相关系数

表4 鲜切柃木中25种农药回收率、精密度
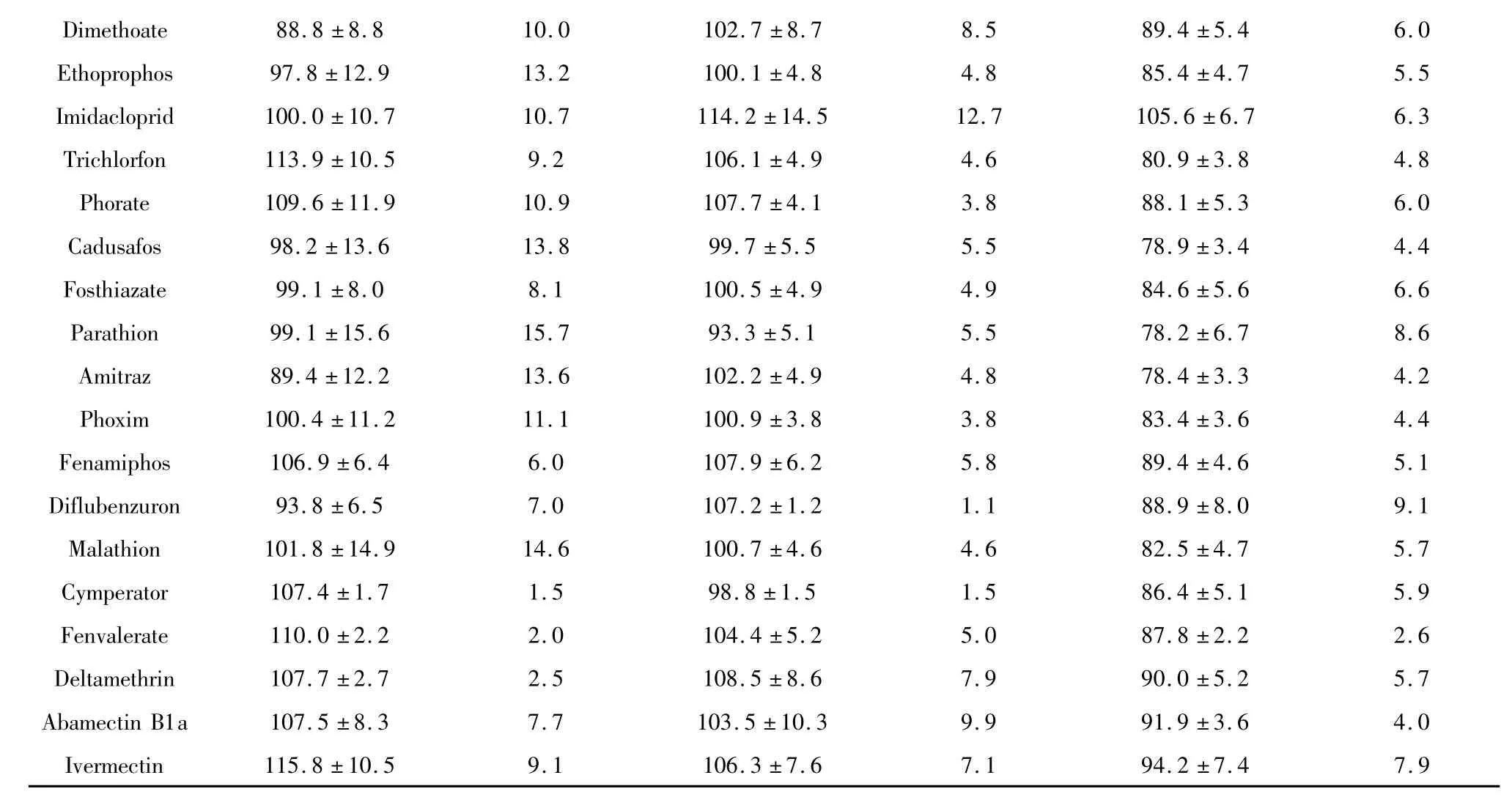
D i m e t h o a t e 8 8.8 ±8.8 1 0.0 1 0 2.7 ±8.7 8.5 8 9.4 ±5.4 6.0 E t h o p r o p h o s 9 7.8 ±1 2.9 1 3.2 1 0 0.1 ±4.8 4.8 8 5.4 ±4.7 5.5 I m i d a c l o p r i d 1 0 0.0 ±1 0.7 1 0.7 1 1 4.2 ±1 4.5 1 2.7 1 0 5.6 ±6.7 6.3 T r i c h l o r f o n 1 1 3.9 ±1 0.5 9.2 1 0 6.1 ±4.9 4.6 8 0.9 ±3.8 4.8 P h o r a t e 1 0 9.6 ±1 1.9 1 0.9 1 0 7.7 ±4.1 3.8 8 8.1 ±5.3 6.0 C a d u s a f o s 9 8.2 ±1 3.6 1 3.8 9 9.7 ±5.5 5.5 7 8.9 ±3.4 4.4 F o s t h i a z a t e 9 9.1 ±8.0 8.1 1 0 0.5 ±4.9 4.9 8 4.6 ±5.6 6.6 P a r a t h i o n 9 9.1 ±1 5.6 1 5.7 9 3.3 ±5.1 5.5 7 8.2 ±6.7 8.6 A m i t r a z 8 9.4 ±1 2.2 1 3.6 1 0 2.2 ±4.9 4.8 7 8.4 ±3.3 4.2 P h o x i m 1 0 0.4 ±1 1.2 1 1.1 1 0 0.9 ±3.8 3.8 8 3.4 ±3.6 4.4 F e n a m i p h o s 1 0 6.9 ±6.4 6.0 1 0 7.9 ±6.2 5.8 8 9.4 ±4.6 5.1 D i f l u b e n z u r o n 9 3.8 ±6.5 7.0 1 0 7.2 ±1.2 1.1 8 8.9 ±8.0 9.1 M a l a t h i o n 1 0 1.8 ±1 4.9 1 4.6 1 0 0.7 ±4.6 4.6 8 2.5 ±4.7 5.7 C y m p e r a t o r 1 0 7.4 ±1.7 1.5 9 8.8 ±1.5 1.5 8 6.4 ±5.1 5.9 F e n v a l e r a t e 1 1 0.0 ±2.2 2.0 1 0 4.4 ±5.2 5.0 8 7.8 ±2.2 2.6 D e l t a m e t h r i n 1 0 7.7 ±2.7 2.5 1 0 8.5 ±8.6 7.9 9 0.0 ±5.2 5.7 A b a m e c t i n B 1 a 1 0 7.5 ±8.3 7.7 1 0 3.5 ±1 0.3 9.9 9 1.9 ±3.6 4.0 I v e r m e c t i n 1 1 5.8 ±1 0.5 9.1 1 0 6.3 ±7.6 7.1 9 4.2±7.4 7.9
3.3 样品的净化
虽然25种待测物的极性范围分布较广,理化性质差异大,为了保证都能获得较好的回收率,提取和净化必须具有一定的通用性[7]。
乙腈配合一些盐类(NaCl、MgSO4、柠檬酸三钠等)是国内外农药多残留分析中使用最流行的高效提取溶剂,同时共萃取的干扰物少,用水稀释后可以直接进样,可以加快前处理速度,优于甲醇、丙酮和乙酸乙酯[8]。提取液中含有大量叶绿素等脂溶性强物质,若不经过净化处理,菊酯类、阿维菌素类受到明显的抑制效应,灵敏度相当低。为了克服LC-MS/MS的基质效应问题,净化处理是至关重要的[9]。从便利高效考虑,选择已经在蔬菜水果农残检测广泛使用的QuEChERS方法对乙腈提取液进行净化处理,其核心步骤是基质分散固相萃取(DSPE),此方法既具有简便性又具有通用性[9-10]。对填料 PSA,石墨化碳(GCB)、中性氧化铝、C18、NH2进行筛选,发现PSA和C18不仅有较好的净化作用,而且对回收率影响甚小,硫酸镁用于吸收水分。C18对去油脂非常高效,PSA对有机酸、固醇类、糖类和脂类均有较好的吸附性,PSA比NH2吸附颜色更深,这是由于其含有两个氨基,离子交换容量更大的原因[11]。石墨化碳具有最好的除色素作用,美中不足的是对双甲脒吸附强,当每毫升乙腈中超过5 mg GCB时,甚至超过50%。这是由于双甲脒分子为平面结构的芳香烃(见图2),极易被石墨化碳片状所吸附。Stanislaw也曾指出当每毫升乙腈中超过10 mg GCB时,嘧菌环胺、喹螨醚、嘧霉胺、喹氧灵、五氯硝基苯等农药容易被GCB吸附[12]。中性氧化铝在去除本底干扰物的同时,会吸附特定待测组分,引起回收率的降低。
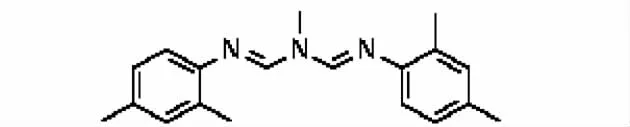
图2 双甲脒结构式
最终选用在乙腈中加入PSA和C18填料除杂质的方法,与固相萃取小柱相比节约成本和时间,而且具有更好的回收率和重复性[13]。
3.4 实际样品分析结果
在除害处理车间取样经分析,分别检出乐果的平均含量在6.79 mg/kg,柃木中氧化乐果平均含量为0.12 mg/kg,检出氰戊菊酯为 4.15 mg/kg。另外,在宁波地区花店进行康乃馨抽样检测,检出氧化乐果最高浓度为0.071 mg/kg、双甲脒的最高浓度为0.087 mg/kg 和定虫眯最高浓度为0.79 mg/kg。
4 结论
鲜切植物是极为复杂的基质,在本方法中样品仅需乙腈提取和d-SPE(PSA和C18填料)净化,对于不同理化性质的受试农药,不仅基质效应小,而且回收率理想、精密度良好;单个样品前处理的时间少于 1h,仪器分析运行时间13min。表明了QuEChERS结合UPLC-MS/MS具有快速和通用特点,适合鲜切植物中多类别农药残留检测,具有显著的省时、省力、低消耗的特点。
[1] 戚龙君,王旭.苗木浸根杀寄生线虫处理技术[J].植物检疫,2002,16(5):270 -272.
[2] 郑炜,谢清云,张海滨,等.三种杀线虫剂对盆景上线虫防治效果比较[J].植物检疫,2005,19(3):145-147.
[3] 徐瑛,张冬冬,王江岭,等.两种生物制剂对植物寄生线虫防效的室内测定[J].安徽农业科学,2009,37(8):3611-3612.
[4] 郝丽丽,薛健.菊花中18种有机氯农药的多残留分析药物分析杂志[J].药物分析杂志,2006,26(12):1838-1841.
[5] David A.Durden.Positive and negative electrospray LC – MS–MSmethods for quantitation of the antiparasitic endectocide drugs,abamectin,doramectin,emamectin,eprinomectin,ivermectin,moxidectin and selamectin in milk[J].J Chromatogr B,2007,850(1-2):134-146.
[6] Kokkonen M,Jestoi M.A multi-compound LC-MS/MSmethod for the screening of mycotoxins in grains[J].Food Anl Methods,2009,2:128-140.
[7] JoséLuis Fernández Moreno,A.Garrido Frenich,Patricia Plaza Bolan~os,JoséLuis Martínez Vidal.Multiresidue method for the analysis of more than 140 pesticide residues in fruits and vegetables by gas chromatography coupled to triple quadrupole mass spectrometry[J].J Mass Spectrom,2008,43(9),1235 -1254.
[8] Pizzutti I R,de Kok A,Hiemstra M,et al.Prestes O D[J].J Chromatogr A,2009,1216(21):4539-4552.
[9] F JSchenck ,JE Hobbs(July 2004)."Evaluation of the Quick,Easy,Cheap,Effective,Rugged,and Safe(QuEChERS)Approach to Pesticide Residue Analysis"[J].Bull Environ Contam Toxico,2004,73(1):24-301.
[10] 宋欢,薛园园,林勤保.超高效液相色谱-电喷雾串联质谱法同时测定坚果中18种氨基甲酸酯类农药残留[J].分析化学,2009,37(5):782.
[11] Beyer,M Biziuka.Comparison of efficiency of different sorbents used during clean-up of extracts for determination of polychlorinated biphenyls and pesticide residues in low - fat food[J].Food Research International,2010,43(3):831 -837.
[12] SWalorczyk.Application of gas chromatography/tandem quadrupole mass spectrometry to the multi-residue analysis of pesticides in green leafy vegetables[J].Rapid Commun.Mass Spectrom,2008,22(23):3791-3801.
[13] Anastassiades M,Lehotay S J,Stajnbaher D,et al.Fast and easy multiresidue method employing acetonitrile extraction/partitioning and"dispersive solid-phase extraction"for the determination of pesticide residues in produce[J].J AOAC Int,2003,86(2):412-431.
