抗体介导的排斥反应病理学研究概要
2012-09-17郭晖
郭晖
随着细胞性排斥反应的有效控制和抗体介导的排斥反应(antibody-mediated rejection,AMR)发病机制及其各移植器官病理学特征研究的深入,AMR已经成为排斥反应预防、诊断和治疗的核心内容。进一步了解AMR的病理学特征及其研究进展,有助于移植病理医师更好地利用其病理学特点及时准确地判断并指导临床治疗,切实改善移植受者和移植器官的长期存活。
1 有关AMR认识的简要回顾
AMR亦称体液性排斥反应(humoral rejection),其中参与的体液性因素主要为移植后产生的供者特异性抗体(donor-specific antibody,DSA),亦称为受者同种反应性抗体(recipientde novoalloantibody或de novoDSA)。1970 年 Jeannet等[1]提出肾移植受者术后早期即会产生DSA,其可以导致严重的血管性排斥反应,这类受者预后很差[2-4]。随后在20世纪90年代早期,加拿大 Alberta大学的 Halloran等[5-8]明确了在移植肾急性排斥反应时伴有抗HLA的de novoDSA产生,并初步提出了抗体所致免疫损伤的途径为“补体-中性粒细胞途径(complementneutrophil pathway)”,即DSA与移植物HLA抗原结合后激活补体,介导炎症细胞反应导致局部组织免疫性损伤。几乎与此同时,1993年德国慕尼黑大学的Feucht等[9-10]最早报道了移植物毛细血管内皮表面补体片段C4d沉积与移植物失功能的关系以及可以作为AMR的组织学指标。这一发现几乎可以称为器官移植排斥反应研究尤其是AMR研究的一次“革命”。在此基础上,美国麻省总医院的Collins等[11]在移植肾活组织检查(以下简称“活检”)C4d免疫组织化学染色检测及其临床-病理关系方面进行了深入的研究,规范性地建立了C4d免疫荧光以及免疫酶染色检测方法。随后瑞士巴塞尔大学病理学研究所也确定了将C4d染色作为临床移植肾AMR特异的诊断标志物。紧接着,维也纳大学的Böhmig等[12-13]通过研究进一步证实了上述发现。这一系列研究进展,不仅迅速改变了长期以来单纯以细胞免疫作为移植物排斥反应损伤效应机制的观念,而且也打破了长期以来由于缺乏一种特异性诊断标志物从而使得AMR免疫损伤机制的研究一直裹足不前的局面。
2 AMR的分类及其诊断
C4d指标在AMR中诊断意义的明确及其检测方法的建立,不仅揭示了体液免疫反应的存在,而且也帮助我们认识到:AMR的靶部位主要位于以移植物毛细血管为主的末梢血管床,进而造成广泛的血管内皮免疫损伤,并可以成为慢性移植物血管病或慢性移植物失功能的重要致病因素之一。AMR参与到几乎所有排斥反应类型的病理损伤机制中(见图1),包括经典排斥反应类型中的超急性排斥反应和急性排斥反应,甚至慢性排斥反应,在这个认识基础上提出的慢性AMR的概念逐渐被大家所接受。

图1 抗体介导的排斥反应与超急性排斥反应、急性排斥反应以及慢性排斥反应的关系模式图
在上述经典分类的基础上,随着AMR的临床、病理学以及免疫学综合研究的深入,其基本的临床诊断标准逐渐明确,即应包括是否出现移植物功能减退、能否在受者血清内检测出DSA、移植物活检组织内是否具有相应的组织学改变以及是否具有C4d染色阳性。在2003年4月,由美国国立卫生研究院(National Institute of Health)组织了由病理学家、临床学家以及基础研究科学家组成的国际专家组,针对AMR的移植术前检测的技术与方法、临床综合诊断(包括临床表现、病理学与免疫学)指标、临床治疗以及基础研究进行了分组研讨,初步提出了一种新的AMR的类型划分[14],见表1。

表1 2003年美国国立卫生研究院制订的AMR分类a
因此,严格而言,建立AMR的诊断应具备两方面的资料,即在移植者血清内检测出DSA以及在移植物内检测出AMR的标志物C4d。此外,严重者可有临床移植物功能异常。AMR基本的临床诊断标准如下:(1)临床可见明显的移植物功能减退;(2)组织学检查见毛细血管内中性粒细胞、单核细胞等的淤积;(3)C4d免疫组织化学法染色见毛细血管或肾小管管周毛细血管部位C4d阳性表达;(4)对激素等常规抗排斥反应治疗无效。
3 AMR基本病理学特征
移植物最严重的AMR无疑是临床超急性排斥反应,其主要的病理学特征为动脉管壁纤维素样坏死,广泛的血管腔内血栓形成,移植物缺血性或出血性坏死(见图2),甚至可致移植肾破裂,移植物间质内明显出血、水肿以及大量中性粒细胞浸润。
移植肾急性AMR时病理学表现包括严重的血管内膜炎、动脉血管管壁纤维素样坏死、肾小球炎、肾小管管周毛细血管内中性粒细胞淤积、实质组织梗死等。也有研究者报道肾小球毛细血管丛和(或)肾小管管周毛细血管内单核/巨噬细胞的出现是AMR的早期标志。
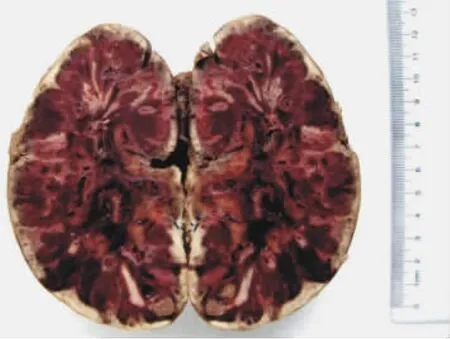
图2 移植肾抗体介导的排斥反应(超急性排斥反应)大体标本
移植肝AMR的组织学表现因是否ABO血型不相合肝移植以及活检取材或移植肝切取的时间而有所不同。对于ABO血型不合肝移植受者,肉眼可见移植肝明显肿大并呈现出血状外观;镜下可见大片出血性或缺血性坏死灶,各级动脉以及静脉血管分支呈血管内膜炎,血管内皮细胞明显水肿,管壁呈纤维素样坏死。术后即刻活检可见肝窦内红细胞以及中性粒细胞淤积;汇管区静脉分支和(或)中央静脉管腔内纤维素样血栓栓塞;肝小叶内小灶状肝细胞缺血坏死。数天后活检可见肝组织内肝细胞缺血性坏死更为明显,部分肝组织出血性坏死;血管内皮细胞明显水肿以及腔内血栓形成。对于ABO血型相合的肝移植受者如果发生AMR,一般其程度较之ABO血型不相合移植受者轻,主要表现为肝动脉以及门静脉血管分支血管内膜炎,肝细胞可以出现点状嗜酸性坏死或小灶状缺血性坏死。国际推荐的基本诊断标准为:移植肝出现快速肝功能下降,组织学检查可见肝组织缺血性坏死并伴有中性粒细胞浸润并排除了其他可能导致移植肝缺血性坏死的原因。如果在排除了血管并发症所致梗死等因素后,对于肝组织内坏死性动脉炎、免疫球蛋白沉积以及在移植受者血清内检测出DSA,则建议可以直接诊断AMR。AMR有时难以与其他导致移植肝损伤的并发症如严重的缺血再灌注损伤以及血管栓塞等相鉴别,在借助影像学检查等排除了血管并发症以及在活检组织内发现明显的血管内膜炎等组织学表现后,这一鉴别过程则相对比较容易了。
移植心脏的AMR最主要的特征为冠状动脉血管分支的动脉内膜炎甚至坏死性动脉炎。在移植肺,除血管内皮细胞作为主要靶部位形成移植肺动脉内膜炎外,移植肺各级支气管黏膜上皮(airway epithelial cell)由于强烈表达HLAⅡ 类抗原分子,因此也成为AMR攻击的主要靶部位,甚至有部分研究者报道了移植肺支气管黏膜上皮细胞较之血管内皮细胞在排斥反应中具有更重要的作用。
目前,随着C4d这一补体片段在AMR诊断中的研究越来越广泛,各种移植物C4d免疫组织化学染色的表现日益明了。C4d免疫组织化学染色已经成为移植肾必要的检测项目,而且在移植肝、心脏、肺等多种移植物AMR中的作用正在逐渐被认识。移植肾发生AMR时,免疫荧光以及免疫酶染色可见肾组织内广泛的肾小管管周毛细血管内皮细胞以及基底膜有线样C4d阳性表达(见图3);在移植肝组织内可见肝窦内皮细胞或汇管区C4d阳性表达(见图4);在移植心脏的心肌间毛细血管基底膜有C4d阳性表达(见图5);在移植肺,可见C4d表达于终末细支气管黏膜上皮细胞表面,甚至在移植肺慢性排斥反应即闭塞性支气管炎时,仍可见终末细支气管黏膜上皮细胞表面C4d阳性表达。

图3 移植肾抗体介导的排斥反应组织病理学表现(免疫酶染色 ×400)
慢性AMR病理学特征与慢性细胞性排斥反应相似。慢性AMR在移植肾除主要表现为移植肾动脉血管病外,近来研究发现移植肾肾小球病(transplant glomerulopathy)是慢性AMR的新的特征性病变[15],主要表现为移植肾肾小球系膜基质增生、硬化分叶和毛细血管基底膜双轨样改变,但缺乏电子致密物沉积。移植肝慢性AMR则同样表现为慢性移植肝动脉血管病和胆管缺失;移植心脏表现为移植心脏冠状动脉血管病。其确诊除具备以移植物动脉血管病为主要特点的病变外,还须经移植物免疫组织化学染色检测到C4d表达和受者血清检测出DSA证实。

图4 移植肝抗体介导的排斥反应组织病理学表现(免疫酶染色 ×200)
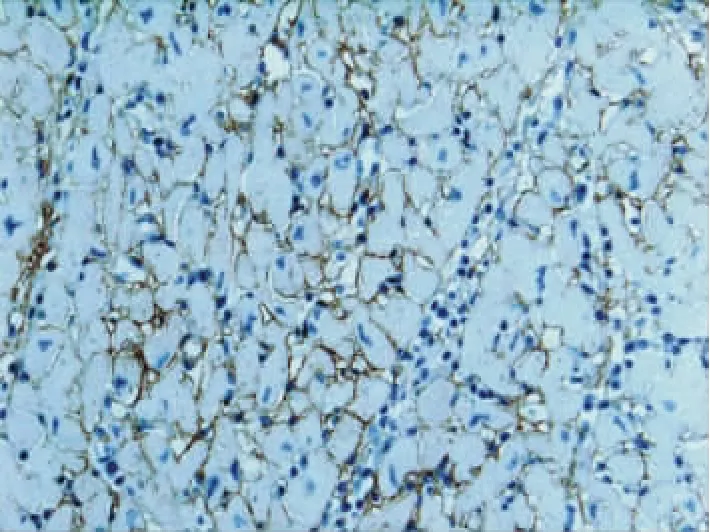
图5 移植心脏抗体介导的排斥反应组织病理学表现(免疫酶染色 ×200)
4 AMR病理学研究进展
4.1 关于C4d阴性AMR
随着C4d免疫组织化学染色在移植物活检诊断中的应用日益广泛,目前发现C4d在诊断AMR上具有局限性[16]。部分病例移植物活检具备AMR的病理学特征且受者血清中检测到DSA而C4d检测呈阴性,仅能疑为AMR或诊断为C4d阴性AMR,尤其是许多慢性移植肾肾小球病受者体内可检测到DSA但活检组织内C4d染色呈阴性。这或许是由于染色方法学的原因,或许是由于石蜡制片过程溶解了内皮细胞上沉积的补体,抑或由于抗体与移植抗原结合后尚未充分结合补体等因素,也可以由于抗HLAⅡ类抗原抗体介导的移植物血管内皮细胞凋亡而无需激活外体(非补体依赖性的途径)等。此外C4d表达也可见于ABO血型不合移植术后应用eculizumab治疗且未出现间质-肾小管病变和无移植物功能减退的病例中。可见C4d对AMR的诊断具有较好的特异性,但敏感性并不高,C4d阴性者并不能绝对排除AMR的诊断。由于C4d免疫组织化学染色检测在C4d阴性AMR诊断中失去了意义,借助NK细胞检测和电镜观察血管内皮是否活化和损伤以及检测免疫损伤所致血管内皮活化相关标志物均有助于明确C4d阴性AMR患者诊断和预后。Sis等[17]近来报道,通过筛查C4d阴性和C4d阳性受者移植肾活检组织内血管内皮活化相关因子,发现其中冯·维勒布兰德(von Willebrand's)因子(vWF)、小凹蛋白1(caveolin-1)、黑色素瘤细胞粘附分子(melanoma cell adhesion molecule)、血小板/内皮粘附分子(platelet/endothelial cell adhesion molecule-1)、选择素-1(selectin-1)、CD34和钙粘素-5与 AMR显著相关,其对于 C4d阴性DSA阴性AMR诊断的敏感性和特异性分别为77%和71%,同时可与T淋巴细胞介导的排斥反应和其他非免疫因素损伤较好鉴别。
4.2 移植肝AMR
移植肝AMR中C4d染色的病理学特征一直存在争议[18]。我们观察了移植肝活检组织中AMR特异性标志物C4d的表达情况,发现其阳性率仅4.5%,远低于移植肾活检组织中约15%的阳性率;且移植肝AMR患者C4d阳性表达仅有极少许在肝窦内皮和少数在汇管区内纤维组织,难以见到在肝窦内皮弥漫性表达;在慢性排斥反应病例中均未检出C4d沉积[19],造成这一现象的机制有待后续研究。目前推测可能与以下因素有关:(1)肝血窦类似于一块巨大“海绵”吸附受者体内的预存抗体或抗原-抗体复合物,阻止其作用于内皮细胞;(2)肝具有动脉和门静脉的双重血供,且肝窦由不连续的或网状的内皮细胞覆盖这一独特的解剖结构,更容易耐受补体激活形成的微血栓和缺血损伤;(3)肝窦内皮大量库普弗(Kupffer)细胞具有强大的吞噬和清除免疫复合物的能力等,因此移植肝可能与移植肾、心脏等具有完全不同的免疫耐受机制。
Neil等[20]最新研究发现移植肝急性排斥反应是其慢性排斥反应直接始动因素,而且急性排斥反应后发生慢性排斥反应非常迅速(3个月左右)。在组织学上贯穿于慢性排斥反应的演进过程中的最关键的表现为肝小叶中央静脉血管内皮炎以及以它为中心的小叶中央坏死性炎症(centrilobular necroinflammation,CLNI)和小叶中央肝细胞坏死(centrilobular necrosis),这一研究再次证明肝小叶的坏死性炎症在进展为慢性排斥反应中的重要性。同时,CLNI在急性排斥反应诊断中的价值也有提高:若移植肝活检组织中有CLNI而没有或仅有轻微的炎性浸润时也可判断为急性排斥反应。通过增加免疫抑制剂的用量可使急性排斥反应组织学特征之一——汇管区炎性浸润消失,但CLNI却仍然存在,提示需要延长免疫抑制剂冲击治疗的时间或存在其他的目前尚未明了的致病机制。由于Nakazawa等[21]的研究也有类似发现,因而最近的移植肝活检诊断与分级的Banff标准中将CLNI增补为急性排斥反应的诊断依据,并且认为以前的名称“中央静脉炎(central venulitis)”并不恰当,而“小叶中央坏死性炎症(centrilobular necroinflammation)”的名称更为准确。进一步的研究还发现,CLNI可进展为小叶中央纤维化(centrilobular fibrosis),形成肝小叶第3区肝组织纤维化,并成为移植肝向慢性排斥反应进展的重要指征。
4.3 移植心脏AMR
近来逐渐明确AMR不仅导致移植后近期移植心脏失功能,而且也是导致移植心脏发生以冠状动脉血管病为特征的慢性排斥反应的重要危险因素[22]。国际上多数心脏移植中心确定在移植心脏内膜心肌活检组织内IgG、IgM、IgA、C1q、C3d和C4d是AMR的病理组织学标志物,其中C4d作为活化的补体片段,是活检诊断中新的、优于上述其他指标的、更为特异的诊断AMR的免疫病理学指标。基于C4d免疫组织化学染色技术,Michaels等[23]报道移植心脏AMR的发生率为44%~59%。我们应用光镜和C4d免疫酶染色方法观察移植心脏内膜心肌活检组织,发现移植心脏呈C4d阳性的AMR是移植术后常见的并发症之一,其发生率为43.7%[24]。
移植心脏AMR是否导致临床症状和体征一直存有疑问。部分发生移植心脏AMR患者仅出现低热、乏力、轻微气短和运动后呼吸困难,胸部X线摄片检查无异常、心电图QRS波群电压轻微下降,甚至无任何症状和体征,而移植心脏内膜心肌活检后C4d免疫组织化学染色呈阳性。我们认为该部分患者属于所谓“亚临床AMR”。这一结果提示移植心脏内膜心肌活检病理学诊断仍是鉴别细胞性排斥反应和AMR以及其它并发症的独特手段,是其他诊断手段所不能取代的。
因AMR也是导致移植心脏慢性排斥反应的重要致病因素之一,故早期诊断和及时治疗移植心脏AMR成为预防移植心脏慢性排斥反应的关键环节之一。移植心脏内膜心肌活检组织C4d免疫酶染色是更切合临床诊断实际,具有良好时效性、特异性和敏感性的方法。近来Rodriguez等[25]报道在结合临床检查同时联合进行C4d和C3d染色能提高移植心脏AMR诊断的敏感性,可更好地指导治疗和预防慢性排斥反应的发生。
1 Jeannet M,Pinn VW,Flax MH,et al.Humoral antibodies in renal allotransplantation in man[J].N Engl J Med,1970,282(3):111-117.
2 Kissmeyer-Nielsen F,Olsen S,Peterson VP,et al.Hyperacute rejection of kidney allografts associated with preexisting humoral antibodies against donor cells[J].Lancet,1966,2(7465):662-665.
3 Patel R,Terasaki PI.Significance of the positive crossmatch test in kidney transplantation[J].N Engl J Med,1969,280(14):735-789.
4 Terasaki PI,McClelland JD.Microdroplet assay of human serum cytotoxins[J].Nature,1964,204:998-1000.
5 Halloran PF,Wadgymar A,Ritchie S,et al.The significance of the anti-classⅠantibody response.Ⅰ.Clinical and pathologic features of anti-classⅠmediated rejection[J].Transplantation,1990,49(1):85-91.
6 Halloran PF. The clinicalimportanceofalloantibody-mediated rejection[J].Am J Transplant,2003,3(6):639-640.
7 Halloran PF,Schlaut J,Solez K,et al.The significance of anti-classⅠantibody response.Ⅱ.Clinical and pathologic features of renal transplants with anti-classⅠ-like antibody[J].Transplantation,1992,53(3):550-555.
8 Trpkov K,Campbell P,Pazderka F,et al.Pathologic features of acute renal allograft rejection associated with donor-specific antibody[J].Transplantation,1996,61(11):1586-1592.
9 Feucht HE,Felber E,Gokel MJ,et al.Vascular deposition of complement-split products in kidney allografts with cell-mediated rejection[J].Clin Exp Immunol,1991,86(3):464-470.
10 Feucht HE,Schneeberger H,Hillebrand G, et al.Capillary deposition of C4d complement fragment and early renal graft loss[J].Kidney Int,1993,43(6):1333-1338.
11 Collins AB,Schneeberger EE,Pascual MA,et al.Complement activation in acute humoral renal allograft rejection:diagnostic significance of C4d deposits in peritubular capillaries[J].J Am Soc Nephrol,1999,10(10):2208-2214.
12 Böhmig GA,Exner M,Habicht A,et al.Capillary C4d deposition in kidney allografts:a specific marker of alloantibody-dependent graft injury[J].J Am Soc Nephrol,2002,13(4):1091-1099.
13 Böhmig GA,Regele H,Exner M,et al.C4d-positive acute humoral renal allograft rejection:effective treatment by immunoadsorption[J].J Am Soc Nephrol,2001,12(11):2482-2489.
14 Takemoto SK,Zeevi A,Feng S,et al.National conference to assess antibody-mediated rejection in solid organ transplantation[J].Am J Transplantation,2004,4(7):1033.
15 Haas M,Mirocha J.Early ultrastructural changes in renal allografts:correlation with antibody-mediated rejection and transplant glomerulopathy[J].Am J Transplant,2011,11(10):2123-2131.
16 Kedainis RL,Koch MJ,Brennan DC,et al.Focal C4d+in renal allografts is associated with the presence of donor-specific antibodies and decreased allograft survival[J].Am J Transplant,2009,9(4):812-819.
17 Sis B,Jhangri GS,Bunnag S,et al.Endothelial gene expression in kidney transplants with alloantibody indicates antibody-mediated damage despite lack of C4d staining[J].Am J Transplant,2009,9(10):2312-2323.
18 Colvin RB.C4d in liver allografts:a sign of antibody-mediated rejection?[J].Am J Transplant,2006,6(3):447-448.
19郭晖,陈忠华,陈知水,等.移植肝穿刺活检268例次病理学观察[J]. 中华医学杂志,2011,91(48):3401-3405.
20 Neil DA,Hubscher SG.Histologic and biochemical changes during the evolution of chronic rejection og liver allografts[J].Hepatology,2002,35(3):639-651.
21 Nakazawa Y, Walker NI, Kerlin P, et al.Clinicopathological analysis of liver allograft biopsies with late centrilobular necrosis:a comparative study in 54 patients[J].Transplantation,2000,69(8):1599-1608.
22 Tan CD,Sokos GG,Pidwell DJ,et al.Correlation of donor-specific antibodies,complement and its regulators with graft dysfunction in cardiac antibody-mediated rejection[J].Am J Transplant,2009,9(9):2075-2084.
23 Michaels PJ,Espejo MJ,Kobashigawa BJ,et al.Humoral rejection in cardiac transplantation:risk factors,hemodynamic consequences and relationship to transplant coronary artery disease[J].J Heart Lung Transplant,2003,22(1):58-69.
24郭晖,周洪敏,昌盛,等.抗体介导的排斥反应所致的移植心脏组织病理学变化的观察[J].中华器官移植杂志,2012,33(7):417-421.
25 Rodriguez ER,Skojec DV,Tan CD,et al.Antibody-mediated rejection in human cardiac allografts:evaluation of immunoglobulins and complement activation products C4d and C3d as markers[J].Am J Transplant 2005,5(11):2778-2785.
