乌贼皮胶原蛋白的提取及结构表征
2012-09-15李和生张丽媛孙楠楠
雷 静,李和生,张丽媛,孙楠楠
宁波大学生命科学与生物工程学院,宁波 315211
乌贼皮胶原蛋白的提取及结构表征
雷 静,李和生*,张丽媛,孙楠楠
宁波大学生命科学与生物工程学院,宁波 315211
为了充分利用乌贼加工废弃物,分析了乌贼皮的基本组成成分,优化了从乌贼皮中提取胶原蛋白的工艺条件,并利用SDS-PAGE垂直电泳、紫外扫描和傅里叶变换红外光谱对所提取的胶原蛋白进行了结构表征。结果表明,乌贼皮中含有大量胶原蛋白,可作为胶原蛋白来源的补充。采用酸酶复合提取胶原蛋白的最佳条件为:酒石酸浓度为0.1 mol/L,胃蛋白酶添加量为1400 U/g,料液比为1∶20(m∶V,原料),4℃提取18 h,提取率为12.08%。SDS-PAGE垂直电泳、紫外扫描和傅里叶变换红外光谱的结果表明,采用酸酶复合法从乌贼皮中提取的胶原蛋白为Ⅰ型胶原蛋白,保持了完整的三螺旋结构。
胶原蛋白;乌贼皮;提取;结构表征
乌贼(Cuttlefish)又名墨鱼、花枝,具有较高营养和多种药用功能,其肉、蛋、脊骨(中药名为海螵蛸)均可进药。最常见的种类有金乌贼、曼氏无针乌贼等,是我国四大海产之一,广泛分布在我国各海区。乌贼加工会产生大量的下脚料,如乌贼皮、侧鳍、内脏、内骨骼等,如果不进行有效处理,不仅会造成环境的污染,而且会浪费大量的宝贵资源。有研究表明,占乌贼废弃物总量8% ~13%的乌贼皮中含有丰富的蛋白质资源,蛋白质含量约占乌贼皮干重的80%以上,主要是胶原蛋白[1]。胶原蛋白是一种天然高分子化合物,具有一定的凝胶强度、乳化性、吸水性和保湿性等,广泛应用于食品、医药、化妆品等工业中。胶原蛋白的提取方法一般有热水法、酸法、碱法、酶法等,其中酶法提取具有高效性、温和性,因而广泛用于食品加工中[2]。为了有效地利用资源,本研究以乌贼加工过程中产生的乌贼皮为原料,采用酸酶复合法提取胶原蛋白,考察酸浓度、加酶量、料液比及提取时间对胶原蛋白提取率的影响,优化提取的工艺条件,并对所提取的胶原蛋白结构进行初步鉴定。
1 材料与方法
1.1 材料与试剂
乌贼,品种为金乌贼(Sepia esculenta),购买于宁波市庄市市场。将皮剥下后用自来水清洗数次,然后用剪刀将乌贼皮剪碎,再用自来水清洗干净,室温下晾干后储存在-20℃条件下备用。
胃蛋白酶(比活力1∶3000)南宁庞博生物有限公司;十二烷基硫酸钠(SDS)、Tris碱、丙烯酰胺、甲叉双丙烯酰胺、β-巯基乙醇、过硫酸铵、甘氨酸、考马斯亮蓝 R-250、溴酚蓝 上海捷瑞生物工程有限公司;其他试剂均为分析纯。
1.2 仪器与设备
T6新锐-可见分光光度计,北京普析通用仪器有限责任公司;H1650高速台式离心机,长沙湘仪离心机仪器有限公司;79480真空冷冻干燥机,美国Labconco公司;DYCZ-24D型电泳槽,DYY-6B型电泳仪,北京市六一仪器厂;Tanon-410型凝胶成像系统,上海天能科技有限公司;紫外-可见光谱仪,美国Varian公司;Tensor 27傅立叶红外光谱仪,德国布鲁克光谱仪器公司。
1.3 方法
1.3.1 乌贼皮基本成分测定
参照国家标准GB/T5009系列(2003年版),水分测定采用直接干燥法;灰分测定采用灰化法;粗蛋白测定采用微量凯氏定氮法;粗脂肪测定采用索氏抽提法;总糖测定采用苯酚硫酸法。
1.3.2 前处理[3]
以下操作过程均在4℃下进行。称取20 g碎乌贼皮,加4倍质量的水组织捣碎,用料液比为1∶30 (鱼皮原重:盐溶液体积)的0.1 mol/L NaCl溶液,浸泡3 h,离心,取沉淀用相同溶液重复操作一次。除杂后样品,按照原皮重量,以1∶20的料液比加入0.01 M NaOH溶液(含1%H2O2),浸泡12 h,水洗至中性后离心。取沉淀加冰水至200 g,间歇匀浆,制成10%匀浆液备用。
1.3.3 胶原蛋白的提取[4-6]
选择酸加胃蛋白酶复合提取胶原蛋白。实验均在4℃进行。
准确称取10 g乌贼皮匀浆液,按设定的提取条件(酸浓度、料液比、加酶量、提取时间)进行实验,离心分离后得上清液,测定上清液中胶原蛋白含量和杂蛋白含量。提取液中胶原蛋白含量越大,提取率越高;杂蛋白含量越小,溶出率越低,提取纯度越高。提取后的胶原蛋白溶液,加氯化钠-酒石酸溶液使最终盐浓度为0.9 mol/L,搅拌5 min后4℃静置过夜。盐析后离心,沉淀用0.1 mol/L酒石酸溶解后移入透析袋,用pH 7.2的磷酸缓冲液透析1 d,再用蒸馏水透析2 d,每天更换透析液3~4次。冷冻干燥后备用。
1.3.4 测定方法
1.3.4.1 胶原蛋白的测定
羟脯氨酸是胶原蛋白的特征氨基酸,通过测定羟脯氨酸的含量,再乘以换算系数,即可得到胶原蛋白的含量。采用氯胺T法[7]测定羟脯氨酸。
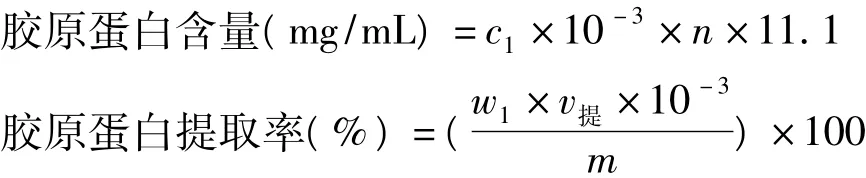
式中:c1为标准曲线上相对应的羟脯氨酸的含量(μg/mL);n为稀释倍数;11.1为换算系数;w1为提取液的胶原蛋白含量(mg/mL);v提为提取液的总体积(mL);m为乌贼皮质量(g)。
1.3.4.2 蛋白质的测定
胶原提取液中杂蛋白含量的测定,采用考马斯亮蓝法,按下式计算:
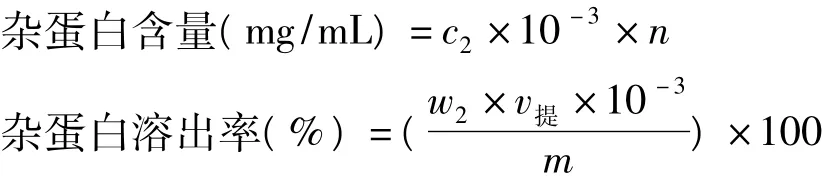
式中:c2为标准曲线上相对应的蛋白质含量(μg/mL);n为稀释倍数;w2为胶原提取液中杂蛋白含量(mg/mL);v提为提取液的总体积(mL);m为乌贼皮质量(g)。
1.3.5 乌贼皮胶原蛋白的结构表征[8]
1.3.5.1 SDS-PAGE电泳分析
1.3.5.2 紫外吸收光谱分析
将冻干的胶原蛋白样品溶于0.1 mol/L酒石酸溶液中,配成1 mg/mL胶原溶液,在190~400 nm的近紫外区进行扫描。
1.3.5.3 傅里叶变换红外光谱(FT-IR)分析
微量胶原样品经KBr压片后,用傅里叶变换红外光谱仪在4000~400 cm-1范围内扫描图谱。
2 结果与分析
2.1 乌贼皮基本组成分析
从表1中可看出,乌贼皮含有大量水分,干物质占20.38%。粗蛋白含量为16.65%,约占乌贼皮干重的81%。羟脯氨酸的含量为1.17%,而鱼类胶原的平均换算系数为11.1[9],经估算得胶原含量约为13%,约占乌贼皮蛋白质总量的78%,因此,从乌贼皮中提取胶原蛋白具有可行性。

表1 乌贼皮基本成分Table 1 The basic composition of cuttlefish skin
2.2 乌贼皮胶原蛋白提取条件优化
2.2.1 酸种类的选择
产业扶贫是我国长期扶贫开发实践中逐步形成的专项扶贫开发模式之一,是打赢脱贫攻坚战的一项利器。然而,总结各地产业扶贫实践,也存在一些共性问题。我们要基于问题导向,更好处理三种关系,以发挥产业扶贫的更大效力。
分别用醋酸、柠檬酸、苹果酸、酒石酸、乳酸在相同条件下提取(空白pH为2),酸浓度均为1.0 mol/ L,加酶量均为1400 U/g(酶/底物),料液比为1∶10 (W∶V=原皮重量∶酸溶液),酸酶同时作用,4℃提取12 h。五种酸作为介质与胃蛋白酶共同作用提取乌贼皮中胶原蛋白,实验结果见图1。其中,酒石酸与胃蛋白酶共同作用效果最好,提取液胶原蛋白含量最高,胶原提取率为7.92%。因此选择酒石酸进行后续实验。
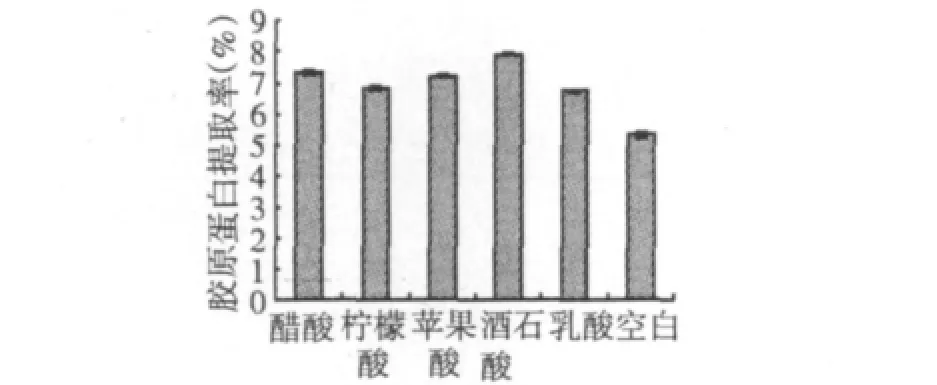
图1 不同酸对胶原蛋白提取的影响Fig.1 Effect of different acid on the extraction of collagen
2.2.2 酸浓度的确定
称取等量前处理后的乌贼皮匀浆液,按照乌贼皮原重计算,加酶量为1400 U/g(酶/底物),料液比为1∶10(W∶V),酒石酸溶液浓度分别为0.1、0.5、1.0、1.5和2.0 mol/L,4℃提取18 h。按此条件进行实验,结果见图2。
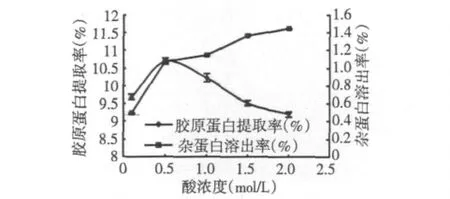
图2 酸浓度对胶原蛋白提取的影响Fig.2 Effect of acid concentration on the extraction of collagen
由图2可见,酸浓度为0.5 mol/L时,胶原蛋白提取率最高,此后随着酸浓度的增加,胶原蛋白提取率降低;可能是因为加入0.5 mol/L酒石酸后,提取液的pH最适宜胃蛋白酶作用。随着酸浓度的增加,杂蛋白溶出率不断升高,说明溶出了更多非胶原蛋白。综合考虑胶原蛋白的得率和纯度,选择0.5 mol/L酒石酸为最适酸浓度。
2.2.3 料液比的确定
称取等量前处理后的乌贼皮匀浆液,按照乌贼皮原重计算,加酶量为1400 U/g(酶/底物),酒石酸溶液浓度为1.0 mol/L,料液比(W∶V)分别为1∶10、1∶15、1∶20、1∶25、1∶30、1∶40、1∶50,4℃提取18 h。按此条件进行实验,结果见图3。

图3 料液比对胶原蛋白提取的影响Fig.3 Effect of liquid ratio on the extraction of collagen
由图3可见,料液比为1∶20(W∶V)时,胶原蛋白提取率最高,此后随着料液比(W∶V)的减小,提取率降低;可能是因为加入过多的酸溶液后稀释了反应液,反而降低了酶的作用。同时,料液比为1∶20时,杂蛋白溶出率也最小,随着料液比(W∶V)的减小提取液中杂蛋白含量略有增加。综合考虑胶原蛋白的得率和纯度,选择1∶20(W∶V)为最适料液比。
2.2.4 加酶量的确定
称取等量前处理后的乌贼皮匀浆液,按照乌贼皮原重计算,料液比为1∶10(W∶V),酒石酸溶液浓度为0.5 mol/L,加酶量分别为700、1400、2100、3500、4200、5600 U/g(酶/底物),4℃提取18 h。按此条件进行实验,结果见图4。
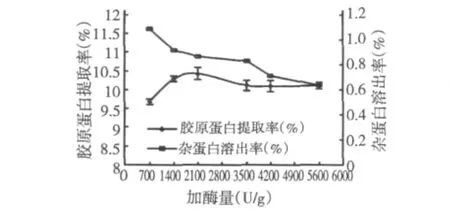
图4 加酶量对胶原蛋白提取的影响Fig.4 Effect of enzyme dosage on the extraction of collagen
由图4可见,加酶量为2100 U/g时,胶原蛋白提取率最高,此后随着加酶量的增加,提取率基本保持不变;可能是因为料液比与加酶量的相互作用,当加酶量大于2100 U/g时,酶浓度已趋于饱和,使得部分胃蛋白酶无法充分作用。同时,随着加酶量的增加,杂蛋白溶出率相应减小,可能是部分胃蛋白酶作用于非胶原蛋白,降低了提取液中非胶原蛋白含量。综合考虑胶原蛋白的得率和纯度,选择2100 U/g为最适加酶量。
2.2.5 提取时间的确定
称取等量前处理后的乌贼皮匀浆液,按照乌贼皮原重计算,加酶量为1400 U/g(酶/底物),料液比为1∶10(W∶V),酸浓度为0.5 mol/L,4℃提取,提取时间分别为6、12、18、24、36和48 h。按此条件进行实验,结果见图5。

图5 提取时间对胶原蛋白提取的影响Fig.5 Effect of time on the extraction of collagen
由图5可见,提取时间小于18 h,胶原蛋白提取率随提取时间的增加而显著升高;提取时间大于18 h,随提取时间的增加,胶原蛋白提取率略有降低,可能是因为随着时间的增加,部分未钝化的内源酶对胶原蛋白发生了作用。当提取18 h后,酶与底物反应最充分,提取液中胶原蛋白含量最高,提取率最大;此时,胶原提取液中杂蛋白含量也最高。随着反应时间的延长,杂蛋白溶出率逐渐降低,可能是部分胃蛋白酶作用于非胶原蛋白。综合考虑胶原蛋白的得率和纯度,选择18 h为最适提取时间。
2.2.6 正交实验
根据单因素实验结果,选择酸浓度、加酶量、料液比和提取时间四个因素,每个因素确定3个水平,按L9(34)正交表进行正交实验,正交实验因素水平见表2。
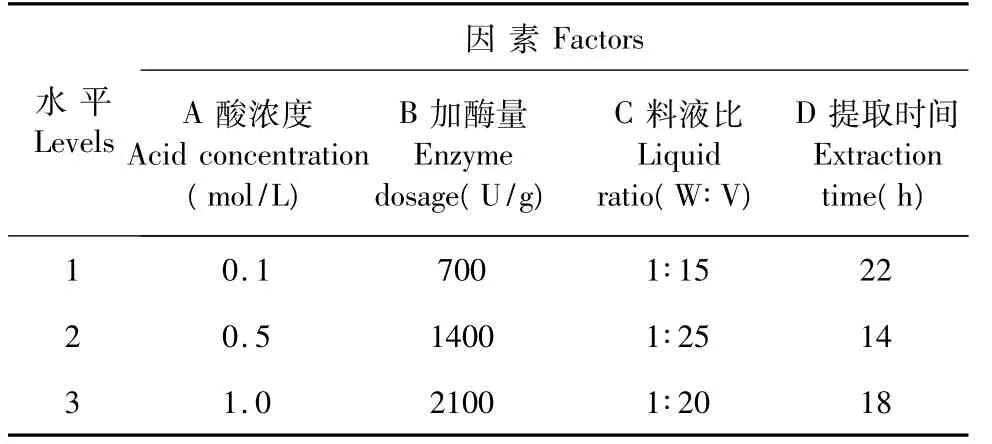
表2 正交实验因素水平表Table 2 Factors and levels of orthogonal test
实验均在4℃进行,离心后得上清液,测定上清液中胶原蛋白含量,计算提取率。正交实验结果见表3。
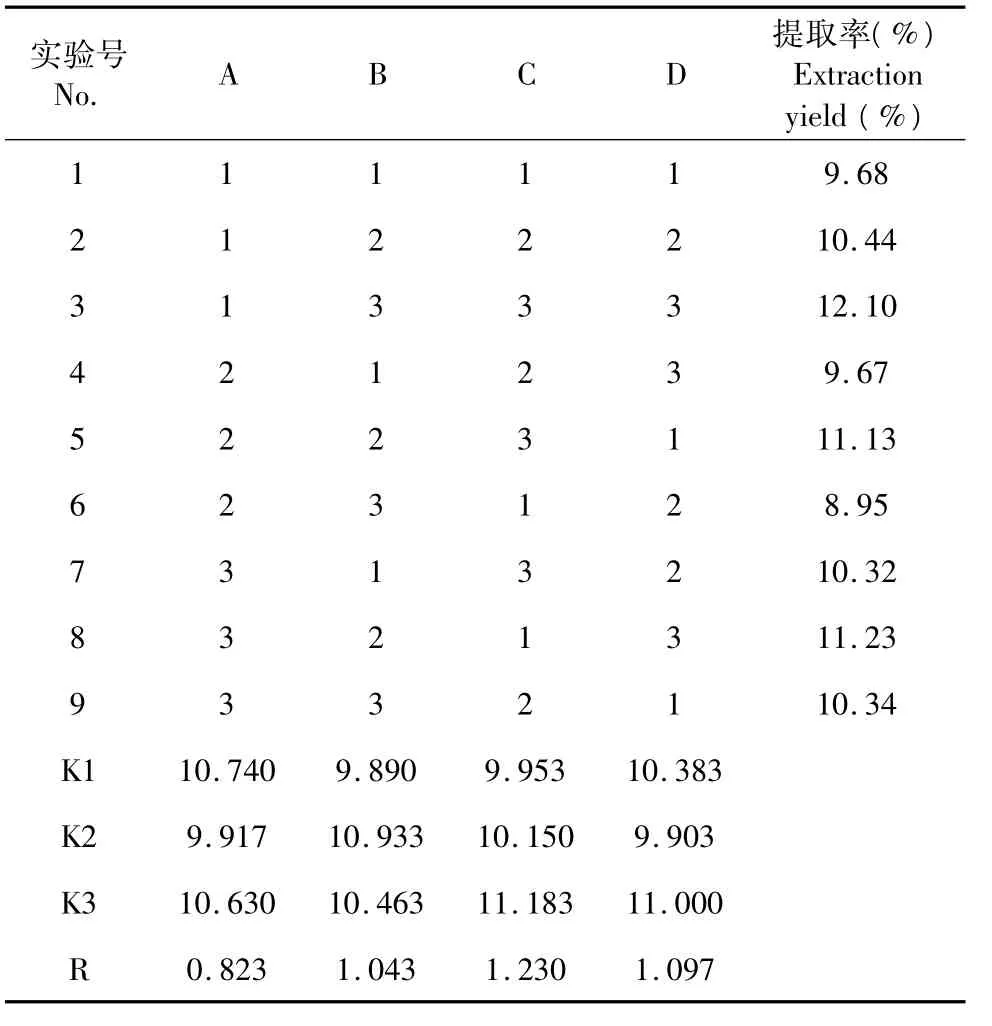
表3 正交实验结果Table 3 Results and range analysis of orthogonal test
由表3可知,实验极差因素C>D >B>A,说明影响提取因素排列依次为料液比 >提取时间 >加酶量 >酸浓度,根据K值,得出理论上最佳提取工艺条件为A1B2C3D3。所以,利用酒石酸-胃蛋白酶从乌贼皮提取胶原蛋白的较佳工艺为A1B2C3D3,即酒石酸溶液浓度为0.1 mol/L,加酶量为1400 U/g,料液比为1∶20,提取时间为18 h。重复最佳条件试验,获胶原蛋白提取率为12.08%。
2.3 乌贼皮胶原蛋白的结构表征
2.3.1 SDS-PAGE电泳分析
取冻干的胶原蛋白样品进行电泳分析,见图6。

图6 乌贼皮胶原蛋白的电泳图谱Fig.6 SDS-PAGE patterns of collagens from cuttlefish skin
如图6所示,乌贼皮胶原蛋白的电泳图谱由三条链组成,即α1(α2)、β以及少量的γ,α1、α2链的分子量在110-130 KD之间,β、γ链的分子量在200 KD以上,与其他来源胶原蛋白[6,10-12]的电泳谱带基本一致。与标准Ⅰ型胶原[13]比较,符合典型的Ⅰ型胶原蛋白的特征,表明提取出来的胶原蛋白主要是Ⅰ型胶原蛋白。图谱上无其他杂带,可见所提胶原蛋白纯度较高,达到了电泳纯。
2.3.2 紫外光谱分析
配制胶原蛋白溶液,进行紫外扫描。结果表明,乌贼皮胶原蛋白在234 nm波长处有强烈吸收,这与其他来源的胶原蛋白[6,8-9]的紫外吸收峰基本相似,与标准Ⅰ型胶原蛋白[14]比较,认为符合Ⅰ型胶原的特征紫外吸收。胶原蛋白紫外吸收的另一个特征是在250~290 nm之间几乎无吸收峰,因为色氨酸、酪氨酸和苯丙氨酸中的R基团含有苯环共轭双键系统,分别在283、278和259 nm处有吸收峰,其中以色氨酸在280 nm处吸收最强烈;而胶原蛋白不含色氨酸,酪氨酸含量较少。乌贼皮胶原蛋白在这个区域的紫外吸收较弱,与此特征符合。
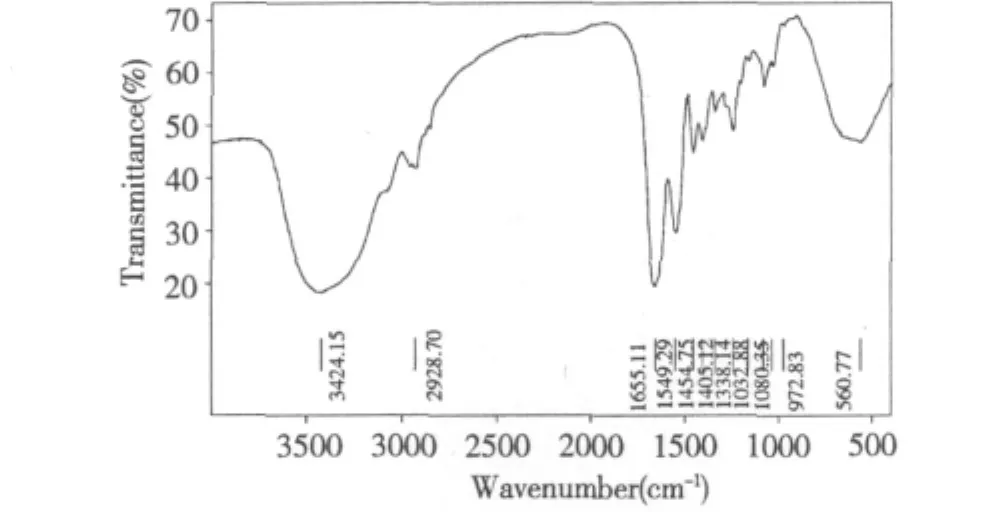
图7 乌贼皮胶原蛋白的红外图谱Fig.7 Fourier transform infrared spectrum of collagens from cuttlefish skin
2.3.3 傅里叶变换红外光谱(FT-IR)分析
取冻干的胶原蛋白样品进行红外光谱分析,见图7。
图7显示了乌贼皮胶原蛋白傅里叶变换红外光谱图,其中3424 cm-1处的强吸收是胶原蛋白酰胺A的N-H伸缩振动的吸收峰,2928 cm-1处的弱吸收是胶原蛋白酰胺B的C-N伸缩振动的特征吸收峰。酰胺Ⅰ带的特征吸收频率为1600-1700 cm-1,是由蛋白多肽骨架的C=O伸缩振动引起的;乌贼皮胶原蛋白的酰胺Ⅰ带位于1655 cm-1处,符合酰胺Ⅰ带的出峰位置。胶原蛋白的酰胺Ⅱ带出现在1454 cm-1处,它是由C-N伸缩振动和N-H弯曲振动共同引起的。由于胶原蛋白的甘氨酸和特征氨基酸羟脯氨酸、脯氨酸含量高,且形成独特的(Gly-Pro-Hyp)n序列,所以在1200~1400 cm-1光谱范围内,胶原蛋白具有特别的红外光谱特征。1200~1360 cm-1谱带属于酰胺Ⅲ,是由C-N伸缩和N-N弯曲引起的,归属于Gly骨架和Pro侧链的CH2摇摆振动峰也在此区域;乌贼皮胶原蛋白的酰胺Ⅲ带位于1241 cm-1处。
由于乌贼皮胶原蛋白的 FT-IR图谱中,出现1655、1241和1454 cm-1三个明显的吸收峰,分别位于酰胺Ⅰ、酰胺Ⅲ带和酰胺Ⅱ带的出峰位置,与文献中报道的鲤鱼鱼皮胶原蛋白[12]、狭鳕鱼皮胶原蛋白[15]、深海鲑鱼胶原蛋白[16]、尼罗河鲈鱼皮胶原蛋白[17]进行了比较,同时结合电泳图谱分析,表明乌贼皮胶原蛋白具有特殊的三螺旋结构。
3 结论
通过测定乌贼皮胶原蛋白的基本组成,可知乌贼皮中粗蛋白含量为16.65%(湿重计),约占干重的81%,其中胶原含量占乌贼皮蛋白质总量的78.13%。因此,从乌贼皮中提取胶原蛋白具有可行性。研究了从乌贼皮中提取胶原蛋白的工艺条件,结果表明,采用酸酶复合提取胶原蛋白的最佳条件为:酒石酸浓度为0.1 mol/L,胃蛋白酶添加量为1400 U/ g,料液比为1∶20,4℃提取18 h,胶原蛋白提取率为12.08%。同时对所提取的胶原蛋白进行了电泳图谱、紫外和红外光谱分析,结果表明所提取的乌贼皮胶原蛋白纯度较高,主要是Ⅰ型胶原,并具有特殊的三螺旋结构特征。
1 Hao ZL(郝振林),Zhang XM(张秀梅),Zhang PD(张沛东).Biological characteristics and multiplication techniques ofSepia esculenta.Chin J Ecology(生态学杂志),2007,26: 601-606.
2 Jiang DT(蒋挺大),Zhang CP(张春萍).The Collagen(胶原蛋白).Beijing:Chemical Industry Press,2001,1-60.
3 Zhang JZ(张建忠).Research on preparation and characterization of collagen from skin ofgrass carp.Nanjing:Nanjing Agricultural University(南京农业大学),PhD.2007.
4 Takeshi N,Eiji Y,Kei T,et al.Isolation and characterisation of collagen from the outer skin waste material ofcuttlefish(Sepia lycidas).Food Chem,2001,72:425-429.
5 Mario Hiram UM,Joe Luis AM,Maribel PJ,et al.Jumbo squid(Dosidicus gigas)mantle collagen:Extraction,characterization,and potential application in the preparation of chitosan-collagen biofilms.Bioresour Technol,2010,101:4212-4219.
6 Zhang JZ(张建忠),An XX(安辛欣),Wang L(王林)et al.Isolation and Characterization of Acid-soluble and Pepsinsoluble Collagens from Skin ofGrass Carp(Ctenopharyngodon idellus).Food Sci(食品科学),2006,12:556-558.
7 Yan MY(闫鸣艳).Study on the structure and physical properties of collagen fromwalleye pollock(Theragra chalcogramma)skin.Qingdao:Ocean University of China(中国海洋大学),PhD,2009.
8 Zhao YH(赵玉红),Gao T(高天).Characteristics of Collagen from Deer Bone.Food Sci(食品科学),2008,7:43-47.
9 Zhong ZH(钟朝辉),Li CM(李春美),Gu HF(顾海峰)etal.Extraction and Basic Properties of Pepsin-soluble Collagen fromGrass Carp(Ctenopharyndogon idellus)Scales.Fisheries Sci(水产科学),2007,2:91-95.
10 Yi JB(易继兵),Li BF(李八方),Zhao X(赵雪).Extraction and the physical and chemical characterization of collagen insnailfish.Sci Tech Food Ind(食品工业科技),2010,3:65-69.
11 Yang XQ(杨贤庆),Zhang S(张帅),Hao SX(郝淑贤)et al.Optimization of Extraction and Physicochemical Properties ofTilapiaSkin Collagen.Food Sci(食品科学),2009,16: 106-111.
12 Duan R(段蕊),Zhang JJ(张俊杰),Jin YJRY(今野久仁彦)et al.Characteristics Comparison of Pepsin-soluble Collagen from Skin and Bone ofCarp(Cyprinus Carpio).Food Ferm Ind(食品与发酵工业),2008,5:10-13.
13 Zhang H(张虹),Zhuo SZ(卓素珍),Dai ZY(戴志远).Extraction and Characterization of Collagen fromAnglerfish(Lophius Litulon)Skin.J Chin Inst food Sci Technol(中国食品学报),2009,9(6):34-41.
14 Liu LL(刘丽莉),Ma MH(马美湖),Yang XL(杨协力).Extraction and Characterization of TypeⅠCollagen fromBovineBone.Food Sci(食品科学),2010,2:87-92.
15 Yan MY,Li BF,Zhao X,et al.Characterization of acid-soluble collagen from the skin ofwalleye pollock(Theragra chalcogramma).Food Chem,2008,107:1581-1586.
16 Wang L,An XX,Yang FM,et al.Isolation and characterisation of collagen from the skin,scale and bone of deep-sea red fish(Sebastes mentella).Food Chem,2008,108:616-623.
17 Muyonga JH,Cole CGB,Duodu KG.Fourier transform infrared(FTIR)spectroscopic study of acid soluble collagen and gelatin from skins and bones of young and adultNile perch(Lates niloticus).Food Chem,2004,86:325-332.
Extraction and Characterization of Collagen from Skin of Sepia esculenta
LEI Jing,LI He-sheng*,ZHANG Li-yuan,SUN Nan-nan
Ningbo University,College of Life Science and Biotechnology,Ningbo 315211,China
In order to take full advantage of cuttlefish(Sepia esculenta)processing waste,the basic components of cuttlefish skin were analyzed and the extraction conditions for collagen from cuttlefish skin were optimized.Along with this,purified collagen was analyzed through SDS-PAGE vertical electrophoresis,UV scanning and FT-IR.The results showed that cuttlefish skin contained large amounts of collagen and it could be used as the source of complement for collagen.The optimum conditions for collagen with acid and pepsin were determined as follows:soaking cuttlefish skin in 0.1 mol/ L tartaric acid solution with a ratio of material to liquid of 1∶20(m∶V,raw materials)at 4℃ for 18 h,the 1400 U/g pepsin was added in the beginning for the restriction hydrolysis,and the extraction yield of collagen was 12.08%.SDSPAGE vertical electrophoresis,UV scanning and FT-IR results indicated that the extracted collagen was typeⅠcollagen and the unique triple helical structure of typeⅠcollagen remained well.
collagen;cuttlefish skin;extraction;structure characterization
TS254.9;Q58
A
1001-6880(2012)05-0575-06
2011-07-01 接受日期:2011-11-23
浙江省科技厅重大科技专项(2009C03017-3)
*通讯作者 Tel:86-532-88963253;E-mail:lihesheng@nbu.edu.cn
