蛋白酪氨酸磷酸酶SHP-2对AngⅡ刺激的心肌成纤维细胞增殖的影响*
2012-09-14张丽景金成艳王果元李全凤徐长庆
张丽景, 金成艳, 王果元, 吴 博, 李全凤, 徐长庆, 田 野, 张 力
(哈尔滨医科大学病理生理教研室,黑龙江哈尔滨150081)
心肌重塑是伴随和加重心力衰竭发展的一个重要过程,其中心肌纤维化是心肌重塑的一种形式。在心肌纤维化过程中,心肌成纤维细胞增殖,心肌间质胶原纤维沉积,心肌僵硬度增加,加重心脏功能障碍。因此揭示心肌成纤维细胞增殖的影响因素及机制是阻断这一过程的基础,将为改善心功能提供理论依据。
心肌成纤维细胞(cardiac fibroblasts,CFs)是心肌组织中的可分裂细胞,占心脏细胞总数的近70%。以往认为,CFs不像心肌细胞那样在心脏的功能中起着关键作用,但近年来的研究越来越多地集中到CFs上,并发现其与心肌细胞相互作用,在心肌细胞的功能调节中不可或缺[1-2]。导致心肌纤维化的心肌间质Ⅰ型和Ⅲ型胶原纤维主要是由CFs分泌的,而CFs被激活成心肌肌成纤维细胞的关键体液因子是血管紧张素 II(angiotensinⅡ,AngⅡ)[3]。但Ang II促心肌成纤维细胞增殖作用的细胞内机制不清。而含有Src同源结构域2的蛋白酪氨酸磷酸酶2(Src homology 2 domain-containing protein tyrosine phosphatase 2,SHP-2)是多种生长因子及细胞因子的细胞内共同细胞信号转导因子,并在促细胞增殖的细胞信号转导中起正相调节作用[4],因此我们提出假设,即Ang II对心肌成纤维细胞的作用是通过SHP-2调控的。
SHP-2是一种胞内型蛋白酪氨酸磷酸酶,含有2个Src同源结构域,可与磷酸化的酪氨酸残基结合,并转导信号,广泛存在于机体的各种组织和细胞中。大量文献报道,SHP-2与心脏疾病密切相关[5-7]。为验证我们的假说,我们在心肌成纤维细胞中过表达SHP-2,另外采用SHP-2的抑制剂,观察在血管紧张素Ⅱ作用下SHP-2对细胞增殖的影响。
材料和方法
1 材料
1.1 动物 1~3 d SD大鼠仔鼠,雌雄不限,由哈尔滨医科大学动物中心(许可证号为黑动字第80050/009)提供。
1.2 主要试剂 胰蛋白酶、MTT和AngⅡ均购自Sigma;DMEM培养基(高糖)、胎牛血清(fetal bovine serum,FBS)购自 HyClone;腺病毒 Ad-GFP、腺病毒野生型和突变型载体 pAd-GFP-SHP-2、pAd-GFP-SHP-2E76A由美国耶鲁大学Anton M.Bennet教授惠赠;SHP-2抑制剂NSC-87877购自Calbiochem;抗波形蛋白(vimentin)抗体购自博士德;免疫组化小鼠二步法检测试剂盒购自中杉公司。
2 方法
2.1 CFs原代培养 无菌条件下开胸取出仔鼠心脏,剪成4~6块,加入0.25%胰蛋白酶于37℃消化,所得的全部细胞用培养液悬浮,分种于25 cm2塑料培养瓶中,5%CO2培养箱内培养90 min,贴壁细胞即心肌成纤维细胞。用完全培养液(含10%胎牛血清、青霉素 1×105U/L、链霉素 100 mg/L的DMEM培养基)培养细胞2~3 d。当融合度达80%~90%,消化传代。第2~3代细胞用于实验。
2.2 CFs鉴定 待细胞铺满盖玻片的50% ~70%时,PBS洗5 min×3次,用4%多聚甲醛室温固定30 min。3%过氧化氢室温孵育5 min,PBS漂洗5 min×3次,滴加波形蛋白Ⅰ抗(1∶200),置4℃冰箱过夜;次日晨 PBS漂洗,加入Ⅱ抗,室温静置30 min;3,3'二氨基联苯胺(DAB)显色1 min,苏木素复染。PBS作为阴性对照。
2.3 细胞转染 在60 mm培养皿中按照1.0×105的密度接种细胞,将重组腺病毒Ad-GFP(GFP组)、野生型Ad-GFP-SHP-2(WT组)、突变型Ad-GFP-SHP-2-E76A(EA组)分别感染心肌成纤维细胞,培养4 h后,补加适当体积的完全培养基。48 h后通过倒置荧光显微镜观察绿色荧光蛋白(green fluorescent protein,GFP)表达情况。
2.4 Western blotting 收集细胞,冰上裂解细胞30 min;4℃ 12 000 r/min离心10 min,取上清液,测定蛋白含量;加入上样缓冲液沸水中煮沸5 min,进行SDS-PAGE电泳。300 mA恒流转膜;膜封闭1 h,然后加Ⅰ抗于4℃孵育过夜。次日晨加Ⅱ抗(辣根过氧化物酶标记)在摇床上孵育1 h,然后经ECL发光试剂(Pierce)显影,最后于暗室X线胶片感光。
2.5 MTT法测定细胞增殖率 细胞以1.0×104cells/well的密度接种于96孔板,待细胞贴壁至细胞融合达70% ~80%后,换无血清的培养液培养4 h。转染48 h、AngⅡ刺激 24 h、NSC-87877作用 24 h后,每孔加入MTT试剂(5 g/L)20 μL避光培养4 h。小心吸弃孔内上清,加入二甲基亚砜(DMSO)150 μL/well,振荡10 min,酶标仪检测490 nm吸光度值。细胞增殖率=(处理组A490/对照组A490)×100%。
2.6 实验分组 SHP-2过表达对细胞增殖作用分组如下:(1)无转染对照组(control组);(2)转染Ad-GFP对照组(GFP组);(3)转染Ad-GFP-SHP-2野生型组(WT组);(4)转染Ad-GFP-SHP-2-E76A突变体组(EA组);(5)AngⅡ组;(6)GFP+AngⅡ组;(7)WT+AngⅡ组;(8)EA+AngⅡ组。SHP-2抑制剂NSC-87877对AngⅡ刺激下细胞增殖作用的分组如下:(1)NSC-87877 0 μmol/L+AngⅡ组;(2)NSC-87877 25 μmol/L+AngⅡ组;(3)NSC-87877 50 μmol/L+AngⅡ组;(4)NSC-87877 75 μmol/L+AngⅡ组(AngⅡ浓度均为 10-7mol/L)。
3 统计学处理
结 果
1 CFs形态学观察及免疫细胞化学鉴定
大部分CFs分离培养90 min后贴壁,呈梭形,分布较均匀,散在生长。CFs生长迅速,2~3 d即呈融合状态,胞体大,胞质透明,细胞无自发性搏动,见图1A。免疫细胞化学染色显示,我们所分离的CFs波形蛋白呈阳性反应,即胞质内有大量棕黄色颗粒沉着,胞浆内可见棕色丝状或束状结构,阳性率在90%以上,见图1C。PBS作为阴性对照,可见清晰的长梭形细胞形态,胞浆和胞核蓝染,对照呈阴性,见图1B。
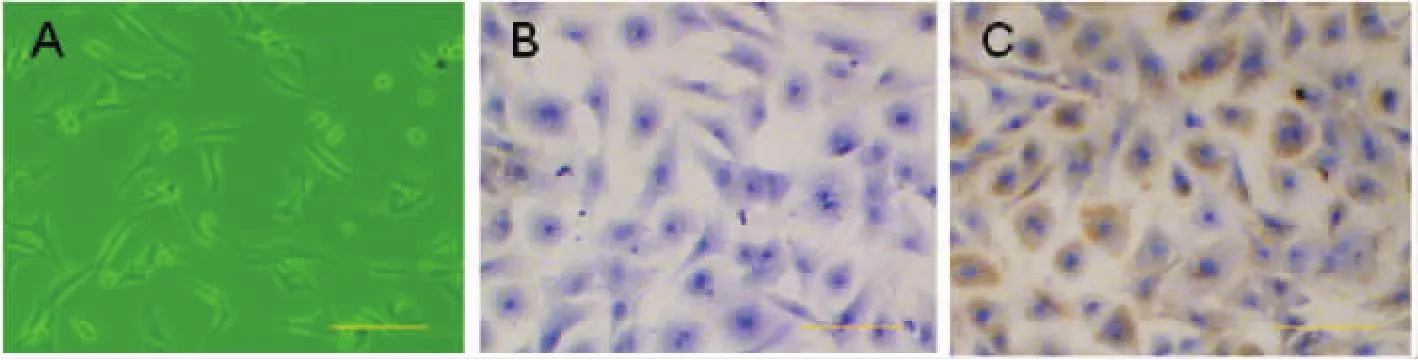
Figure 1.The morphology and identification of rat neonatal cardiac fibroblasts(×100).A:cardiac fibroblasts were cultured for 2 d and observed under a light microscope;B:negative control of immunochemical staining using PBS;C:the positive cells of vimentin immunochemical staining were more than 90%.Scale bar:10 μm.图1 心肌成纤维细胞形态及波形蛋白免疫细胞化学染色
2 AngⅡ促进心肌成纤维细胞增殖
AngⅡ在无血清培养下作用24 h。当AngⅡ浓度为10-9mol/L时,细胞的增殖作用明显高于对照组(P<0.01),呈现浓度依赖关系;当AngⅡ浓度达到10-7mol/L时,细胞的增殖率达到最大值(200% ±19%)。当继续增大AngⅡ浓度到10-6mol/L和10-5mol/L时,细胞活力反而降低,增殖率分别是191% ±18%和169% ±12%,但与无AngⅡ刺激的对照组相比,依然有明显的促增殖效果(P<0.01),见图2。因此,我们后续实验均采用浓度为10-7mol/L的AngⅡ。
3 SHP-2在CFs中的过表达
重组腺病毒[8]感染CFs时,我们优化了感染效率。当感染复数(multiplicity of infection,MOI)为100时,Ad-GFP、Ad-WT和 Ad-EA感染心肌成纤维细胞的转染效率都可达到90%左右,见图3A。
Western blotting结果显示,GFP组SHP-2的表达与对照组一致,是CFs内源性SHP-2的表达;WT组和EA组SHP-2的表达量明显增多(P<0.01),见图3B。
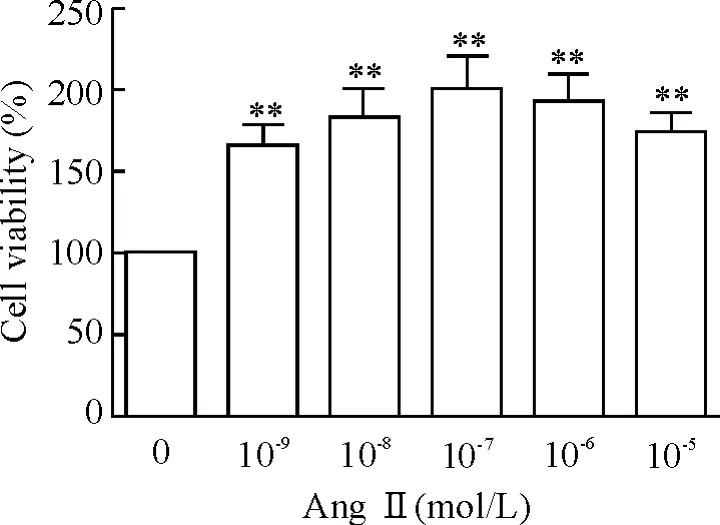
Figure 2.AngⅡ promoted cardiac fibroblast proliferation in a dose-dependent manner.±sE.n=3.**P<0.01 vs control group(AngⅡ=0 mol/L).图2 MTT法检测AngⅡ促进成纤维细胞增殖
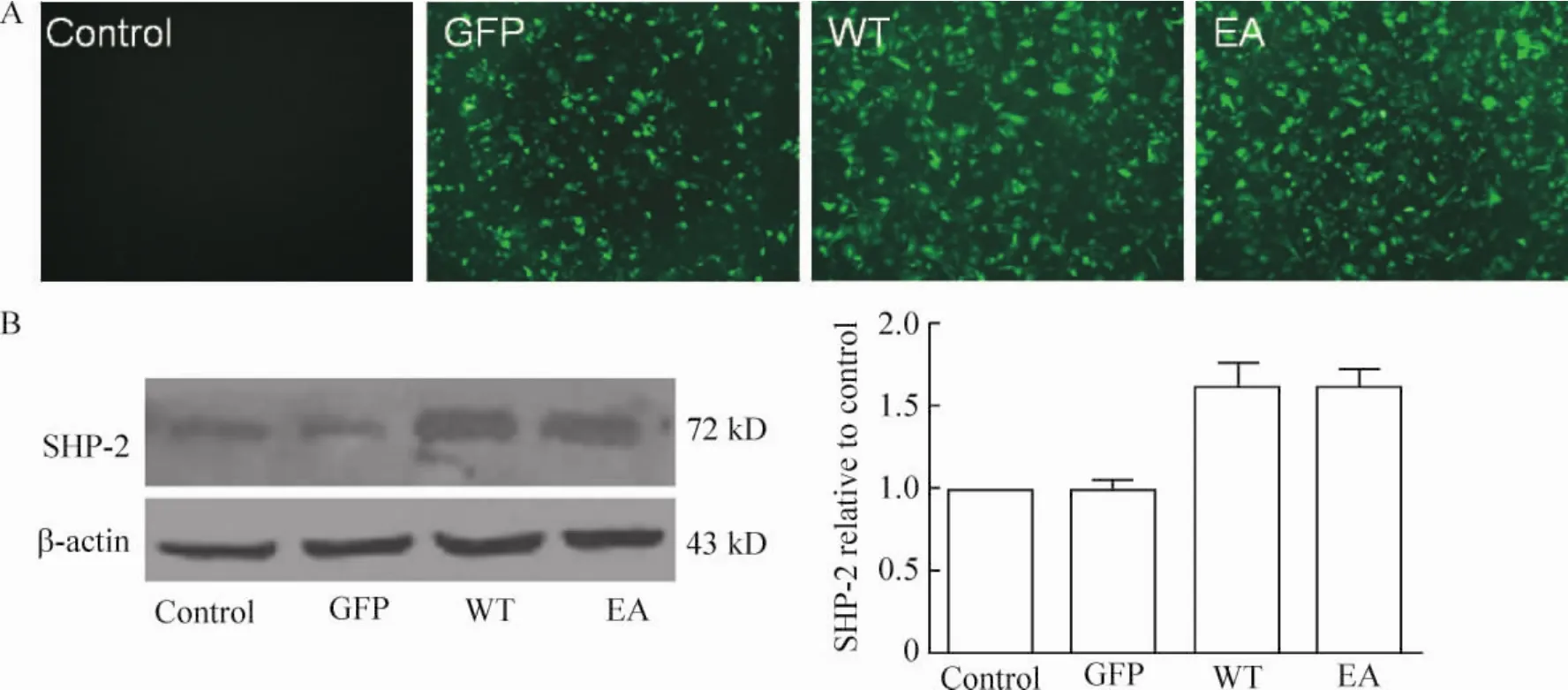
Figure 3.Overexpression of SHP-2 in cardiac fibroblasts by transfection of SHP-2 adenovirus and detection of expression of SHP-2.A:the transfection efficiency after 48 h of transfection(×40)was detected by green fluorescence emitted from the green fluorescent protein under a fluorescence microscope;B:expression of SHP-2 in cardiac fibroblasts.±sE.n=3.**P<0.01 vs control.图3 重组腺病毒转染心肌成纤维细胞及转染后SHP-2的表达
4 SHP-2过表达增强AngⅡ作用下CFs的增殖
与对照组相比,没有AngⅡ刺激、单纯转染组的CFs,即GFP组、WT组和EA组细胞增殖不明显(P>0.05);AngⅡ刺激后,其余各组增殖率明显增高;AngⅡ组与对照组以及GFP+AngⅡ组与GFP组相比,细胞都有明显增殖(P<0.01);与转染了空载体的GFP+AngⅡ组相比,转染了SHP-2的WT+AngⅡ组和转染了SHP-2-E76A突变体的EA+AngⅡ组增殖率分别是239% ±29%、279% ±12%,增殖率显著增加,另外,EA+AngⅡ组增殖率也明显高于WT+AngⅡ组(P <0.01),见图4。
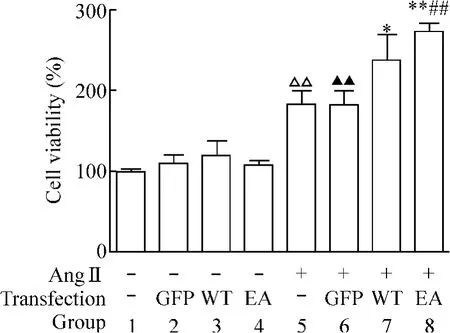
Figure 4.SHP-2 overexpression enhanced cardiac fibroblast proliferation upon AngⅡtreatment.±sE.n=3.△△P<0.01 vs group 1;▲▲P <0.01 vs group 2;*P <0.05,**P<0.01 vs group 6;##P<0.01 vs group 7.图4 SHP-2过表达对心肌成纤维细胞活力的影响
5 SHP-2抑制剂NSC-87877降低AngⅡ作用下CFs的增殖
在AngⅡ作用下,当抑制剂浓度为25 μmol/L时抑制细胞增殖;在浓度达50 μmol/L时,增殖率为60% ±8%,明显降低(P<0.01);当抑制剂浓度增大到75 μmol/L时,对细胞的抑制增殖率为66% ±8%,与50 μmol/L的浓度相比没有显著差异,但与对照组相比,抑制效果依然明显(P<0.01),见图5。
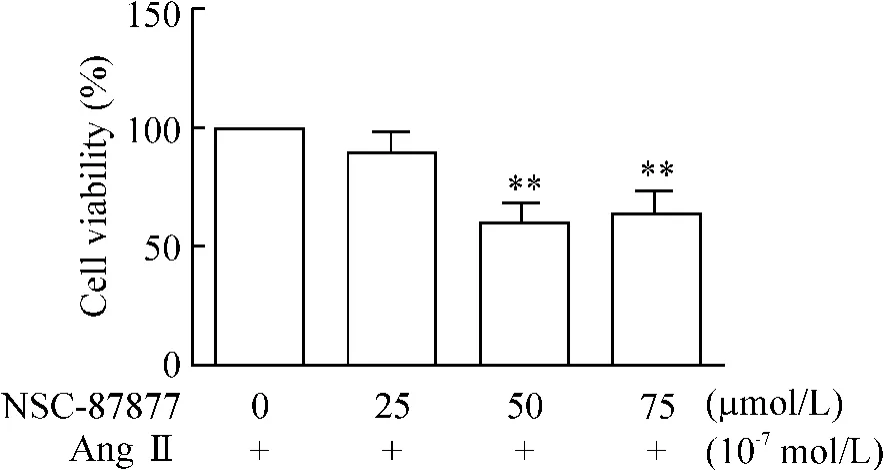
Figure 5.SHP-2 inhibitor NSC-87877 attenuated cardiac fibroblast proliferation induced by AngⅡ.±sE.n=3.**P <0.01 vs control group(NSC-87877=0 μmol/L).图5 SHP-2抑制剂NSC-87877对细胞增殖的影响
讨 论
心肌纤维化是恶化心力衰竭的一个过程。左室重构包括心肌重构和心肌间质重构,心肌间质重构的过程就是成纤维细胞过度增生和心肌纤维化发生发展的过程[9]。AngⅡ是导致心肌成纤维细胞增殖,进而导致心脏间质纤维化的主要体液因素。AngⅡ可显著刺激CFs增加DNA合成速率,并可促进CFs早期反应基因的表达,加速其增殖[10-11]。为明确细胞内参与细胞增殖的细胞信号转导因子SHP-2的作用,我们检测了SHP-2在 AngⅡ作用下对CFs的影响。
本实验首先通过原代培养,建立CFs的培养体系,并鉴定成纤维细胞的纯度达到90%以上,为后续实验奠定基础。有实验表明AngⅡ有促成纤维细胞增殖、胶原合成增多等作用[12]。为明确AngⅡ作用的最佳浓度,本研究进行了浓度梯度实验,确定了AngⅡ促增殖的最佳浓度为10-7mol/L。
我们采用重组腺病毒转染方法过表达SHP-2,而后检测SHP-2过表达对细胞增殖的影响。结果表明,SHP-2在AngⅡ作用下可明显促进细胞增殖。而在无AngⅡ作用下的SHP-2过表达的WT组和EA组,对细胞增殖作用不明显,这与SHP-2在基础状态下,N-SH2结构域与其酶解结构域相结合,而使其处于自我抑制状态有关[13]。只有当其与磷酸化底物结合时,这种自我抑制状态才能解除。有研究表明,AngⅡ可以增加AT1受体第319位点酪氨酸的磷酸化,进而激活AT1受体和EGFR之间的信号通路,文献推测SHP-2可以与AT1受体的pTyr-319结合[14]。由此提示,SHP-2可能是 AngⅡ致CFs增殖的细胞内关键因子。
我们又采用SHP-2抑制剂NSC-87877从反面测试我们的假设。结果显示,SHP-2抑制剂的加入明显抑制了AngⅡ刺激的CFs的增殖。虽然当NSC-87877浓度达到75 μmol/L时,这种抑制作用有所减低,但抑制效果依然显著,抑制增殖率与50 μmol/L相比,没有明显差异。正如文献报道,NSC-87877的最佳作用浓度为50 μmol/L,当浓度较高时,NSC-87877对SHP-1也有交叉抑制,即其抑制效应的特异性将降低[15]。
总之,我们的结果从一个侧面提示了AngⅡ作用的细胞内机制,但更深入的机制还有待探讨。
[1] Takeda N,Manabe I,Uchino Y,et al.Cardiac fibroblasts are essential for the adaptive response of the murine heart to pressure overload[J].J Clin Invest,2010,120(1):254-265.
[2] Brown RD,Ambler SK,Mitchell MD,et al.The cardiac fibroblast:therapeutic target in myocardial remodeling and failure[J].Annu Rev Pharmacol Toxicol,2005,45(2):657-687.
[3] Souders C,Bowers S,Baudino T.Cardiac fibroblast:the renaissance cell[J].Circ Res,2009,105(12):1164-1176.
[4] 祝晓春,张 力,司云凤,等.SHP-2通过ERK和JNK通路调节PC12细胞应对NGF的细胞生存和凋亡[J].中国病理生理杂志,2009,25(7):1348-1354.
[5] Tartaglia M,Mehler EL,Goldberg R,et al.Mutations in PTPN11,encoding protein tyrosine phosphatase SHP-2,cause Noonan syndrome[J].Nat Genet,2001,29(4):465-468.
[6] Tartaglia M,Niemeyer CM,Fragale A,et al.Somatic mutations in PTPN 11 in juvenile myelomonocytic leukemia,myelodysplastic syndromes and acute myeloid leukemia[J].Nat Genet,2003,34(2):148-150.
[7] Kosaki K,Suzuki T,Muroya K,et al.PTPN11(protein-tyrosine phosphatase,nonreceptor type 11)mutations in seven Japanese patients with Noonan syndrome[J].J Clin Endocrinol Metab,2002,87(8):3529-3533.
[8] 张 力,李全凤,李 弘,等.SHP-2重组腺病毒的包装及对心肌细胞的感染[J].哈尔滨医科大学学报,2010,44(6):524-526.
[9] 赵艳峰,徐 江,汤剑青,等.当归对大鼠心肌梗死后心肌纤维化的影响及机制[J].中国病理生理杂志,2005,22(10):1965-1969.
[10] 许 松,符民桂,许玉凤,等.钙调神经磷酸酶在血管紧张素Ⅱ刺激的心脏成纤维细胞增殖中的作用[J].生理学报,2000,52(4):305-307.
[11] Gohe C,Kahlert S,Lobbert K,et al.Angiotensin converting enzyme inhibition modulates cardiac growth[J].J Hypertens,1998,16(2):377-384.
[12] Bouzegrhane F,Thibault G.Is angiotensin II a proliferative factor of cardiac fibroblasts?[J].Cardiovasc Res,2002,53(2):304-312.
[13] Neel BG,Gu H,Pao L.The‘Shp’ing news:SH2 domain-containing tyrosine phosphatases in cell signaling[J].Trends Biochem Sci,2003,28(6):284-293.
[14] Seta K,Sadoshima J.Phosphorylation of tyrosine 319 of the angiotensinⅡtype 1 receptor mediates angiotensinⅡ-induced trans-activation of the epidermal growth factor receptor[J].J Biol Chem,2003,278(11):9019-9026.
[15] Chen LW,Sung SS,Yip ML,et al.Discovery of a novel Shp2 protein tyrosine phosphatase inhibitor[J].Mol Pharmacol,2006,70(2):562-570.
