血管内皮生长因子对大鼠卵巢组织自体移植后的形态与功能的影响*
2012-09-14邢卫杰蔡柳洪王文军麦美琪杨冬梓张清学
邢卫杰, 蔡柳洪, 李 予, 王文军, 麦美琪, 杨冬梓, 张清学△
(1中山大学附属第三医院不育与性医学科,广东广州510630;2中山大学附属第二医院生殖中心,广东广州510120)
随着医学技术的进步,许多肿瘤、严重血液病或者自身免疫性疾病得到了治愈,但是女性的卵巢功能却由于化学或物理治疗而遭到严重损害或衰竭,这使得卵巢功能的保护和生育能力的保存越来越受到重视[1]。目前研究最多的是卵巢组织冷冻保存与移植。尽管有很多实验表明,移植后的卵巢可以在宿主动物体内生存并且有卵泡生长发育,但是还有许多问题有待解决,比如:缺血再灌注损伤,它是移植后卵巢组织存活最大的威胁[2]。为探索减轻缺血再灌注损伤的方法,本实验在大鼠卵巢组织自体移植中使用血管内皮生长因子(vascular endothelial growth factor,VEGF),初步探讨其在卵巢组织自体移植中的应用价值。
材料和方法
1 动物及分组
健康成熟未交配过的清洁级雌性Sprague-Dawley(SD)大鼠,鼠龄70~80 d,体重190 ~220 g。给予标准光照(14 h光照、10 h黑夜)、室内温度(20±2)℃、湿度40% ~50%、标准饲料和水,饲养1周后开始实验。20只大鼠随机分为2组:新鲜卵巢移植组(A组):10只,去势后自体异位移植新鲜卵巢组织;新鲜卵巢移植加VEGF组(B组):10只,去势后自体异位移植新鲜卵巢组织,在移植前放入含0.1 μg VEGF(DSL)的5 mL PBS中浸泡5 min,而且移植手术后第1 d开始在移植物局部注射VEGF 0.2 μg,连用5 d。
2 方法
SD大鼠麻醉成功后固定,腹部剪毛,依次使用Ⅲ型安尔碘和75%乙醇消毒腹部皮肤,铺消毒洞巾。取下腹耻骨联合上1 cm做纵形切口,切口长约2~3 cm,进入腹腔。依次找出子宫、双侧输卵管和卵巢,暴露双侧卵巢,小心切除双侧卵巢及部分输卵管组织,结扎残端并充分止血。将获得的卵巢组织立即放入备好的PBS缓冲液中(B组获得的卵巢组织放入含0.1 μg VEGF的5 mL PBS中,在常温下浸泡5 min),在解剖显微镜下去除多余的脂肪组织、结缔组织和部分输卵管,游离出卵巢组织。用眼科剪把卵巢组织剪成约1 mm×1 mm×2 mm大小的组织块,部分置于10%甲醛固定以备做病理切片,部分做新鲜移植,移植时将处理好的新鲜卵巢组织包埋于腹部切口两侧的皮下与肌层之间,然后75%乙醇消毒皮肤,以丝线间断缝合关腹。术后3 d使用青霉素肌肉注射抗感染。
3 观察指标
3.1 SD大鼠的动情周期 各组SD大鼠自卵巢移植后,每日上午行阴道脱落细胞涂片,用小棉签蘸生理盐水涂阴道脱落细胞于载玻片上,晾干后用碱性美兰液(美兰3.0 g、95%乙醇30 mL、10%氢氧化钠0.1 mL和蒸馏水100 mL)中浸泡5 min,用清水冲洗后晾干,在普通光学显微镜下观察,根据角化细胞的比例来了解动情周期的情况[2]。
3.2 组织形态学 SD大鼠行卵巢组织移植后饲养4周。麻醉后切开腹部皮肤,观察移植的卵巢组织的生长发育情况及周围血供情况,并完整剥离移植物,放入10%甲醛液中保存,以作病理切片行组织学检查。
各级卵泡的形态学表现是[3]:始基卵泡:单层梭形前颗粒细胞包绕1个处于减数分裂双线期的初级卵母细胞;初级卵泡:1层立方形颗粒细胞包绕卵母细胞;次级卵泡:2层或2层以上的立方形的颗粒细胞包绕卵母细胞;窦卵泡:有多层颗粒细胞包绕卵母细胞,并有卵泡腔的形成。按 Gougeon[4]的标准,形态学正常的卵泡表现为:完整的卵母细胞,内见圆形细胞核及清晰的核仁,周围包绕的颗粒细胞排列规则,核无浓缩。形态学异常的卵泡表现为:卵泡结构不完整或消失,卵母细胞皱缩,卵母细胞核固缩,颗粒细胞排列紊乱。
3.3 血清中的雌二醇水平 SD大鼠行卵巢组织移植后,饲养4周。在取卵巢组织的同时取下腔静脉血约3 mL,用低温离心机3 000 r/min离心10 min,血清用放免试剂盒(DSL)测雌二醇水平。
4 统计学处理
结 果
实验过程中共有5只大鼠因麻醉意外、感染等死亡,其中A组3只、B组2只。
1 动情周期的恢复率
A组7只SD大鼠中共有6只恢复动情周期,动情周期恢复率为85.7%,有1只大鼠虽没有恢复动情周期,但是从其阴道脱落细胞涂片分析,角化细胞比例>50%,可以视为受雌激素影响,在一定程度上,可以认为已经恢复卵巢功能;B组中8只SD大鼠全部恢复动情周期,动情周期恢复率为100%。
2 移植4周后SD大鼠卵巢组织的大体标本观察
2.1 A组 移植4周后取标本时,移植物体积比移植前明显增大,移植前卵巢组织平均体积为(1.36±0.61)mm3,4 周后移植物平均体积为(13.30 ±7.19)mm3。移植物与周围组织边界清晰,表面可见细小的血管从周围组织中长入卵巢组织中。体积计算公式为:长 × 宽 × 高 ×0.52。
2.2 B组 移植4周后取标本时,移植物体积比移植前明显增大,移植前卵巢组织平均体积为(1.46±0.49)mm3,4 周后移植物平均体积为(40.04 ±30.46)mm3。移植物表面布满细小的血管,呈鲜红色,从表面偶可见到透明状囊性小卵泡,周围组织血供丰富。
比较移植前后的卵巢组织体积以及A组和B组移植后的卵巢组织体积大小,发现体积大小的差别有统计学意义(P<0.05),见表1。
表1 卵巢组织移植前后的体积比较Table 1.The comparison of ovarian size in the two groups before and after transplantation(±s)

表1 卵巢组织移植前后的体积比较Table 1.The comparison of ovarian size in the two groups before and after transplantation(±s)
*P <0.05 vs group A.
Group n Before transplantation(mm3)After transplantation(mm3)A 7 1.36 ±0.61 13.30 ±7.19 B 8 1.46 ±0.49 40.04 ±30.46*
3 新鲜卵巢组织移植后4周的形态学观察
光镜下:A组和B组中,均可见到正常形态的始基卵泡和生长卵泡(初级卵泡、次级卵泡、窦前卵泡和窦卵泡)。形态学正常的卵泡均有完整的卵母细胞,内见圆形的细胞核及清晰的核仁,周围包绕的颗粒细胞排列规则,核无浓缩。偶可见到异常形态的卵泡,见图1。
每个标本观察10个高倍镜视野,对各级卵泡进行计数,最后分别计算出各组中形态正常的卵泡所占比例,见表2。统计学分析发现各级正常形态卵泡所占的比例在2组之间的差异均没有统计学意义,但是从表2可以看出,B组中移植后正常形态的窦卵泡所占比例与A组移植后相比有增高趋势。
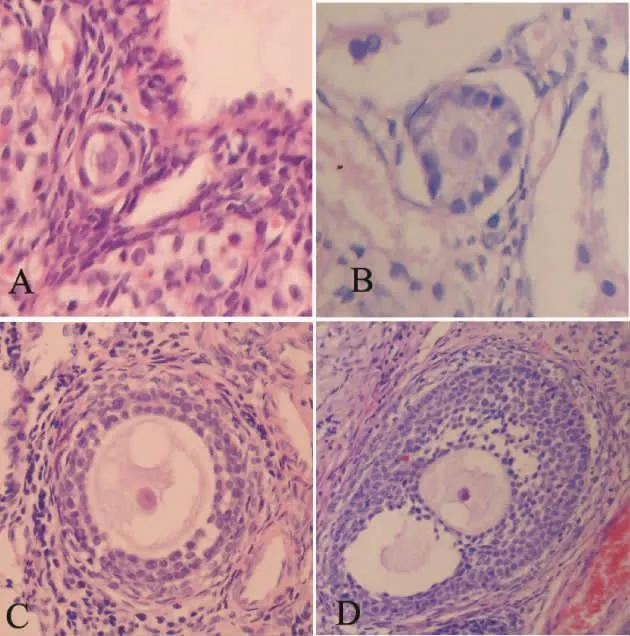
Figure 1.Normal follicles in the two groups(×400).A:primordial follicles,with one layer of flattened granulosa cells around the oocyte(group A);B:primary follicles,with one layer of cuboidal granulosa cells around the oocyte(group A);C:secondary follicles,with two or more layers of cuboidal granulosa cells around the oocyte(group B);D:antral follicles,with an antral cavity formed as a result of coalescence of the fluidfilled spaces(group A).图1 2组中形态正常的卵泡
表2 2组正常形态卵泡所占比例Table 2.The proportion of normal follicles in the two groups(%.±s)
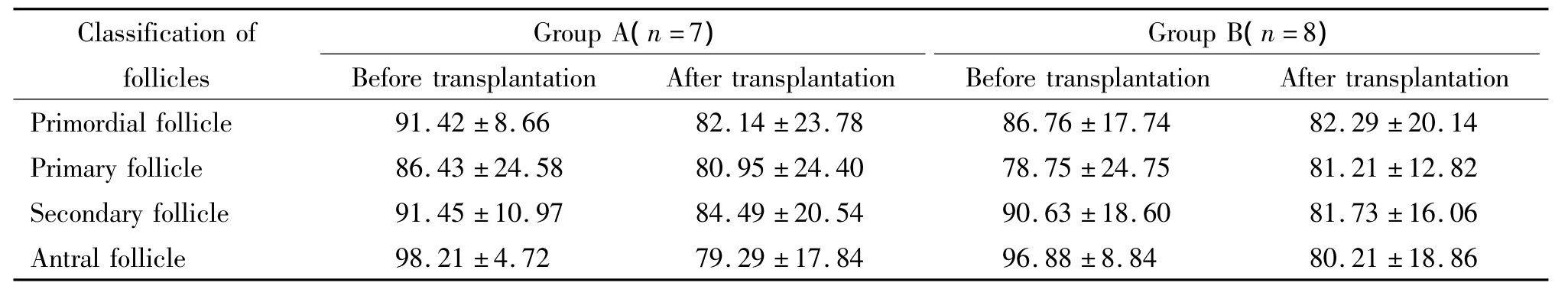
表2 2组正常形态卵泡所占比例Table 2.The proportion of normal follicles in the two groups(%.±s)
Classification of follicles Group A(n=7)Group B(n=8)Before transplantation After transplantation Before transplantation After transplantation Primordial follicle 91.42 ±8.66 82.14 ±23.7886.76 ±17.74 82.29 ±20.14 Primary follicle 86.43 ±24.58 80.95 ±24.40 78.75 ±24.75 81.21 ±12.82 Secondary follicle 91.45 ±10.97 84.49 ±20.54 90.63 ±18.60 81.73 ±16.06 Antral follicle 98.21 ±4.72 79.29 ±17.84 96.88 ±8.84 80.21 ±18.86
4 卵巢组织移植4周后血清雌二醇的测定结果
A组雌二醇平均水平为 (6.64±2.53)ng/L;B组雌二醇平均水平为(10.70±3.10)ng/L,2组的雌二醇水平差异有统计学意义(P<0.05)。
讨 论
1 缺血再灌注损伤对卵巢组织移植的影响
卵巢组织移植过程中的卵泡丢失与移植物局部缺血缺氧的持续时间,即血管长入移植物所用的时间有关,受血管生长因子的调节。有学者认为:缺血再灌注损伤是移植后卵巢组织存活的最大威胁,由于存在缺血再灌注损伤,移植后卵巢组织的体积比移植前缩小30%~70%,并且卵巢组织出现明显的纤维化,严重影响卵泡的生长发育及卵巢功能的恢复。有研究表明窦前卵泡死亡主要是由于缺血再灌注损伤造成,而不是由于冷冻损伤本身[5]。因此,怎样有利于血管生成以及避免缺血再灌注损伤成为移植中的关键问题。
2 VEGF的生理作用
为了找出减少缺血再灌注损伤的方法,有学者对此进行了一些研究。Schnorr等[6]用猴子做实验,卵巢自体移植后应用VEGF,结果显示实验组与对照组中卵巢功能恢复的比例没有显著差别,但是在卵巢功能恢复的猴子中,使用VEGF的猴子体内激素水平比不使用VEGF的激素水平显著升高,说明VEGF对促进移植后卵巢功能的恢复有一定的作用。VEGF是高度特异性的血管内皮细胞生长因子,是血管生成开关的主要成分,它作用最强大,可能是最初起始血管生成一系列反应的信号因子,具有以下几种功能:(1)促进内皮细胞的增殖;(2)增加微血管通透性;(3)改变细胞外基质;(4)维持血管生成等作用。动物实验表明:VEGF及转化生长因子-β1(TGF-β1)等的存在有助于提高血管长入的速度,促性腺激素可调节卵巢内血管生长因子水平,从而可以促进血管生成[7]。
3 VEGF对移植卵巢组织的作用
在大鼠卵巢组织移植实验的研究中发现,血管重建一般发生于移植后的48 h内,需要的时间超过24 h,约有50%的始基卵泡由于缺血再灌注损伤而丢失[8]。另外有实验发现:VEGF是在移植后早期(48 h内)对血管重建起关键作用,血管生长因子(如:VEGF、TGF等)的合成应在移植前达到有效浓度,并维持一定时间,以诱导新血管形成,减轻局部缺血缺氧的发生[7]。根据以上理论基础,而且依据Schnorr等[6]的实验中应用的VEGF浓度,本实验中B组中大鼠的卵巢组织,在移植之前放入含有0.1 μg VEGF的5 mL PBS中浸泡,使其充分接触VEGF,使VEGF在移植前达到有效浓度,而术后继续局部注射VEGF使之维持在一定的浓度,以减少血管重建所需时间,进而减轻由于缺血时间过长而造成的卵泡丢失和卵巢组织的损伤。本实验结果发现:B组中SD大鼠的雌二醇水平明显高于A组;A组和B组移植后的卵巢体积明显大于移植前的卵巢体积,且B组移植后的卵巢体积明显大于A组,其差别均有统计学意义(P<0.05)。此外,B组中移植后正常形态的窦卵泡所占比例与A组移植后相比有增高趋势。肉眼观察移植物,发现B组中的移植物表面布满细小的新生血管,且B组中移植物周围组织血供丰富,有许多小血管从周围组织中长入移植物中。
本实验结果证明,在卵巢组织移植过程中使用VEGF,可以减少因缺血再灌注而造成对卵巢组织的损伤,可以在一定程度上促进卵巢组织功能的恢复。在以后的实验中可以根据不同浓度梯度进行分组,以找到VEGF的最佳浓度,使之发挥更好的促进血管重建的作用。
[1]Dolmans MM,Yuan WY,Camboni A,et al.Development of antral follicles after xenografting of isolated small human preantral follicles[J].Reprod Biomed Online,2008,16(5):705-711.
[2]Newton H,Aubard Y,Rutherford A,et al.Low temperature storage and grafting of human ovarian tissue[J].Hum Reprod,1996,11(7):1487 -1491.
[3]Smitz JE,Cortvrindt RG.The earliest stages of folliculogenesis in vitro[J].Reproduction,2002,123(2):185 -202.
[4]Gougeon A.Dynamics of follicular growth in the human:a model from preliminary results[J].Hum Reprod,1986,1(2):81-87.
[5]van Eyck AS,Jordan BF,Gallez B,et al.Electron paramagnetic resonance as a tool to evaluate human ovarian tissue reoxygenation after xenografting[J].Fertil Steril,2009,92(1):374-381.
[6]Schnorr J,Oehninger S,Toner J,et al.Functional studies of subcutaneous ovarian transplants in non-human primates:steroidogenesis,endometrial development,ovulation,menstrual patterns and gamete morphology[J].Hum Reprod,2002,17(3):612 -619.
[7]Dissen GA,Lara HE,Fahrenbach WH,et al.Immature rat ovaries become revascularized rapidly after autotransplantation and show a gonadotropin-dependent increase in angiogenic factor gene expression[J].Endocrinology,1994,134(3):1146-1154.
[8]Gosden RG.Low temperature storage and grafting of human ovarian tissue[J].Mol Cell Endocrinol,2000,163(1):125-129.
