蒲公英汁的加工工艺*
2012-09-12林春梅孟婉静
林春梅,孟婉静
1(淮海工学院食品工程学院,江苏 连云港,222005)
2(鲁东大学大学外语教学部,山东烟台,264025)
蒲公英汁的加工工艺*
林春梅1,孟婉静2
1(淮海工学院食品工程学院,江苏 连云港,222005)
2(鲁东大学大学外语教学部,山东烟台,264025)
以干燥蒲公英叶子为原料,使用纤维素酶处理、壳聚糖澄清、微孔滤膜过滤等方法,围绕酶用量对蒲公英汁中绿原酸和总黄酮含量的影响,壳聚糖对蒲公英汁的澄清效果,澄清、过滤等对蒲公英汁品质影响等问题进行了研究。得出料液比1∶30和温度50℃条件下,随着纤维素酶用量的增加,蒲公英汁中绿原酸和总黄酮含量增加,当酶用量达1%后,蒲公英汁中绿原酸和总黄酮含量基本稳定;低分子量壳聚糖澄清效果优于高分子量壳聚糖,最佳的澄清工艺条件是低分子量壳聚糖加入量0.4g/L,温度50℃,时间40 min,此条件下得到的蒲公英汁澄清度96.4%,绿原酸含量为0.50 mg/mL,总黄酮含量为0.55 mg/mL,损失分别为26.47%和14.06%;0.45 μm混合微孔滤膜过滤后蒲公英汁澄清度为98.1%,绿原酸含量为0.4962mg/L,损失率为27.03%,总黄酮含量为0.5304mg/L,损失率为17.13%,进一步提高了汁液澄清度,并基本保持了蒲公英主要功能性成分的含量。
蒲公英,纤维素酶,壳聚糖,绿原酸,总黄酮
蒲公英(dandelion)属菊科植物蒲公英(Taraxacum Mongolicum Hand.-Mazz)、碱地蒲公英(Taraxacum Sinicum Kitag),或同属数种植物的干燥全草,原产于欧洲西部和亚洲北部,欧洲、亚洲、美洲大陆分布广泛,田间地头、花园、路边随处可见,我国大部分地区有分布[1-2]。蒲公英化学成分主要有蒲公英甾醇、蒲公英苦素、胆碱、菊糖、肌醇、咖啡酸、绿原酸、黄酮类等。据报道,类黄酮具有很多生物活性:抗癌抗肿瘤、抗炎镇痛、免疫调节、降血糖、抑菌抗病毒、抗衰老等[3-5]。绿原酸是一类由咖啡酸与奎尼酸形成的酯类化合物,具有清热解毒、抗菌消炎、抗衰老等的药理作用,用于食品工业还有增香护色、抗氧化等作用[6-9]。所以,蒲公英一直是医药界开发利用的重要中草药资源,同时,蒲公英也是营养保健蔬菜,含丰富的蛋白质、灰分、膳食纤维、钙、磷,亚麻酸等,FAO推荐蒲公英作为一种食物来源用于色拉制作[1]。目前,国内外已先后开发出蒲公英饮料、蒲公英酒、咖啡、糕点、蒲公英花粉和蒲公英根粉等保健食品,受到各界人士的青睐[10-14]。其中,蒲公英饮料是研究最多的课题,大多数研究以新鲜蒲公英叶子为原料,用水浸提,不但限制了原料的周年供应,而且功能性成分溶出有限;另外,以新鲜的叶子压榨出的汁有青草的味道,影响了饮料的色泽和风味[15]。本研究以干燥的蒲公英叶子为原料,利用纤维素酶对植物细胞壁的酶解作用,增加功能性成分的溶出量,并用壳聚糖对酶解液进行澄清,避免了加工过程产生沉淀的问题,以0.45μm的微孔滤膜进行无菌真空抽滤有效去除了大多数细菌微生物,避免了高温灭菌对功能性成分的破坏,得到气味纯正、便于储存、质量稳定的亮橙黄色蒲公英汁,加工用水为去离子水,所得澄清汁可直接用于饮料的调配。
1 材料与方法
1.1 材料和试剂
蒲公英:2011年春季采于山东烟台郊区农田;纤维素酶35KU Japan北京梦怡美生物科技有限公司分装;绿原酸标准品,纯度>98%,北京中科三捷生物有限公司;芦丁标准品,上海沪宇生物试剂公司;高分子量壳聚糖(CTS)、低分子量壳聚糖(WSC)山东奥康生物科技有限公司;无水甲醇、柠檬酸、亚硝酸钠、硝酸铝、氢氧化钠均为分析纯(AR)。
1.2 仪器和设备
XFB-400小型粉碎机,长沙市雨花区中诚制药机械厂;ZFD-5040电热鼓风干燥箱,上海绿宇精密仪器制造有限公司;数显恒温水浴锅(HW·YS),浙江舟山市定海区海源仪器厂;T6新世纪紫外可见分光光度计,北京普析通用仪器有限公司;wi3058809全玻璃砂芯过滤装置,东西仪(北京)科技有限公司;0.45 μm微孔滤膜(50)北京中西远大科技有限公司。
1.3 研究方法
1.3.1 蒲公英预处理
取山东烟台郊区农田采挖未开花蒲公英全草适量,洗净去杂去根,置电热鼓风干燥箱中45℃烘24h,使含水量降至1%以下,粉碎,过40目筛,备用。
1.3.2 绿原酸标准曲线的绘制[4]
用万分之一的天平精密称取绿原酸42.5 mg,50%的甲醇溶解,并定容于1000 mL棕色容量瓶中,摇匀,得到绿原酸标准液(42.5mg/L)。取适量绿原酸标准液于500~200 nm内扫描,以50%的甲醇溶液作参比测定绿原酸的吸光度,绿原酸在327 nm处有最大吸收峰,故选择327 nm为测定波长。
标准曲线的制定:精密吸取以上绿原酸标准液0.0、1.5、2.0、3.0、5.0、6.5 mL,分别置于 10 mL 容量瓶中,加50%甲醇定容,摇匀。在327 nm处分别测定不同浓度标准溶液的吸光光度值,以绿原酸标准样品含量(μg/mL)为横坐标,吸光光度值为纵坐标绘制标准曲线,见图1。
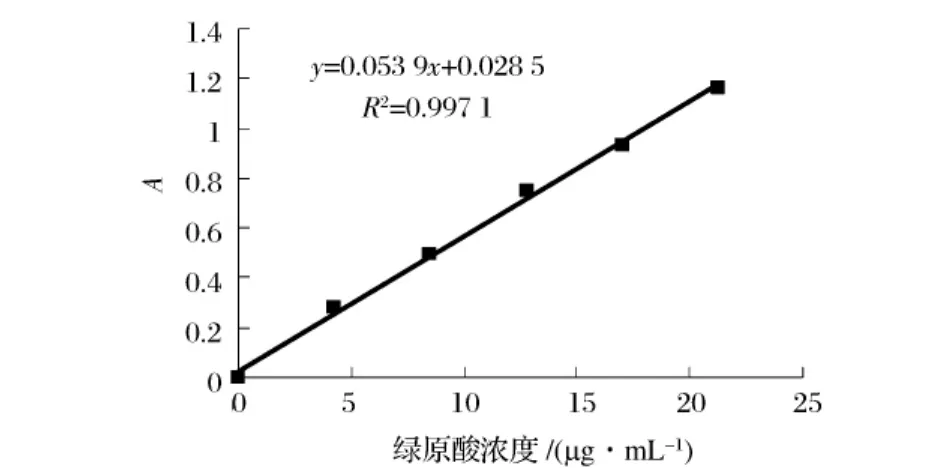
图1 利用UV测得绿原酸标准曲线
1.3.3 芦丁标准曲线的绘制[16]
精密称取105℃条件下干燥至恒重的芦丁对照品5.0 mg,置于小烧杯中,加5 mL无水甲醇溶解后转移至25.0 mL的容量瓶中,用蒸馏水定容,混匀,得芦丁标准液(0.20 mg/mL)。
标准曲线的制定:精密吸取以上芦丁标准液0.0、0.5、1.0、2.0、3.0、4.0、5.0 mL 分别置于 10 mL容量瓶中加质量分数为10%的NaNO2溶液0.30 mL,混匀,静置6 min,加质量分数为20%Al(NO3)3溶液0.3 mL混匀,静置6 min,加质量分数为8%NaOH溶液4.0 mL,摇匀,静置12 min,蒸馏水定容至刻度,以试剂为空白,在510 nm下测吸收光度,绘制标准曲线,见图2。
1.3.4 蒲公英汁的提取
工艺流程:新鲜蒲公英全草→洗净、去杂去根干燥→粉碎过筛→称量→装料→加入纤维素酶、去离子水→50℃保温2 h→80℃保温1 h→抽滤得第1次提取液→滤渣80℃保温1 h→抽滤得第2次提取液→合并2次提取液即实验用蒲公英汁

图2 芦丁标准曲线
1.3.5 纤维素酶用量对蒲公英汁中绿原酸、总黄酮含量的影响
取干燥蒲公英叶子粉10 g 5份,分别置于5个500 mL 三角瓶中,依次加入 0.00、0.01、0.05、0.1、0.15、0.20 g纤维素酶,300 mL去离子水,50℃恒温水浴保温2 h,80℃保温1 h,抽滤得第1次提取液,滤渣80℃保温1 h,抽滤得第2次提取液,合并2次提取液,准确移取200 μL置10 mL容量瓶中,50%无水甲醇溶液定容,于327 nm波长下,分别测定蒲公英汁中绿原酸含量;准确移取600 μL置10 mL容量瓶中,按芦丁标准曲线制定方法,于510 nm波长下,分别测定蒲公英汁中总黄酮(以芦丁计,下同)含量。结果见图3。
1.3.6 澄清
1.3.6.1 WSC与CTS对蒲公英汁澄清效果比较
WSC溶液和CTS溶液的制备:准确称取2.5 g壳聚糖,加入一定体积2%柠檬酸溶液,磁力搅拌至完全溶解,移入250 mL容量瓶中,2%柠檬酸溶液定容,配制成质量分数1%的壳聚糖溶液。
室温下,取1.3.5中最佳酶用量下制得的蒲公英汁原汁少量,另取2份,每份50 mL,往其中一份加入1.5 mL的水溶性壳聚糖(WSC)溶液,一份加入1.5 mL的水不溶性壳聚糖(CTS)溶液,混匀,50℃恒温水浴50 min,抽滤,滤液及原汁在620 nm处测透光率,比较澄清效果。结果见表2。
透光率的测定:以可见分光光度计,在620 nm处,用1 cm比色皿,蒸馏水作空白,测定蒲公英汁的透光率。以T%表示蒲公英汁的澄清度。
1.3.6.2 单因素试验
室温下,将1.3.5中最佳酶用量下制得的蒲公英汁分装5份(50 mL/份),分别加入 1.0、1.5、2.0、2.5、3.0 mL质量分数1%的壳聚糖溶液,混匀,静置50 min,抽滤,滤液于620 nm处测透光率,比较澄清效果(图4)。壳聚糖添加量对绿原酸和总黄酮含量的影响(图 5),设置 20、30、40、50、60 min 时间,比较澄清效果(图6)。澄清时间对绿原酸和总黄酮含量的影响(图7)。设置30、40、50、60、70℃温度,比较澄清效果(图8)。澄清温度对绿原酸和总黄酮含量的影响(图9)。
1.3.6.3 最佳澄清工艺条件的确定
在以上单因素试验基础上,以壳聚糖用量、澄清温度、澄清时间为主要因素,透光率为指标,进行L9(34)正交试验,确定最佳澄清工艺条件,因素水平表见表1。

表1 因素水平表
1.3.7 澄清、过滤对蒲公英汁品质的影响
最佳酶用量下,取按1.3.4工艺流程制备的蒲公英汁3份,每份100 mL,按最佳澄清工艺条件澄清、0.45 μm混合滤膜过滤后,置37℃恒温培养箱中保温1个月,取出观察汁液外观有无沉淀、浑浊、变色、异味等,并测其绿原酸含量、总黄酮含量以及微生物指标。
细菌总数:按GB4789.2-1994测定;大肠杆菌数:按 GB4789.3-1994测定;致病菌数:按GB4789.10-1994测定。
2 结果与分析
2.1 绿原酸标准曲线
图1,绿原酸标准曲线回归方程y=0.0539x+0.0285,相关系数R2=0.9971。结果表明绿原酸在4.25,L~21.25 μg/mL内有良好的线性关系。
2.2 芦丁标准曲线
图2,芦丁标准曲线回归方程 y=10.632x-0.0107,相关系数R2=0.9988。结果表明,在0.01~0.1 mg/mL内有良好的线性关系。
2.3 不同纤维素酶用量下蒲公英汁中绿原酸、总黄酮的含量
由图3可以看出,采用水提工艺,绿原酸和总黄酮溶出量为10.70 mg/g和16.67 mg/g,随着纤维素酶用量的增大,蒲公英汁中绿原酸和总黄酮的含量呈上升趋势,当纤维素酶用量达到0.1 g(w纤维素酶:w蒲公英为1%)之后,蒲公英汁中绿原酸和总黄酮的含量上升趋势减缓,从经济角度考虑,选择纤维素酶用量为1%作为较佳水平。

图3 不同纤维素酶用量下蒲公英汁中绿原酸、总黄酮的含量
2.4 壳聚糖对蒲公英汁的澄清效果
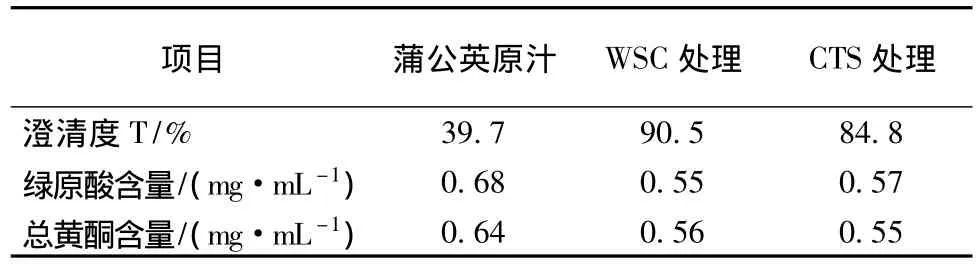
表2 WSC、CTS对蒲公英汁的澄清效果
试验表明,红褐色不透明的蒲公英汁中加入壳聚糖溶液之后,立即呈浑浊状态,水浴结束,有明显絮凝物沉在三角瓶底部,抽滤后,滤液呈清亮橙红色。由表2可以看出,用壳聚糖澄清后,蒲公英汁的澄清度有明显的提高,WSC处理过的汁液澄清度高于CTS处理的,绿原酸和总黄酮都有部分损失,但大部分保留在溶液中,所以,下面的试验中采用WSC作为澄清剂。
2.4.1 壳聚糖添加量对澄清效果的影响

图4 壳聚糖添加量对蒲公英汁澄清效果
由图4可以看出,随着WSC用量的增加,蒲公英汁澄清度呈上升趋势,当壳聚糖用量达到2 mL,即0.4 g/L之后,澄清度稳定在90%以上,所以选择0.4 g/L的添加量为最佳。

图5 壳聚糖添加量对绿原酸、总黄酮含量的影响
由图5可以看出,随着WSC用量的增加,蒲公英汁中绿原酸、总黄酮均有损失,壳聚糖用量为3.0 mL,即0.6 g/L时,绿原酸损失39.7%,总黄酮损失15.6%,绿原酸含量随着壳聚糖用量的增加损失较多。所以,澄清时应在保证澄清度超过85%的原则下,减少壳聚糖用量,以保证功能性成分的保留。
2.4.2 澄清时间对澄清效果的影响
由图6可以看出,随着时间的延长,蒲公英汁澄清度增加,但50min之后,开始下降,可能时间延长后沉降下来的絮凝物又有部分溶解其中,造成透光率的降低。
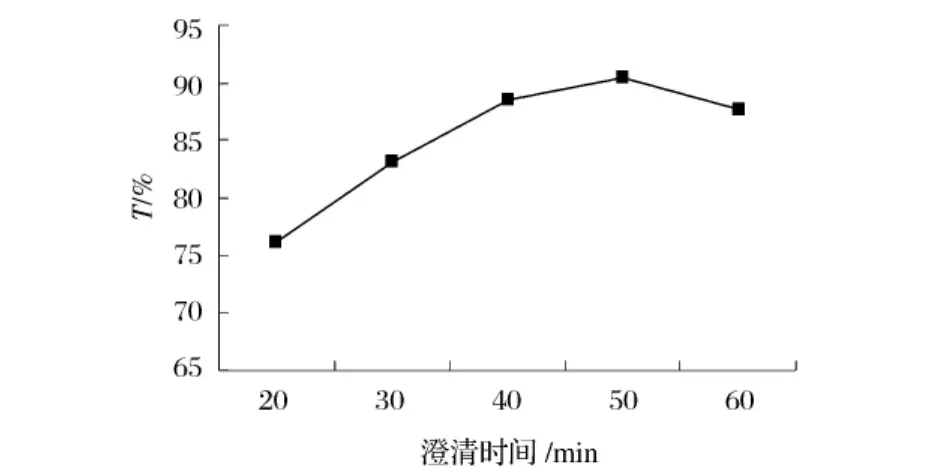
图6 澄清时间对蒲公英汁澄清效果
由图7可以看出,随着时间的延长,蒲公英汁中绿原酸、总黄酮含量都有下降,60 min时,绿原酸含量下降35.3%,总黄酮含量下降20.3%,可能与壳聚糖易于吸附多酚类物质有关,所以,应在保持澄清度的前提下,尽可能缩短澄清时间。

图7 澄清时间对绿原酸、总黄酮含量的影响
2.4.3 澄清温度对澄清效果的影响
由图8可以看出,随着温度的升高,蒲公英汁澄清度增加,50℃之后,开始有所降低,到70℃时,澄清度降到80%以下,可能温度高,使絮凝物部分溶解,造成澄清度的降低,所以,澄清温度不应超过50℃。

图8 澄清温度对蒲公英汁澄清效果

图9 澄清温度对绿原酸、总黄酮含量的影响
由图9可以看出,随着温度的升高,蒲公英汁中绿原酸、总黄酮含量都略有下降,与壳聚糖用量和澄清时间对二者的含量影响相比,温度的影响较小,70℃时,绿原酸损失23.5%,总黄酮损失14.6%。
2.4.4 壳聚糖澄清蒲公英汁的正交试验结果
由表3可知,壳聚糖用量对蒲公英汁澄清效果影响最大,其次为澄清温度,澄清时间影响最弱,其最佳组合为A2B3C3,即壳聚糖用量为0.4 g/L,澄清温度为50℃,澄清时间为50 min,结合单因素试验中壳聚糖用量、澄清时间和澄清温度对绿原酸和总黄酮含量的影响程度不同,选择澄清时间40 min可以保证澄清度超过85%,确定最佳工艺条件为壳聚糖用量为0.4 g/L,澄清温度为50℃,澄清时间为40 min,在此条件进行验证实验,平行3次,取均值得到的蒲公英汁澄清度为96.4%。同时,测定其中绿原酸含量为0.50 mg/mL,总黄酮含量为0.55 mg/mL,损失分别为26.47%和14.06%。方差分析表明,壳聚糖用量、澄清温度和澄清时间的影响均不显著(P<0.05)。

表3 正交试验结果

表4 方差分析表

表5 澄清、过滤处理后蒲公英汁的变化
2.5 澄清、过滤对蒲公英汁品质的影响
经最佳条件澄清、0.45 μm微孔滤膜过滤、37℃恒温一个月后的蒲公英汁,外观呈清亮橙红色,无沉淀、浑浊、异味,蒲公英清香味浓郁。测得各项指标值如表5。微生物指标:细菌总数≤100 CFU/mL,大肠杆菌≤3CFU/100 mL,致病菌未检出。
3 讨论
本研究首次将纤维素酶其用于蒲公英汁的提取,在进行预实验和参考厂家给出的最适酶条件基础上选择料液比1∶30,温度50℃,改变酶用量,考察功能性成分绿原酸和总黄酮的提取率,结果发现,当酶用量达到1%之后,功能性成分的溶出增加缓慢,1%的酶用量为较佳用量。
壳聚糖用于蒲公英汁的澄清[17-22],发现高分子量壳聚糖澄清效果不如低分子量壳聚糖,不同用量对蒲公英汁澄清效果影响最大,其次为澄清温度,澄清时间影响最弱,单因素试验发现,壳聚糖用量和澄清时间对绿原酸和黄酮的含量影响较大,选择澄清时间40 min可以保证澄清度超过85%,所以确定最佳工艺条件为壳聚糖用量为0.4 g/L,澄清温度为50℃,澄清时间为40 min,在此条件进行验证实验,平行3次,取均值得到的蒲公英汁澄清度为96.4%。同时,测定其中绿原酸含量为0.50 mg/mL,总黄酮含量为0.55 mg/mL,损失分别为26.47%和14.06%。方差分析表明,壳聚糖用量、澄清温度和澄清时间对澄清度的影响均不显著(P<0.05)。研究还发现,蒲公英汁中加入壳聚糖后加热到30℃以上,形成大块状絮凝物,容易过滤,适于工业生产。
蒲公英汁在澄清、过滤、37℃放置一个月后,外观呈亮橙红色,无沉淀、浑浊、异味,蒲公英清香味浓郁。透光率为96.4%,绿原酸含量为0.4962mg/mL,总黄酮含量为0.5304mg/mL。微生物指标:细菌总数≤100 CFU/ml,大肠杆菌≤3 CFU/100 mL,致病菌未检出。0.45 μm孔径的滤膜可去除大部分的颗粒物和细菌。经过这种方法处理得到的蒲公英汁,既克服了原料的限制,又避免了高温灭菌对其成分的破坏,可直接用于饮料的调配。
[1]Escudero N L,de Arellano M L,Fernndez,et al.Taraxacum officinale as a food source[J].Plant Foods for Human Nutrition,2003,58:1-10.
[2]宋德花,梁运霞,李继昌.蒲公英的药理作用研究进展[J].黑龙江畜牧兽医职业学院学报,2008,7(1):51-52.
[3]曹纬国,刘志勤,邵云,等.黄酮类化合物药理作用的研究进展[J].西北植物学报,2003,23(12):2241-2247.
[4]Lee Sullim,Han Saem,Hye Min Kim et al.Simultaneous determination of luteolin and luteoloside in dandelions using HPLC[J].Hort Environ Biotechnol.2011,52(5):536-540.
[5]Chkhikvishvili I D,Kharebava G I.Chicoric and chlorogenic acids in plant species from georgia[J].Applied Biochemistry and Microbiology,2001,37(2):188-191.
[6]向昌国,李文芳,聂琴,等.甘薯茎叶中绿原酸提取方法的研究及含量测定[J].食品科学,2007,28(1):126-130.
[7]乌兰,张泽生.金银花中绿原酸的提取及检测[J].食品科学,2005,26(6):130-134.
[8]邓良,袁华,喻宗沅.绿原酸的研究进展[J].化学与生物工程,2005,7:4-6.
[9]Bylka W,Matlawska I,Fran'ski R.Essential oil composition of Taraxacum officinale[J].Acta Physiol Plant,2010,32:231-234.
[10]李喜凤,郝哲,邱天宝,等.蒲公英药材质量标准研究[J].中国现代应用药学,2011,28(1):54-57.
[11]赵美瑾,许莉,关巍岱,等.中药蒲公英提取工艺研究[J].中国当代医药,2009,16(19):30,49.
[12]赵坚华,权伍荣.蒲公英保健饮料及其降血脂、降血糖作用研究[J].食品科技,2010,35(11):123-126.
[13]李宏高,吴忠会.蒲公英、山楂复合保健饮料的研制[J].食品科学,2009,30(4):286-289.
[14]王家玉.蒲公英的经济价值及其开发利用[J].生物学通报,2000,35(3):43-44.
[15]任运宏,程建军,肖志刚.蒲公英饮料生产工艺及配方的研究[J].食品工业科技,2001,22(5):38-39.
[16]陆海峰,罗建华,蒙春越,等.蒲公英总黄酮提取及对羟自由基清除作用[J].广州化工,2009,37(3):101-103.
[17]罗志敏,李忠水,林运鸿,等.壳聚糖在乌龙茶汁澄清中的应用研究[J].福建师范大学学报:自然科学版,2009,25(6):61-64.
[18]刘崑,高婷婷,杨柳.壳聚糖对葡萄汁的澄清作用[J].食品与发酵工业,2011,37(3):118-121.
[19]张晓勇,高向阳,陈秀霞等.纤维素酶半纤维素酶的应用及分子相关性[J].纤维素科学与技术,2006,14(1):47-51.
[20]胡晓亮,周国燕.壳聚糖及其衍生物在果蔬贮藏保鲜中的应用[J].食品与发酵工业,2011,37(3):146-150.
[21]吴琼,李三鸣,姜爱萍等.壳聚糖絮凝法精制红景天提取液[J].沈阳药科大学学报,2005,22(3):220-222.
[22]陈昕.壳聚糖作为中药水提取液中絮凝澄清剂的研究[J].中医药研究,2002,18(6):44-45.
ABSTRACTDandelion juice was made from dry dandelion.CMC treatment,chitosan clarification and microporous membrane filtration were used in making the juice.The effect of CMC content on chlorogenic acid and total flavones content of dandelion juice were studied.Results showed that the content of chlorogenic acid and total flavones increased with the increase of cellulose under the conditions of 1:30 ratio of raw material to solvent and 50℃.The content of chlorogenic acid and total flavones was stable when the dosage of cellulose reached to 1%;low molecular weight chitosan was better than insoluble chitosan in the clarification,and the best conditions were:low molecular weight 0.4g/L,temperature 50℃,time 40min.Under the optimal conditions,transmission was 96.4%,the content of chlorogenic acid were 0.50mg/mL,its loss was 26.47%,the content of total flavones were 0.55mg/mL,its loss was14.06%;after filtering with 0.45μm microporous membrane,transmission was 98.1%.The content of chlorogenic acid were 49.62mg/100mL,its loss was 27.03%;the content of total flavones was 53.04mg/100mL,its loss was 17.13%,the main functional components of dandelion were maintained.
Key wordsdandelion,cellulose,chitosan,chlorogenic acid,total flavones
Study on the Technology of Dandelion Juice
Lin Chun-mei1,Meng Wan-jing2
(Food Technology,Huaihai Institute of Technology,Lianyungang 222005,China)
(College Foreign Languages?Teaching Department,Ludong University,Yantai 264025,China)
博士,副教授(Linlin0174@Sina.com)。
*江苏省产学研联合创新资金计划(BY2010127)。
2012-02-29,改回日期:2012-04-21
