胃蛋白酶水解大豆分离蛋白的研究*
2012-09-12庞美蓉丁秀臻孔祥珍华欲飞
庞美蓉,丁秀臻,孔祥珍,华欲飞
(江南大学食品科学与技术国家重点实验室,食品学院,江苏无锡,214122)
胃蛋白酶水解大豆分离蛋白的研究*
庞美蓉,丁秀臻,孔祥珍,华欲飞
(江南大学食品科学与技术国家重点实验室,食品学院,江苏无锡,214122)
采用胃蛋白酶对大豆分离蛋白进行酶法水解,随着酶解时间的延长,蛋白质的水解度逐渐增大,水解6 h,DH为7.90%。采用分子筛凝胶过滤色谱(SE-HPLC)和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)对不同的酶解时间下大豆分离蛋白酶解物的分子结构进行表征,结果表明,胃蛋白酶选择性地酶解大豆11 S球蛋白。大豆分离蛋白经胃蛋白酶水解6 h后,分子量大于10 ku的部分占21.34%,其中主要是7 S球蛋白;分子量小于5 ku的部分所占比例为68.30%。对酶解物中的游离巯基和二硫键含量测定结果表明,随着酶解的进行,游离巯基的含量呈现先增大后减小的趋势,二硫键的含量总体变化不大。该研究旨在更好地了解胃蛋白酶水解大豆分离蛋白的机理,并为开发大豆分离蛋白酶解物产品提供理论依据。
大豆蛋白,胃蛋白酶,水解,分子量
大豆蛋白中90%的蛋白质以储藏蛋白的形式存在,主要分为大豆球蛋白(glycinin)和β-伴大豆球蛋白(β-conglycinin)[1]。大豆球蛋白也称作11 S,分子质量为340~375 ku,主要由酸性亚基(A1、A2、A3、A4、A5和A6,分子质量为38 ku)和碱性亚基(B1、B2、B3、B4、B5、B6,分子质量为20 ku)通过二硫键连接形成(A4酸性亚基除外)。β-伴球蛋白也称作7 S,分子质量为180~210 ku,主要由α、α'和β三种亚基所组成,分子质量分别为65、62和57 ku[2]。大豆蛋白含有人体所需的8种必需氨基酸,且比例合理,其赖氨酸含量可以与动物蛋白相媲美;大豆蛋白具有优良的乳化性、发泡性和凝胶性,是食品工业重要的蛋白质。但是,大豆蛋白质由于其分子量大、溶解度低、含有抗营养因子以及具有抗原性等因素而大大限制了大豆蛋白产品的应用领域。
蛋白质酶促水解是在水溶液中通过酶的催化作用,使蛋白质中的肽键断裂,生成胨、肽等低分子量产物的生化反应过程。蛋白质经酶水解有助于改善其营养价值和功能性质,从而拓宽其应用范围。大豆蛋白水解能改善溶解度、乳化性、起泡性等功能性质以及降低过敏性,产品能应用于乳制品、肉类、饮料以及婴儿食品中,在食品蛋白质配料加工方面有着特殊意义[3-6]。
本研究采用胃蛋白酶对大豆分离蛋白进行酶法水解,测定其酶法水解进程曲线,采用分子筛凝胶过滤色谱(SE-HPLC)和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)对不同的酶解条件下大豆分离蛋白酶解物的分子结构进行表征,并对酶解物中的巯基/二硫键含量进行测定,旨在更好地了解胃蛋白酶水解大豆分离蛋白的机理,并为开发大豆分离蛋白酶解物产品提供理论依据。
1 材料与方法
1.1 材料
全脂豆粕,山东万德福有限公司;胃蛋白酶,诺维信生物技术有限公司;三硝基苯磺酸(TNBS)、二硫代二硝基苯甲酸(DTNB),Sigma公司;乙腈,色谱纯;其余试剂均为分析纯。
1.2 仪器及设备
LGJ-10冷冻干燥机,北京四环科学仪器厂;高速冷冻离心机,日本日立公司;ECP3000三恒电泳仪,北京市六一仪器厂;Waters 600高效液相色谱、Spectrumlab22PC分光光度计,美国Waters公司;分析天平,上海天平仪器厂,FA1004型;868型pH计,上海热电仪器公司。
1.3 实验方法
1.3.1 大豆蛋白的制备
醇洗豆粕按1∶15的料液比加入去离子水,充分溶解,用2 mol/L的NaOH溶液调节至pH 7.0,室温下低速搅拌1 h,以10000 r/min在4℃离心30 min,弃去沉淀。上清液用2 mol/L的HCl溶液调节至pH 4.5,以10000 r/min在4℃离心30 min,弃去上清液,得到的蛋白质凝乳经水洗后,加入去离子水并用2 mol/L的NaOH将溶液回调至pH 7.0,经搅拌充分溶解后,溶液在4℃以10000 r/min离心30 min以弃去少量不溶物质,上清液经透析24 h除盐后冷冻干燥,干燥的大豆分离蛋白在4℃条件下保存。
1.3.2 胃蛋白酶水解大豆分离蛋白
大豆分离蛋白5%分散于水中,调节pH2.0,温度37℃,搅拌10 min,加入胃蛋白酶(酶与底物的比为1∶100),进行酶反应,反应过程中保持pH恒定。控制反应时间分别为0.5、1、2、3、4、5、6 h。反应完毕,调节水解液至pH7.0终止反应,以10000 r/min在4℃离心20 min,收集上清液和沉淀。冷冻干燥后在4℃条件下保存备用。
1.3.3 水解度的测定
水解度(DH)的测定采用三硝基苯磺酸法[7]。标准曲线由L-Leu(0~2.0 mmol/L)来制备。水解度的计算:
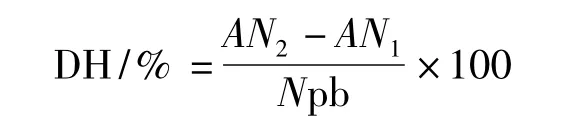
式中:AN1指蛋白水解前氨基氮的含量,mg/g(蛋白);AN2指蛋白水解后氨基氮的含量,mg/g(蛋白);Npb指蛋白底物中肽键的氮含量,Npb对于大豆球蛋白来讲为109.2 mg/g。
1.3.4 分子量分布的测定
采用高效液相色谱法(HPLC)。色谱仪,美国Waters公司;色谱柱:TSKgel 2000SWXL 300 mm×7.8 mm(Tosoh,Japan);流动相:V(乙腈)∶V(水)∶V(三氟乙酸)=45∶55∶0.1;检测:UV(220 nm);流速:0.5 mL/min;柱温:30℃;分子量校正曲线所用标准品:细胞色素C(MW 12500 u),抑菌肽(MW6500 u),杆菌肽(MW1450 u),Gly-Gly-Arg-Tyr(MW 451 u),Gly-Gly-Gly(MW 189 u)。
1.3.5 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)
天然大豆蛋白及蛋白质聚集体的电泳采用SDSPAGE,根据Laemmili的方法在DYCZ-24B型垂直电泳槽制胶[8]。分离胶、浓缩胶的浓度分别为12.5%和4%。
1.3.6 游离巯基含量的测定
将样品(30 mg/mL)溶解在含pH 8.0的0.15 mol/L的Tris-HCl缓冲液中,取1 mL样品,加入135 μL DTNB(0.01 mol/L),25℃反应30 min,以10000 r/min离心20 min后在412 nm处测定吸光度。样品中游离巯基含量的计算:[9]
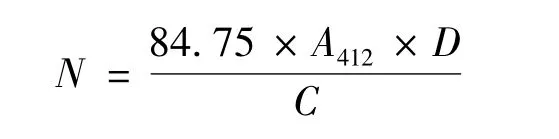
注:N为巯基含量,单位μmol/g;A412为样品在412 nm处的吸光度;D为样品的稀释度;C为样品中蛋白质的浓度,mg/mL。
1.3.7 二硫键含量的测定
将样品(10 mg/mL)溶解在含pH8.0的0.15 mol/L的Tris-HCl(含8 mol/L盐酸胍)缓冲液中。取0.5 mL样品加入4.2 μL NEM(0.2 mol/L)黑暗中反应1h将游离巯基封闭。封闭游离巯基后的样品中加入0.5 mL 2.5%硼氢化钠进行二硫键的还原。之后采用游离巯基含量的测定方法来进行二硫键含量的测定,二硫键的含量以半胱氨酸的含量(μmol/g蛋白)来表示,即2×(S—S)。
2 结果与讨论
2.1 大豆分离蛋白的水解曲线
采用三硝基苯磺酸法测定胃蛋白酶水解大豆分离蛋白的进程曲线,结果如图1所示。由图1可以看出,随着酶解时间的延长,蛋白质的水解度逐渐增大。尤其在最初的30 min水解速率很大,之后变得比较平缓。究其原因,随着酶解反应的进行:①底物浓度减小,反应位点逐渐被酶分子饱和;②产物浓度增加,其竞争性抑制变强;③酶活性降低;④中间复合物[ES]在经历了初始阶段的积累后达到稳态,趋于恒定。上述因素综合作用的结果使得酶解速率随时间延长而逐渐减小。胃蛋白酶水解大豆分离蛋白6 h,其DH达到7.90%。
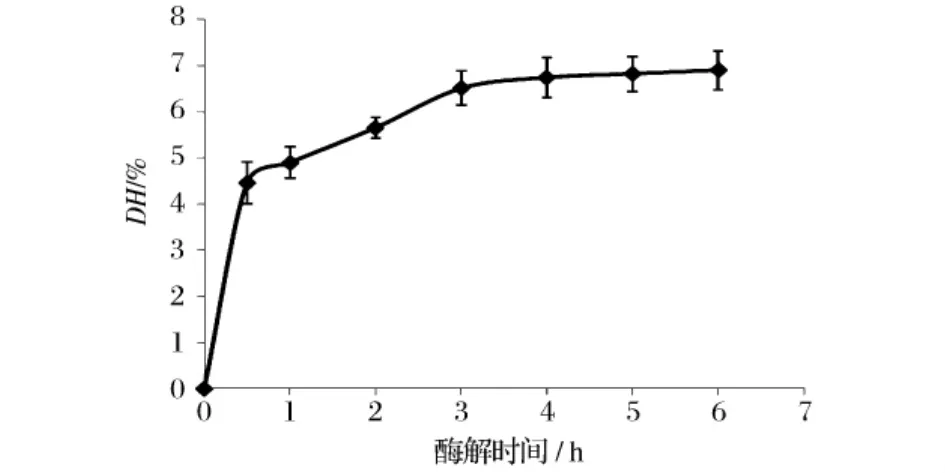
图1 胃蛋白酶水解大豆分离蛋白的水解进程曲线
2.2 大豆分离蛋白水解物的SE-HPLC图谱分析
采用SE-HPLC对不同水解时间下制备的大豆分离蛋白酶解物(未离心)、上清液和沉淀的分子量分布进行表征,结果如表1~表3所示。原料大豆分离蛋白(SPI)基本在空体积处流出。随着酶解时间的延长,酶解物的分子量逐渐减小。大豆分离蛋白酶解上清液和沉淀的分子量分布范围都比较宽广。比较表2和表3可以发现,上清液中小分子量肽段所占的比例明显要高于沉淀中。随着酶解时间的增加,酶解液离心后所得沉淀的量逐渐减少,酶解6 h后,离心未得到沉淀。值得注意的是,尽管胃蛋白酶水解大豆分离蛋白6 h后,分子量大于10 ku的部分仍占较大比例。
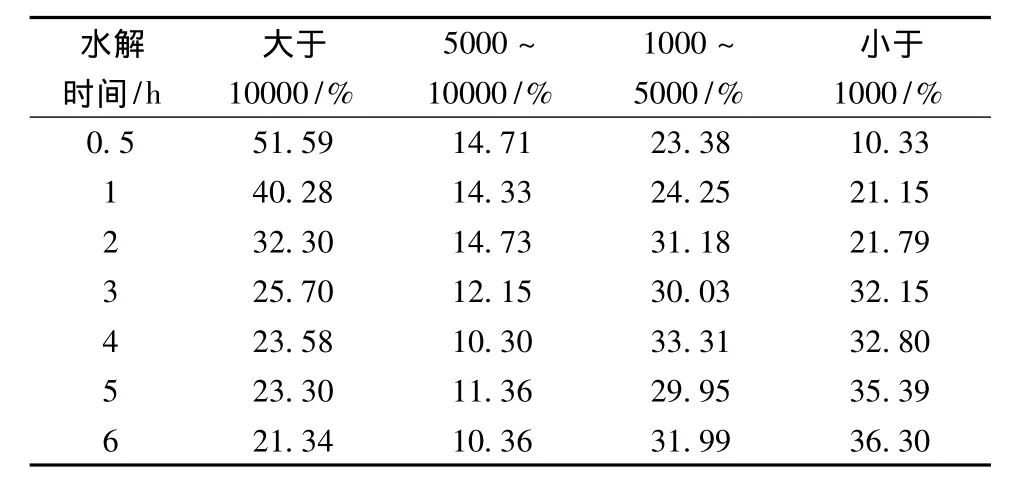
表1 大豆分离蛋白总酶解物的分子量分布
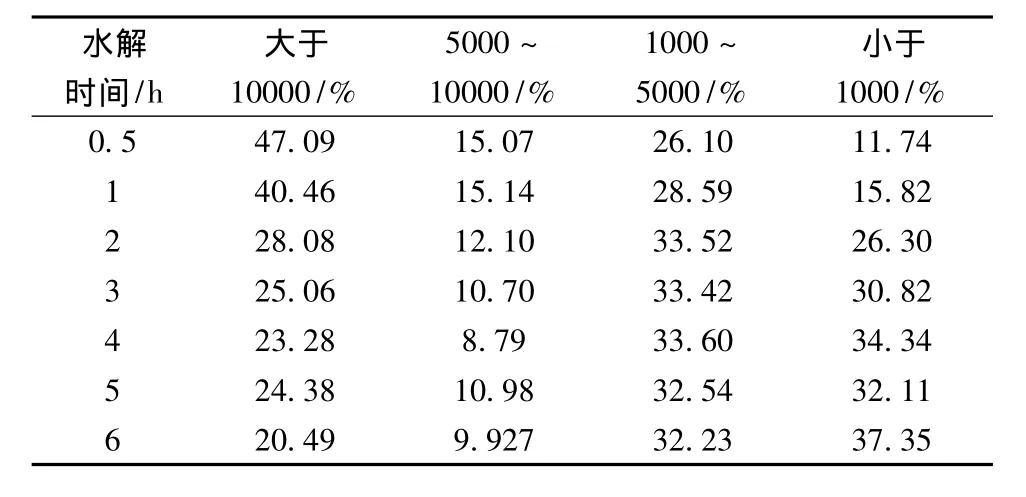
表2 大豆分离蛋白酶解物上清液的分子量分布
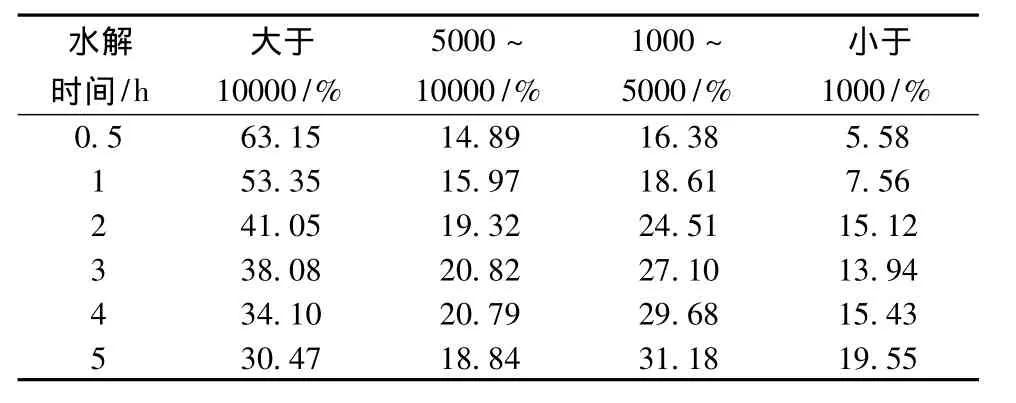
表3 大豆分离蛋白酶解物沉淀的分子量分布
2.3 大豆分离蛋白水解物的SDS-PAGE分析
为了更清楚地了解胃蛋白酶水解大豆分离蛋白的机理,对不同酶解时间下制备的大豆分离蛋白酶解物进行了SDS-PAGE表征。由图2可以看出,胃蛋白酶在pH 2.0,37℃下水解大豆分离蛋白,酶解时间0~6 h,大豆分离蛋白中的伴球蛋白成分7 S的条带并未发生较大的变化。可见胃蛋白酶水解主要作用于大豆球蛋白11 S。当酶解时间为0.5 h时,11 S的A肽链和B肽链的条带已经几乎不可见。结合上述SE-HPLC的实验结果,可见分子量大于10 ku的部分中,7 S蛋白占了很大比例。7 S球蛋白和11 S球蛋白因为其结构上的差异而表现出不同的功能性质,这个结果为选择性地酶解某一种蛋白来开发具有特定功能的大豆蛋白产品提供了一个很好的思路。
在此基础上,我们对大豆分离蛋白胃蛋白酶酶解物的上清液和沉淀进行了SDS-PAGE分析,结果如图3和图4所示。未发生酶解的7 S球蛋白在上清液和沉淀中都占较大的比例。
2.4 大豆分离蛋白酶解物的游离巯基和二硫键含量分析

图4 大豆分离蛋白酶解物沉淀的SDS-PAGE的电泳图谱
大豆球蛋白11S富含Cys,达42 mol/mol[10]。组成11 S的5种亚基分别为A1bB2,A2B1a,A1aB1b,A3B4和A5A4B3,其中每种亚基均由一条酸性肽链(A)和一条碱性肽链(B)通过一个二硫键连接而成。亚基根据其同源性分成两类,Ⅰ型亚基含有3个二硫键,2个游离巯基;Ⅱ型亚基含有2个二硫键,2个游离巯基[11]。由SDS-PAGE结果表明,采用胃蛋白酶进行大豆分离蛋白的酶解,11 S球蛋白几乎被完全酶解。针对11 S球蛋白中Cys含量高的分子特点,对大豆分离蛋白的酶解物中的巯基、二硫键含量进行测定,以期更进一步地了解胃蛋白酶酶解大豆分离蛋白在分子水平上发生的变化。如图5所示,在总酶解物、上清和沉淀中,游离巯基的含量呈现先增大后减小的趋势。这可能是由于随着水解的进行,原本包埋在球蛋白内部的巯基由于蛋白结构发生变化而暴露出来从而使得测定的游离巯基含量增大。之后继续酶解,来源于7 S亚基、A肽链、B肽链的肽段之间可能发生聚集(部分通过二硫键相连)从而导致巯基含量减少。
随着大豆分离蛋白的酶解,蛋白结构展开,并逐渐被水解为低分子量的肽段。大豆蛋白分子结构中的巯基、二硫键也会发生交换反应[12]。对大豆蛋白酶解物的上清液和沉淀中的二硫键的含量测定结果表明,随着酶解时间的延长(0~6 h),二硫键含量总体变化不大(约为45 μmol/g蛋白,如图6所示)。

图5 大豆分离蛋白酶解物的游离巯基含量
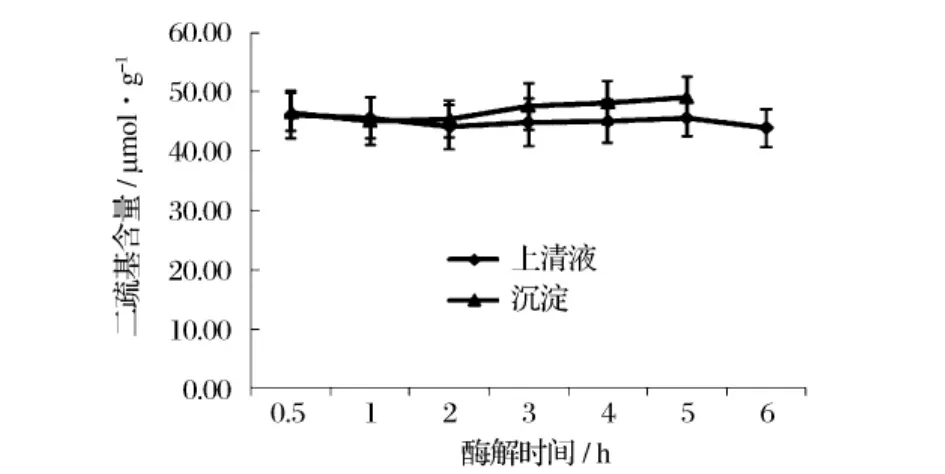
图6 大豆分离蛋白酶解物上清和沉淀的二硫键含量
3 结论
(1)采用胃蛋白酶对大豆分离蛋白进行酶法水解,随着酶解时间的延长,蛋白质的水解度逐渐增大,水解6 h,DH为7.90%。
(2)采用分子筛凝胶过滤色谱(SE-HPLC)和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)对不同的酶解条件下大豆分离蛋白酶解物的分子结构进行表征,结果表明,胃蛋白酶选择性地酶解大豆11 S球蛋白。大豆分离蛋白经胃蛋白酶酶解6 h后,分子量大于10 ku的部分占21.34%,其中主要是7 S球蛋白;分子量小于5 ku的部分所占比例为68.30%。
(3)对酶解物中的游离巯基含量测定结果表明,随着酶解的进行,游离巯基的含量呈现先增大后减小的趋势,二硫键的含量总体变化不大。研究结果旨在更好地了解胃蛋白酶水解大豆分离蛋白的机理,并为开发大豆分离蛋白酶解物产品提供一定的理论依据。
[1]Liu C,Wang X S,Ma H,et al.Functional properties of protein isolates from soybeans stored under various conditions[J].Food Chemistry,2008,111(1):29-37.
[2]Remkema J M S,Knabben J H M,Vliet T V.Gel formation by β-conglycinin and glycinin and their mixtures[J].Food Hydrocolloids,2001,15(4-6):407-415.
[3]Kim S Y,Park P S,Rhee K C.Functional properties of proteolytic enzyme modified soy protein isolate[J].Journal of Agriculture and Food Chemistry,1990,38(3):651-656.
[4]Cai T,Chang K C,Lunde H.Physicochemical properties and yields of sunflower protein enzymatic hydrolysates as affected by enzyme and defatted sunflower meal[J].Journal of Agriculture and Food Chemistry,1996,44(11):3500-3506.
[5]Henn R L,Netto F M.Biochemical characterization and enzymatic hydrolysis of different commercial soybean protein isolates[J].Journal of Agriculture and Food Chemistry,1998,46(8):3009-3015.
[6]Lee J Y,Lee H D,Lee C H.Characterization of hydrolysates produced by mild-acid treatment and enzymatic hydrolysis of defatted soybean flour[J].Food Research International,2001,34(2-3):217-222.
[7]Adler-Nissen J.Detemination of the degree of hydrolysis of food protein hydrelysates by trinitrobenzene sulfonic acid[J].Journal of Agriculture and Food Chemistry,1979,27(6):1256-1262.
[8]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[9]Huang Y R,Hua Y F,Qiu A Y.Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J].Food Research International,2006,39(2):240-249.
[10]Wolf W J.Sulfhydryl content of glycinin:effect of reducing agents[J].Journal of Agriculture and Food Chemistry,1993,41(2):168-176.
[11]Prak K,Nakatani K,Katsube-Tanaka T,et al.Structurefunction relationships of soybean proglycinins at subunit levels[J].Journal of Agriculture and Food Chemistry,2005,53(9):3650-3657.
[12]Caessens P W J R,Daamen W F,Gruppen H,et al.β-Lactoglobulin hydrolysis2peptide identification,SH/SS exchange,and functional properties of hydrolysate fractions formed by the action of Plasmin[J].Journal of Agriculture and Food Chemistry,1999,47(8):2980-2990.
ABSTRACTSoy protein extract was enzymatically hydrolyzed with Pepsin.With the increase of soy protein hydrolysis,the degree of hydrolysis values varied from 0%to 7.90%after 360 min of incubation.The molecular weight distribution of soy protein hydrolysates prepared with Pepsin was determined by SE-HPLC and SDS-PAGE.The results showed that soy glycinin(11S)was selectively hydrolyzed by Pepsin.The molecular weight distribution of the hydrolysates obtained after6h of incubation were as follows:21.34%were above 10 ku and 68.30%were below5kDa.Soy conglycinin played a big role on the MW above 10 kDa.With the hydrolysis,free sulfhydryl content first increased and then decreased,while the content of disulfide bonds had no obvious change.The results herein were helpful for understanding the mechanism of soy protein hydrolysis with Pepsin,and could serve as a guide for the development of soy protein hydrolysate products.
Key wordsSoy protein,Pepsin,Hydrolysis,Molecular weight
Enzymatic Hydrolysis of Soy Protein Extract with Pepsin
Pang Mei-rong,Ding Xiu-zhen,Kong Xiang-zhen,Hua Yu-fei
(State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
本科生(孔祥珍教授为通讯作者)。
*国家自然科学基金(No.21146002),项目名称:酶水解大豆蛋白中二硫键分布、结构状态以及非天然结构连接模式的全局性表征;江苏省自然科学基金(No.BK2011151),项目名称:大豆蛋白酶水解产物的巯基二硫键状态及其对其性质的影响;国家重点实验室建设项目计划(No.SKLF-ZZB-201202),项目名称:江南大学食品科学与技术国家重点实验室开放课题资助课题
2012-04-25,改回日期:2012-05-22
