亚甲基蓝对大肠杆菌O157的光动力杀伤作用及机理*
2012-09-12唐姝姝唐书泽李红爱吴希阳陈振强
唐姝姝,唐书泽,李红爱,吴希阳,陈振强
1(暨南大学食品科学与工程系,广东广州,510632)
2(暨南大学光电工程系,广东广州,510632)
亚甲基蓝对大肠杆菌O157的光动力杀伤作用及机理*
唐姝姝1,唐书泽1,李红爱1,吴希阳1,陈振强2
1(暨南大学食品科学与工程系,广东广州,510632)
2(暨南大学光电工程系,广东广州,510632)
探讨亚甲基蓝对革兰氏阴性菌肠出血性大肠杆菌O157的光动力杀伤作用及机理。通过细菌平板菌落计数法研究亚甲基蓝对肠出血性大肠杆菌O157的光动力杀伤作用,同时运用实时荧光定量PCR技术和聚丙烯酰胺凝胶电泳观察光动力技术对O157的基因组DNA的损伤程度和蛋白质降解效果。结果表明,当亚甲基蓝的浓度为10 mg/L,可见光(光功密度为200 mW/cm2)光照30 min时,几乎全部的肠出血性大肠杆菌O157能被杀死,并伴随有DNA断裂和蛋白质降解。亚甲基蓝对革兰氏阴性菌肠出血性大肠杆菌O157有非常明显的光灭活效应,其灭活机理可能是对基因组DNA的损伤以及蛋白质的降解。
亚甲基蓝,肠出血性大肠杆菌O157,光动力灭菌技术,脱氧核糖核酸损伤,蛋白质降解
传统的杀菌技术主要借助热或化学的手段来灭菌,这通常会导致食品中不良的物理和化学变化。抗生素的滥用导致潜在的“超级细菌”爆发,迫使人们开始寻求新型、非热能、生态友好和经济有效的杀菌技术[1]。光动力灭菌技术(APDT)则是其中的一种。APDT基于光动力作用,利用光敏剂对活性细菌的优先聚集特性,在特定波长的光源照射激发下,光敏剂吸收光子的能量,产生单态氧、自由基等活性氧物质,这些物质能通过氧化作用杀伤靶细胞,且不伤害周围组织和细胞[2]。革兰氏阴性菌由于具有复杂的细胞壁结构,屏蔽了细胞膜与单重态氧的有效结合,降低了光动力疗法的杀伤作用[3-4]。
O157是肠出血性大肠杆菌(Enterohaemorrhagic E.coli,EHEC)的主要血清型,属于革兰氏阴性菌,可通过污染的食物、水以及直接接触感染的人或动物而感染。该菌是近几年新发现的危害严重的新型人类致病菌,能够引起人类出血性腹泻(HC),溶血性尿毒综合征(HUS),血栓性血小板减少性紫癜(TTP),甚至引发死亡[5]。自1982年在美国首次发现由肠出血性大肠杆菌O157引起的食物中毒爆发以来,国内外由该菌感染致病的病例数已呈明显上升趋势,引起了人们的广泛关注。
亚甲基蓝属吩噻嗪衍生物,在水溶液中带有阳性电荷,是第2代光敏剂,其最大吸收波长为600~700 nm,激活后生成的光敏复合物对病毒包膜和核酸有损伤作用[6]。国外从20世纪90年代起已开展了基于亚甲基蓝的光灭活血浆中病毒的研究工作,但在微生物方面的应用才刚刚起步[7]。本课题选择肠出血性大肠杆菌O157作为实验菌株,通过平板菌落计数,荧光定量PCR和聚丙烯酰胺凝胶电泳实验,探讨亚甲基蓝的光动力杀菌技术对革兰氏阴性菌株的灭活效果及作用机理。
1 材料和方法
1.1 材料
1.1.1 菌种
肠出血性大肠杆菌(EHEC)O157,广州市疾病预防控制中心。
1.1.2 培养基
细菌计数培养基,LB液体培养基,青岛海博生物技术有限公司。
1.1.3 主要试剂及仪器
亚甲基蓝(MB)(10 g/L),上海红绿光敏剂研究所有限公司;U21901双光束紫外可见光分光光度计,北京普析通用仪器有限责任公司;75 W溴钨灯(光功密度200 mW/cm2),北京卓立汉光仪器有限公司;细菌基因组DNA提取试剂盒,广州东盛生物科技有限公司。
1.1.4 引物合成
针对肠出血性大肠杆菌O157的特异基因rfbE设计引物,委托上海捷瑞生物工程有限公司合成。其序列如下,上游引物:5'-CTACAGGTGAAGGTGGAATGG-3';下游引物:5'-TTCCTCTCTTTCCTCTGCGG-3'。
1.2 肠出血性大肠杆菌O157的光动力灭活试验
1.2.1 细菌接种及培养
将活化的大肠杆菌的菌悬液以1∶100的比例接种于100 mL LB液体培养基中,37℃下振荡培养至对数生长期,离心收集菌体(4000 r/min,10 min),弃去上清液,使菌体重新悬浮于0.1 mol/mL的磷酸盐缓冲液(PBS)中,并使其OD600=0.5(相当于107CFU/mL左右)。
1.2.2 光敏剂梯度稀释[8]
用PBS稀释MB,加入菌液,配置MB终浓度分别为0,1,5,10,25,50 mg/L的菌悬液,备用。
1.2.3 光敏剂浓度试验
将不同浓度MB的菌悬液于37℃避光孵育30 min后进行光照,即在96孔板细胞培养板任取一孔,加入200 μL菌悬液,37℃避光孵育30 min,放在距离溴钨灯光源20 cm处光照30 min。同时设置不光照组(L-)进行对照。
1.2.4 光照时间试验
将MB浓度为10 mg/L的菌悬液于37℃避光孵育30 min后进行光照,即在96孔板细胞培养板任取一孔,加入200 μL菌悬液,37℃避光孵育30 min,放在距离溴钨灯光源20 cm处光照0,5,10,20,30 min。同时设置不加光敏剂组(S-)进行对照。
1.2.5 细菌平板菌落计数
将1.2.3和1.2.4两组处理所得的菌悬液均以1∶10梯度稀释后,每个梯度各取100 μL于细菌平板菌落技术培养基平皿中,于37℃生化培养箱中恒温培养24 h后进行平板菌落计数并绘制失活率柱形图。试验重复3次,取平均值。
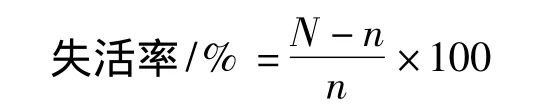
式中,N为对照组菌落数平均值;n为实验组菌落数平均值。
1.3 肠出血性大肠杆菌O157的基因组DNA损伤试验
1.3.1 细菌培养及前处理
按1.2.1的方法培养并收集肠出血性大肠杆菌O157菌液,用PBS稀释MB后加入收集的菌液,配置MB的终浓度为10 mg/L的菌悬液。在96孔板细胞培养板任取5孔,分别加入200 μL菌悬液,37℃避光孵育30 min,放在距离溴钨灯光源20 cm处光照30 min(S+L+),同时设置加光敏剂不光照(S+L-),不加光敏剂但光照(S-L+)和不加光敏剂且不光照(S-L-)作为对照。
1.3.2 细菌基因组DNA的提取
取1.3.1中4组处理方法所得的各1 mL菌悬液,按照细菌基因组DNA提取试剂盒的说明书进行肠出血性大肠杆菌O157的基因组DNA提取,提取出的DNA作为实时荧光定量PCR检测肠出血性大肠杆菌O157的特异性基因rfbE的模板。
1.3.3 实时荧光定量PCR扩增
确定最佳反应体系以及反应条件,用制备的模板进行SYBR Green-I荧光定量PCR试验。该反应的总体系为25 μL,其中,2×SYBR Green Premix Ex Taq母液12.5 μL,DNA模板2 μL,上下游引物各0.5 μL(20 μmol/L),灭菌去离子水9.5 μL。反应条件为:94℃预变性5 min;94℃变性5 s,57℃退火15 s,共扩增40个循环。
1.4 肠出血性大肠杆菌O157的蛋白质降解试验
1.4.1 细菌培养及前处理
参照1.3.1的方法。
1.4.2 SDS-GAGE分析菌体全蛋白降解试验
将1.4.1中4种处理方法所得的各1 mL菌悬液,置于1.5 mL EP管中,离心(10000 r/min,2 min)后弃上清液,向菌体中加入20 μL无菌去离子水使菌体悬浮。加入5 μL 2×SDS-PAGE上样缓冲液,于95℃下加热5 min后进行SDS-PAGE试验。
1.5 统计分析
用SPSS17.0统计软件进行数据处理,结果以平均值±标准差表示,显著性差异用t检验,P<0.05为显著差异。
2 结果与分析
2.1 MB浓度对肠出血性大肠杆菌O157失活率的影响
各浓度MB对肠出血性大肠杆菌O157的光动力灭活作用见图1和图2。在MB浓度低至1 mg/L时,光照30 min能使约91%的肠出血性大肠杆菌O157灭活;当MB浓度达到50 mg/L的时候,几乎可以使全部的肠出血性大肠杆菌O157灭活。表明在光照条件下,随着MB浓度的增加,光动力对O157的杀伤作用逐渐增强。而光敏剂对照组和光照对照组均没有非常明显的杀伤效果。
2.2 光照时间对肠出血性大肠杆菌O157失活率的影响
在MB浓度相同的情况下不同光照时间对肠出血性大肠杆菌O157失活率的影响见图3和图4。当MB浓度固定在10 mg/L时,光照5 min以上即可使绝大部分的肠出血性大肠杆菌O157失活;当光照时间达到30 min时,可以使肠出血性大肠杆菌O157的失活率达到99.9999%。这表明在MB的浓度一定时,随着光照时间的延长,光动力杀菌技术对肠出血性大肠杆菌O157的杀伤作用逐渐增强。
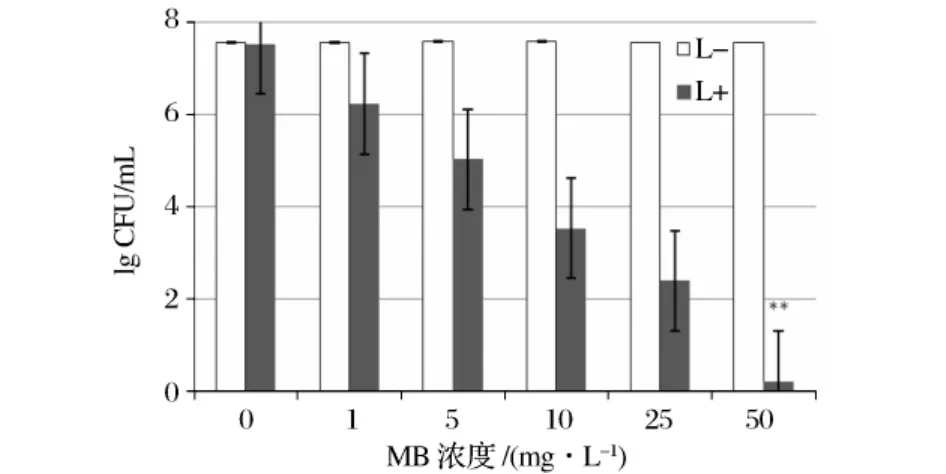
图1 不同浓度MB对肠出血性大肠杆菌O157菌落数(CFU)的影响
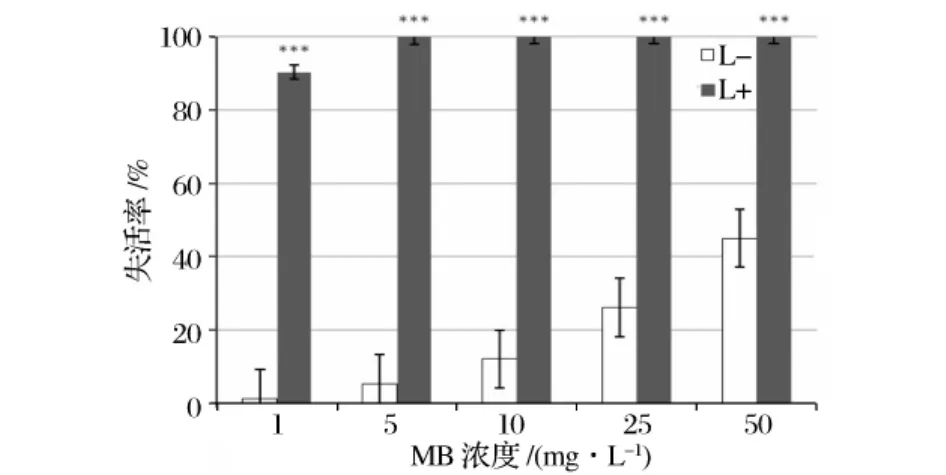
图2 不同浓度MB对肠出血性大肠杆菌O157失活率的影响
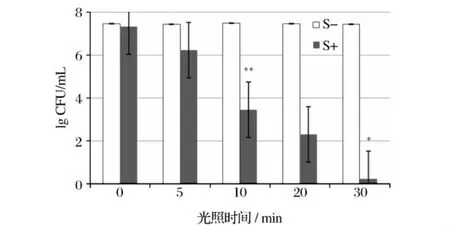
图3 不同光照时间对肠出血性大肠杆菌O157菌落数(CFU)的影响
2.3 MB-APDT对肠出血性大肠杆菌O157基因组DNA的损伤效果分析

图4 不同光照时间对肠出血性大肠杆菌O157失活率的影响
针对肠出血性大肠杆菌O157的特异基因rfbE设计引物,进行实时荧光定量PCR试验,结果见图5和图6。实验组的DNA模板的量相对于对照组确实有很大程度的减少。之后进行了溶解曲线分析,样品的扩增产物的溶解温度是在81℃左右,在其他温度下并没有出现非特异性扩增(见图6),证明了产物的专一性。这表明在一定浓度的光敏剂和适当的光照时间下能够引起肠出血性大肠杆菌O157的基因组断裂,且损伤程度较大。
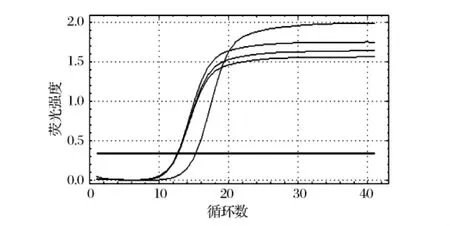
图5 标准模板的实时荧光定量PCR扩增曲线

图6 标准模板的熔融曲线
2.4 MB-APDT对肠出血性大肠杆菌全蛋白降解效果的影响
MB-APDT对肠出血性大肠杆菌O157的全蛋白降解效果见图7。肠出血性大肠杆菌O157在加光敏剂MB(10 mg/L)且进行光照30 min的情况下,其菌体的大部分蛋白质被降解,只在30、32和65 ku这3处有不完全降解的较浅条带出现。而光敏剂对照组、光照对照组及完全对照组则没有变化。

图7 MB-APDT处理后细菌全蛋白降解效果的SDS-PAGE图谱
带阴离子和电中性的光敏剂对革兰氏阴性菌的杀伤作用小,而带阳离子的光敏剂对革兰氏阳性菌和革兰氏阴性菌都有明显的杀伤作用[9]。本课题组前期的研究工作已经证实,光动力杀菌技术对曲霉孢子[10]、革兰氏阴性菌金黄色葡萄球菌[11]及单核细胞增多性李斯特菌[12]具有良好的灭菌效果,本实验进一步证实了MB在光照条件下对革兰氏阴性菌肠出血性大肠杆菌O157也有很强的杀伤作用。但带阳离子光敏剂对细菌有明显杀伤作用的机理目前尚不清楚,Minnock等人认为可能是带阳离子的光敏剂与细菌细胞的某种亚结构选择性地结合,使得细菌对其更为敏感[13]。North等认为可能是带阳离子的光敏剂与细胞膜所带的负电荷容易产生静电吸引力,使得光敏剂能够穿透细菌的细胞壁与细胞膜有效结合,通过改变细胞膜的渗透性从而杀死细菌[14]。
3 结论
加入浓度为10 mg/L的MB,在光功密度为200 mW/cm2的溴钨灯下光照30 min即能使肠出血性大肠杆菌O157的失活率达到99.9999%,并伴有基因组DNA损伤和蛋白质降解。亚甲基蓝介导的光动力技术可能通过DNA损伤和蛋白质降解来实现对革兰氏阴性菌的杀伤作用。因此,光动力杀菌技术也有可能被开发成一种有效的杀灭革兰氏阴性菌的技术应用于肉类食品安全领域。
[1]Buchovec I,Paskeviciute E.Photosensitization-based inactivation of food pathogen Listeria monocytogenes in vitro and on the surface of packaging material[J].Journal of Photochemistry and Photobiology,2010,99(1):9-14.
[2]Maisch T.Anti-microbial photodynamic therapy:useful in the future[J].Laser in Medical Science,2007,22(2):83-91.
[3]Minnock A,Vernon D,Schofiels J.Mechanism of uptake of a cationic water-soluble pyridinium zinc phthalocyanine across the outer membrane of Escherichia coli[J].Agents Chemother,2000,44(4):522-527.
[4]Lacey A,Phillips D.The photosensitization of Escherichia coli using disulphonated aluminium phthalocyanines[J].Journal of Photochemistry and Photobiology,2001,142(3):145-150.
[5]Feng P.Escherichia coli serotype O157:H7:novel vehicles of infection and emergence of phenotypic variants[J].E-merging Infectious Diseases,1995,1(2):47-52.
[6]Epe B,Mutzel P,Adam W.DNA damage by oxygen radicals and excited state species:a comparative study using enzymatic probes in vitro[J].Journal of Photochemistry and Photobiology,1988,67(1-2):149-165.
[7]Orth K,Russ D,Beck G.Methylene blue in photodynamic therapy:From basic mechanisms to clinical applications[J].Photodiagnosis and Photodynamic Therapy,2005,2(3):175-191.
[8]周德庆.微生物学实验教程[M].北京:高等教育出版社,2006:109-113.
[9]黄齐茂,闻静雪,陈彰评,等.新型金属卟啉光敏剂的合成及其抗菌活性[J].武汉化工学院学报,2006,28(3):1-5.
[10]李颖,唐书泽,任雅清,等.光敏化作用对曲霉孢子失活的影响[J].食品与发酵工业,2008,34(8):22-24.
[11]任雅清,唐书泽,吴希阳,等.光动力对金黄色葡萄球菌的杀伤作用及其AFM观察[J].食品与发酵工业,2008,34(8):56-59.
[12]林少玲,唐书泽,唐姝姝,等.血啉甲醚对单增李斯特菌的光动力灭活作用及机理[J].食品与发酵工业,2011,37(3):83-87.
[13]Minnock A,Vernon D,Schofiels J,et al.Use of a cationic water-soluble zinc phthalocyanine to photoinactivate both Gram-negative and Gram-positive bacteria[J].Journal of Photochemistry and Photobiology,1996,32(3):159-164.
[14]North J,Neyndorff H Lvy G.Photosensitizers as virucidal agents[J].Journal of Photochemistry and Photobiology,1993,17(3):99-102.
ABSTRACTThe mechanisms of anti-microbial photodynamic technology(APDT)against Gram-negative bacteria Escherichia coli O157 by methylene blue(MB)was investigated.The bactericidal effect of MB-APDT on E.coli O157 was measured by counting the reduction of colony forming unit(CFU).The damage of DNA was observed by real-time polymerase chain reaction(RT-PCR)and the degradation of proteins was investigated by sodium dodecyl sulphate polyacrylamide gel electrophoresis(SDS-PAGE).Results showed that almost all of the E.coli O157 were photo inactivated by illumination with 30 min visible light(power density 200 mW/cm2)in the presence of 10 mg/L MB.The significant photo-inactivation of Gram-negative bacteria Escherichia coli O157 may be due to the damage of DNAs and the degradation of proteins.
Key wordsmethylene blue,Escherichia coli O157,anti-microbial photodynamic technology,DNA damage,protein degradation
Mechanisms of Anti-microbial Photodynamic Technology Against Escherichia coli O157 by Methylene Blue
Tang Shu-shu,Tang Shu-ze,Li Hong-ai,Wu Xi-yang,Chen Zhen-qiang
1(Department of Food Science and Technology,Jinan University,Guangzhou 510632,China)
2(Department of Optoelectronic Engineering,Jinan University,Guangzhou 510632,China)
硕士研究生(唐书泽教授为通讯作者)。
*暨南大学科研培育与创新基金项目
2012-03-14,改回日期:2012-05-22
