牛不同部位肌肉高铁肌红蛋白还原酶活力及耗氧率对肉色稳定性的影响
2012-09-12高晓光胡文娟戴瑞彤
谢 丽,高晓光,苗 敬,胡文娟,戴瑞彤
(中国农业大学食品科学与营养工程学院,北京100083)
牛不同部位肌肉高铁肌红蛋白还原酶活力及耗氧率对肉色稳定性的影响
谢 丽,高晓光,苗 敬,胡文娟,戴瑞彤*
(中国农业大学食品科学与营养工程学院,北京100083)
为了研究牛不同部位肌肉的高铁肌红蛋白还原酶活力(MRA)和肉的呼吸耗氧强弱对肉色泽稳定性的影响,本文以牛的三个部位的肌肉:背最长肌(LL)、半腱肌(ST)、腰大肌(PM)为研究对象,4℃避光贮藏5d,测定MRA、肌红蛋白(MMb)含量、耗氧率(OCR)等,探究肉色稳定性与牛肉部位、MRA和呼吸耗氧率之间的关系。结果表明,三种肌肉中,背最长肌的色泽稳定性最好,腰大肌最差,半腱肌介于中间;MRA越高的肌肉,肉色越稳定;OCR越低的肌肉,肉色越稳定。
高铁肌红蛋白还原酶活力(MRA),耗氧率(OCR),肉色稳定性
Abstract:In order to explore the relationships among MRA,OCR and color stability of different bovine muscles,MRA,MMb and OCR were determined in longissimus lumborum(LL),semitendinosus(ST) and psoas major(PM) displayed for 5 days at 4℃ in the dark.The result indicated that color stability of LL was best,PM worst and ST in the middle.Moreover,muscles of higher levels of MRA or lower OCR had higher color stability.
Key words:metmyoglobin reducing activity(MRA);oxygen consumption rate(OCR);color stability of meat
肉以及肉制品的色泽对于消费者和生产厂商都具有重要的意义,因为肉的颜色被认为是评价肉及肉制品新鲜程度和品质特征的重要指标。肉制品生产商每年因为肉色褐变的损失高达数百万美元[1]。在屠宰后放血充分的生肉中,肉的颜色主要是由肌红蛋白在肉中的含量和存在状态决定的。肌红蛋白中血红素辅基的铁离子为正二价时,在无氧条件下肌红蛋白为还原型肌红蛋白(DeoMb),肉呈现暗紫色;而氧气充足时肌红蛋白和氧气结合成氧合肌红蛋白(OxyMb)时,肉呈现出令消费者喜爱的樱桃红色;当肌红蛋白血红素辅基中的铁离子被氧化成正三价态时,肌红蛋白以氧化态存在的高铁肌红蛋白(MetMb),其在肉中的堆积会使肉呈现褐色,影响消费者的购买欲。影响牛肉色泽的内部因素和外部因素很多,比如牛的品种、宰后时间、储藏温度等,有学者研究了牛不同部位肌肉的成熟期间的新鲜度[2],亦有研究表明,肌肽和脂肪氧化对肉色的稳定性有影响[3]。另据报道[4-6],肌肉的线粒体呼吸耗氧率也是影响肌肉色泽稳定性的重要因素。此外,肉中天然存在高铁肌红蛋白还原系统(metmyoglobin reducing system),系统中的高铁肌红蛋白还原酶(metmyoglobin reductase,MRase)可以将MetMb还原,在肉宰后一段时间内保持肉颜色的稳定性[7]。研究表明[8],牛的背最长肌是颜色最稳定的肌肉,腰大肌是颜色最不稳定的肌肉,而半腱肌的颜色稳定性介于二者之间。本文主要就鲁西黄牛的三个部位肌肉:背最长肌、腰大肌和半腱肌,进行实验研究,探究色泽稳定性、高铁肌红蛋白还原系统、呼吸耗氧率之间的相互关系,以期为进一步的研究奠定基础。
1 材料与方法
1.1 材料与设备
牛背最长肌、腰大肌、半腱肌 均购自北京御香苑集团公司,牛的品种为鲁西黄牛,宰后于4℃经24h冷却,低温运到实验室,除去表面脂肪和可见的筋膜,作为后续实验的材料;马心肌红蛋白、琥珀酸、NADH 美国Sigma公司;牛血清白蛋白(BSA) 拜尔迪生物有限公司;蔗糖、Tris-Base、HCl、NaH2PO4、EDTA等其他实验试剂 均为分析纯,购自北京蓝弋试剂公司。
AR2140型(精密度0.0001)电子天平 梅特勒-托利多仪器(上海)有限公司;F6-10型超速匀浆器上海Fluko流体机械制造有限公司提供;WSC-S型色差计 上海精密科学仪器有限公司提供;GL-20-II型高速冷冻离心机 上海安亭科学仪器厂;UV-2102C型紫外可见分光光度计 上海优尼科仪器公司;pH211台式酸度计 意大利哈纳科仪器公司;OXYGRAPH液相氧电极 英国汉莎(Hansatech)公司。
1.2 实验方法
1.2.1 肉样的处理 肉样取自9头育龄相同的鲁西黄牛,分别将背最长肌、腰大肌、半腱肌的可见脂肪和结缔组织除去,最后切分成大小相似的块状:2.5cm厚度、10cm左右直径,相同肌肉的样品置于同一托盘,测样时均匀取样。样品用保鲜膜托盘包装,储存在(4±0.5)℃避光的冰箱中,每隔1d进行样品的测定。
1.2.2 色差值的测定 每24h取样,将约5g肉绞碎搅匀,填充于比色皿内,压实抹平,保证测定时表面无气泡和可见的细小脂肪颗粒。用色差仪测定红度值a*、亮度值L*、黄度值b*。色差仪在使用前进行校准,白板的参数为:L*=94.61,a*=-0.52,b*=1.88。Chroma的计算式为:(a*2+b*2)1/2,Hue角度的计算式为:ATAN(b*/a*)×180/π。
1.2.3 pH的测定 取肉样10g绞碎置于90mL去离子水中,混匀振荡30min,测pH,重复三次取平均值。
1.2.4 高铁肌红蛋白还原酶活力的测定
1.2.4.1 MetMb及样品中粗酶液的提取 按照Mikkelsen的方法[9],进行高铁肌红蛋白还原酶活力的测定。肉样10g加20mL 4℃的磷酸盐缓冲液(2.0mmol/L,pH7.0),4℃下均质处理1min,10000r/min离心20min,上清液经中速定性滤纸过滤除去脂肪,滤液加入稍过量的高铁氰化钾氧化后,用冰的磷酸盐缓冲液(2.0mmol/L,pH7.0)4℃下透析24h,期间换液三次。透析完毕后,12000r/min离心20min(4℃),上清液作为高铁肌红蛋白还原酶的粗提液。
1.2.4.2 还原活性的测定 还原酶的活性用分光光度法测定。配制标准反应混合物,成分如表1(pH6.4,反应温度为25℃)所示,空白对照以水代替NADH,其他组分不变。反应加入NADH起始,用紫外-可见分光光度计在波长为580nm下,记录吸光值。依照Mikkelsen的方法[9],MetMb还原酶的活性用每毫升提取液在1min内在580nm下的吸光值变化来表示。在此波长下MbO2与MetMb的吸光值相差最大,两者的摩尔消光系数为12×103L·mol-1·cm-1。通过比较反应前后(在反应线性阶段)吸光值的变化,便可计算出高铁肌红蛋白还原活力。一个酶活力单位定义为:1U=1nmol MMb reduced/min,MMb还原酶比活力表示为反应线性阶段每毫克蛋白所具有的活力单位(U/mg),每个样品的酶活力测定重复三次,取平均值。

表1 高铁肌红蛋白还原酶(MRA)活力测定标准反应混合物Table 1 Reaction substances of metmyglobin reductase activity(MRA)
1.2.5 MetMb相对百分含量的测定 按照Tang[10]的方法,用分光光度计法进行MetMb相对百分含量的测定。取肉样20g,加入100mL浓度为0.04mol/L pH6.8的磷酸钠缓冲剂,室温下以转速10800r/min均质25s。均质液置于冰浴中放置1h,然后于4500×g、4℃下离心30min,将上清通过滤纸过滤,用同样的缓冲液补足至25mL。反应体系在分光光度计上扫描,波长分别为582、557、525、503nm。利用Tang[10]的公式计算出DeoMb,OxyMb,MetMb的相对百分含量。测定公式如下:
[DeoMb]=CDeoMb/CMb=-0.543R1+1.594R2+0.552R3-1.329
[OxyMb]=COxyMb/CMb=0.722R1-1.432R2-1.659R3+2.599
[MetMb]=CMetMb/CMb=-0.159R1-0.085R2+1.262R3-0.520
式中:R1=A582/A525,R2=A557/A525,R3=A503/A525。
1.2.6 耗氧率OCR(Oxygen Consumption Rate)的测定 依据Kaplan的方法[11],进行耗氧率的测定。OXYGRAPH液相氧电极,分别在4、25℃进行校正,用高浓度、现用现配的连二亚硫酸钠校正零氧线,然后用去离子水清洗反应室12次以上。再用OC Buffer(70mmol/L蔗糖、0.002mmol/L EDTA、20mmol/L Tris-HCl、5mmol/L K2HPO4,pH7.4)冲洗几次,向反应室加入1mL OC Buffer,盖好反应室盖子(保持密闭,以免外界氧气进入反应室)。开启转子,开始记录氧含量,等待2min使氧含量平稳。取肉样5g绞碎混匀在50mL去离子水中,测试时加入1mL肉液于反应室,立即计时,记录5min内的呼吸速率,即为肉的OCR。
2 结果与讨论
2.1 三种肌肉的色差值随贮藏时间的变化
三种肌肉:背最长肌(longissimus lumborum,LL)、腰大肌(psoas major,PM)、半腱肌(semitendinosus,ST)的色差值随时间的变化见表2。随着贮藏时间的变化,三种肌肉的色差值的变化规律有很大的不同。背最长肌的L*值随贮藏时间先降低后升高,腰大肌的L*值升高比较缓慢,半腱肌的L*值升高最多。在第5d时背最长肌和半腱肌的L*值并没有显著的差异(p>0.05)。而三种肌肉的红度值a*都随着贮藏时间的延长降低(p<0.05),背最长肌5d红度值降低了4.94,半腱肌降低了2.17,腰大肌降低了4.31;总体上红度值是:背最长肌>半腱肌>腰大肌。三种肌肉的Chroma都是随贮藏时间延长逐渐减小的。这些结论与之前许多学者的实验结果一致[12-14],本次实验结果亦表明,背最长肌和半腱肌的色泽稳定性优于腰大肌。
2.2 三种肌肉的pH随贮藏时间的变化
三种肌肉的pH都随着贮藏时间的延长而降低(p<0.05),其中背最长肌的pH下降最多,5d下降了0.5,半腱肌和腰大肌的pH下降较为缓慢,半腱肌5d下降了0.08,腰大肌5d下降了0.17,见表3。

表2 4℃贮藏5d的三种肌肉背最长肌(LL)、半腱肌(ST)、腰大肌(PM)的色差值Table 2Instrumental color of longissimus lumborum(LL),semitendinosus(ST),psoas major(PM)at 1,2,3,4,5d(4℃)
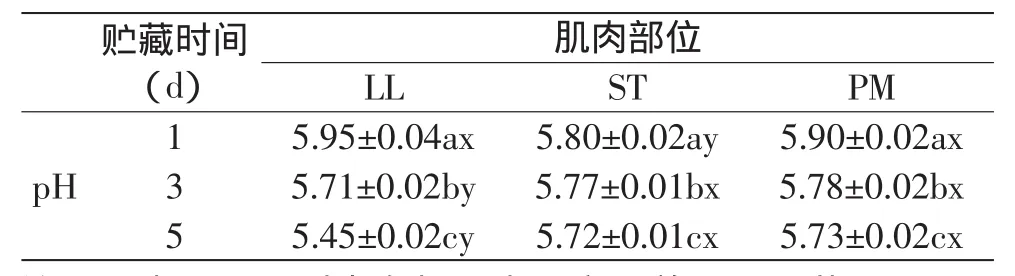
表3 4℃贮藏1、3、5d的背最长肌(LL)、半腱肌(ST)、腰大肌(PM)的pH变化Table 3 pH of longissimus lumborum(LL),semitendinosus(ST),psoas major(PM)at 1,3,5d(4℃)
第5d腰大肌的pH在三种肌肉中保持最高,这与Mark Seyfert的实验结果一致[12],LL、ST、PM最终pH在5.5~5.7之间,且PM最高。本实验的结果支持了D R Mckenna的pH与色泽的相关性并不显著的结论[14],他认为pH的差异并不显著,实验中仅相差0.1左右的差异在实际生产中是可以忽略的,pH与色泽的关联程度不高。在pH对肉色稳定性的影响方面,仍存在争议。
2.3 三种肌肉高铁肌红蛋白还原酶活力(MRA)随贮藏时间的变化
三种肌肉高铁肌红蛋白还原酶活力(MRA)随贮藏时间的变化见图1,三种肌肉的MRA都随着贮藏时间的延长而降低,背最长肌5d后MRA降低了0.026,半腱肌5d后MRA降低了0.025,腰大肌5d后MRA降低了0.024,三种肌肉MRA降低量基本一致,趋势与红度值a*随贮藏时间的变化相一致。许多学者的研究表明[12-14],红度值a*和Chroma与MRA的相关性很大,而且都是LL>ST>PM,色泽更稳定的肌肉(如背最长肌和半腱肌)的MRA要比色泽稳定性差的肌肉(如腰大肌)更高。D R Mckenn的研究[14]表明,色泽稳定性更高的肌肉,RIMF(Resistance to induced meymyglobin)值更高,即色泽越稳定的肌肉,积累的MetMb的量越少,这很可能是高铁肌红蛋白还原酶的作用。Madhavi和Carpenter[15]研究报道称,高铁肌红蛋白还原酶将MetMb还原的作用是依赖于NADH存在的,然而NADH在宰后的肉中的含量是逐渐减少的,宰后7d以后很难再检测到NAD,因此宰后的肉虽然MRA值仍然保持一定的水平,但肉色稳定性却难以维持。

图1 4℃贮藏5d的背最长肌(LL)、腰大肌(PM)、半腱肌(ST)的高铁肌红蛋白还原酶活力(MRA)Fig.1 Metmyoglobin reducing activity(MRA)of longissimus lumborum(LL),psoas major(PM),semitendinosus(ST)at 1,2,3,4,5d(4℃)
2.4 三种肌肉的MMb相对百分含量随贮藏时间的变化
三种肌肉的MMb相对百分含量随贮藏时间的变化见表4。三种肌肉的MMb含量随贮藏时间变化的趋势结果支持了红度值a*和MRA的结果,三种肌肉的高铁肌红蛋白(MetMb)含量都随着时间的延长而逐渐积累,其中腰大肌的MetMb百分含量显著高于背最长肌和半腱肌(p<0.05),随着时间的延长腰大肌MetMb的增加量也高于其他两种肌肉,背最长肌5d后MetMb含量增加了7.6%,半腱肌5d后MetMb含量增加了5.1%,腰大肌5d后MetMb含量增加了3.04%。从数据上看,半腱肌的颜色稳定性要高于背最长肌,因为氧合肌红蛋白含量高于背最长肌,高铁肌红蛋白含量低于背最长肌。王永辉、马丽珍[16]的研究表明肌肉中的氧分压大小与高铁肌红蛋白的产生和积累有很大的相关性,把肉纵切开可以看到由里至外的不同颜色:表面因为与氧气接触充分而呈现鲜红;中间因为氧分压低而呈现一层薄薄的褐色;下层因为无氧而呈现暗紫色。因此一些抗氧化剂比如VC、VE、茶多酚等[17],由于可以抑制肉中肌红蛋白的氧化,对肉以及肉制品护色很有效果。
2.5 三种肌肉的耗氧率随贮藏时间的变化
三种肌肉的耗氧率(OCR)随贮藏时间的变化见表5,随着贮藏时间的延长,三种肌肉的OCR都是逐渐降低的,其中腰大肌的呼吸强度最大,OCR值:PM>ST>LL,这与红度值a*、MRA和MetMb百分含量的顺序相反,即呼吸强度高的肉颜色稳定性越差,这与D R Mckenna的研究结果[14]一致。背最长肌4℃下OCR在5d后降低了109.77,25℃下OCR在5d后降低了194.95;半腱肌4℃下OCR在5d后降低了128.57,25℃下OCR在5d后降低了223.94;腰大肌4℃下OCR在5d后降低了186.19,25℃下OCR在5d后降低了338.38。这三种肉在25℃下ORC的下降值高于4℃近一倍,这可能是由于低温下的呼吸强度要弱于室温下的呼吸强度。不同肌肉的色泽稳定性差异是由于它们的肌纤维结构不同以及生物功能不同造成的,呼吸代谢更强的肌肉OCR更高,比主要依赖糖酵解代谢而非呼吸代谢的肌肉的色泽稳定性差[18]。Hunt和Hedrick的研究[19]表明,腰大肌含有更多的β-红纤维(β-red fibers),而背最长肌则含有更多的α-白纤维(α-white fibers),且腰大肌含有更多的线粒体,所以OCR高于背最长肌和半腱肌。线粒体浓度增加,呼吸耗氧上升,进而降低了氧分压,促使DeoMb生成和积累,DeoMb的稳定性不如OxyMb[20],更易氧化成MetMb,使肉色变褐;同时,呼吸速率的增加,使线粒体夺取OxyMb的氧,也会促使DeoMb的生成和积累,而DeoMb稳定性不如OxyMb,更易氧化生成MetMb,促使肉色褐变。
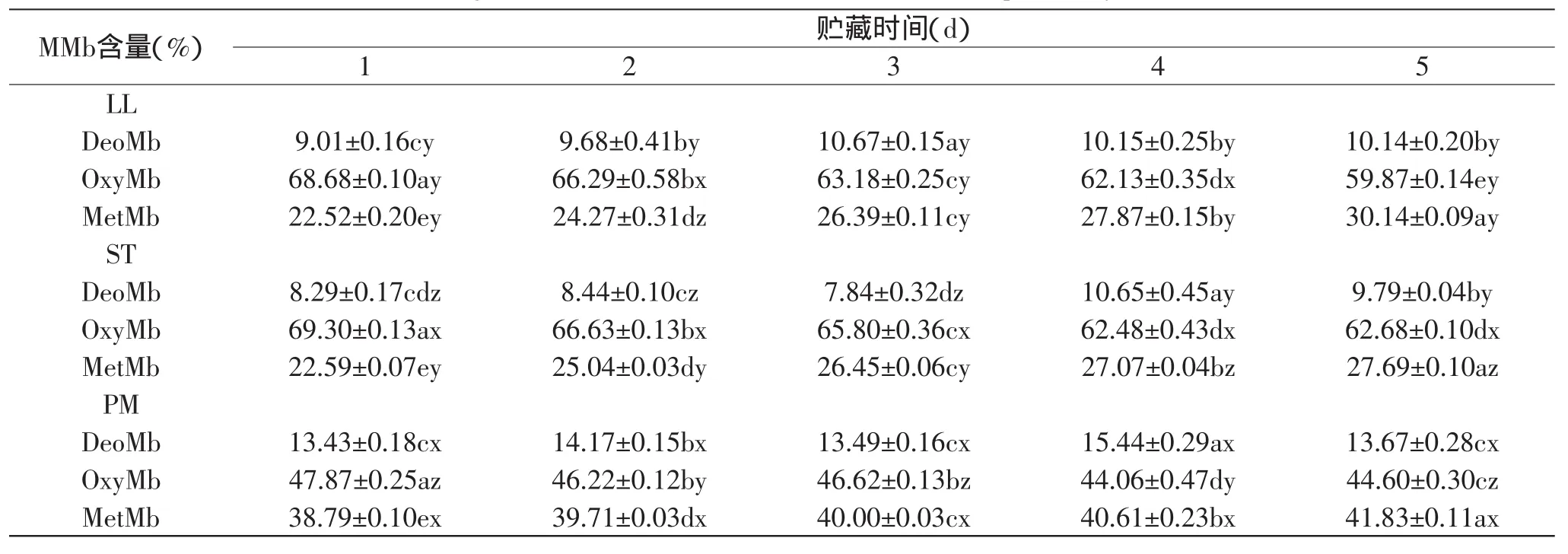
表4 4℃贮藏5d的背最长肌(LL)、半腱肌(ST)、腰大肌(PM)的MMb百分含量Table 4MMb form(%)of longissimus lumborum(LL),semitendinosus(ST),psoas major(PM)at 1,2,3,4,5d(4℃)

表5 4、25℃贮藏5d的背最长肌(LL)、半腱肌(ST)、腰大肌(PM)的耗氧率(OCR)Table 5Oxygen consumption rate(OCR)of longissimus lumborum(LL),semitendinosus(ST),psoas major(PM)at 1,2,3,4,5d(4℃ and 25℃)
3 结论
牛肉的色泽稳定性与高铁肌红蛋白还原酶活力(MRA)和呼吸耗氧率都有关联,而与pH的相关性不显著,三种肌肉的色泽稳定性顺序为:背最长肌(LL)>半腱肌(ST)>腰大肌(PM)。高铁肌红蛋白还原酶活性强的肌肉红度值高,褐变缓慢,色泽稳定性高;而耗氧率低的肌肉色泽稳定性更高,耗氧率(OCR)的顺序为腰大肌(PM)>半腱肌(ST)>背最长肌(LL),与红度值和MRA的顺序相反。
[1]Zerbyh N,Belk K E,Ahola J K,et al.Effects of muscle atocopherol level and surface microbiological contamination on retail case life of fresh beef from the US,Japan,and Australia[J].Meat Science,1999,52:111-118.
[2]刘笑笑,华晶忠,李树锦,等.成熟期间不同部位部位延边黄牛新鲜度变化的比较研究[J].食品工业科技,2011,32(8):361-367.
[3]刘芳,朱金媛,戴瑞彤.肌肽对牛肉糜肉色及脂肪氧化的影响[J].食品工业科技,2009,30(11):140-143.
[4]Ashmore C R,Parker W,Doerr L.Respiration of mitochondria isolated from dark-cutting beef:postmortem changes[J].Journal of animal science,1972,34(1):46-48.
[5]Faustman C,Cassens R G.The biochemical basis for meat discoloration in fresh meat:a review[J].Journal of Muscle Foods,1990,1(3):217-243.
[6]Lanari M C,Cassens R G.Mitochondrial activity and beef muscle color stability[J].Journal of Food Science,1991,56(6):1476-1479.
[7]Dean R W,Ball C O.Analysis of themyoglobin fractions on the surface of beef cut[J].Food Technology,1960,14:271-285.
[8]McKenna D R,Mies P D,Baird B E,et al.Biochemical and physical factors affecting discoloration characteristics of 19 bovine muscles[J].Meat Science,2005,70:665-682.
[9]Mikkelsen A,Juncher D,Skibsted Lh.Metmyoglobin reductase activity in porcine m.longissimus dorsi muscle[J].Meat Science,1999,51(2):155-161.
[10]Tang J,Faustman C,hoagland T A.Krzywicki revisited:Equations for spectrophotometric determination of myoglobin redox forms in aqueous meat extracts[J].Food Chemistry and Toxicology,2004,69:717-720
[11]Ann E Kaplan-Bresler.Metmyoglobin oxidation during electron transport reactions in mitochondria[J].Journal of General Physiology,1965,48(4):685-698.
[12]Seyfert M,Mancini R A,hunt M C,et al.Color stability,reducing activity,and cytochrome c oxidase activity of five bovine muscles[J].Journal of Agricultural and Food Chemistry,2006,54:8919-8925.
[13]Seyfert M,Mancini R A,hunt M C,et al,Influence of carbon monoxide in package atmospheres containing oxygen on colour,reducing activity,and oxygen consumption of five bovine muscles[J].Meat Science,2007,75:432-442.
[14]McKenna D R,Mies P D,Baird B E,et al.Biochemical and physical factors affecting discoloration characteristics of 19 bovine muscles[J].Meat Science,2005,70:665-682.
[15]Madhavi D L,Carpenter Ch.Aging and processing affect color,metmyoglobin reductase and oxygen consumption of beef muscles[J].Journal of Food Science,1993,58(5):939-942.
[16]王永辉,马丽珍.肌肉颜色变化的机理及其控制方法初探[J].肉类工业,2006(4):18-21.
[17]戴瑞彤,南庆贤.抗氧化剂对冷却牛肉护色效果的研究[J].食品工业科技,2001(4):65-69.
[18]Reneer M,Labas R.Biochemical factors influencing metmyoglobin formation in beef muscles[J].Meat Science,1987,19:151-165.
[19]hunt M C,hedrickh B.Profile of fiber types and related properties of five bovine muscles[J].Journal of Food Science,1977,42(2):513-517.
[20]Richards M P,Modra A M,Li R.Role of deoxyhemoglobin in lipid oxidation of washed cod muscle mediated by trout,poultry,and beefhemoglobins[J].Meat Science,2002,62(2):157-163.
Effect of postmortem time on metmyoglobin reducing activity and oxygen consumption of different bovine muscles
XIE Li,GAO Xiao-guang,MIAO Jing,HU Wen-juan,DAI Rui-tong*
(College of Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China)
TS201.2
A
1002-0306(2012)16-0342-05
2011-12-27 *通讯联系人
谢丽(1987-),女,硕士研究生,研究方向:畜产品科学。
国家自然科学基金项目(31071624)。
