大孔吸附树脂纯化乳苣多酚的研究
2012-09-11周向军高义霞张慧芳
周向军,高义霞,张慧芳,张 继,2,*
(1.天水师范学院生命科学与化学学院,甘肃天水741001;2.西北师范大学生命科学学院,甘肃兰州730070)
大孔吸附树脂纯化乳苣多酚的研究
周向军1,高义霞1,张慧芳1,张 继1,2,*
(1.天水师范学院生命科学与化学学院,甘肃天水741001;2.西北师范大学生命科学学院,甘肃兰州730070)
通过吸附和解吸附实验筛选适合乳苣多酚纯化的大孔吸附树脂并确定其最佳工艺。结果表明:D-101为乳苣多酚纯化的最佳树脂,在150min内达到吸附平衡,120min内解吸附平衡。最佳上样浓度为0.2mg·mL-1,pH4,解吸剂浓度为60%乙醇,洗脱速率为0.5mL·min-1,洗脱体积为3BV。紫外吸收表明纯化后乳苣多酚纯度得到提高。结果说明,D-101可用于乳苣多酚进一步纯化。
乳苣,多酚,纯化,大孔吸附树脂
Abstract:According to adsorption and desorption performance towards polyphenol,an optimal macroporous resin was selected from D-101,NKA-9 and AB-8 resins to purify crude polyphenol extracted from Mulgedium tataricum L.The results showed that D-101 was the optimal resin and consequently,was chosen.The optimal adsorption and desorption conditions of Mulgedium tataricum L.polyphenol were determined as follows:The adsorption equilibrium time was 150min and desorption 120min.Polyphenol concentration of sample was 0.2mg·mL-1,pH4,the optimal desorbent concentration,flow rate and elution volume for the desorption of Mulgedium tataricum L.polyphenol were 60%ethanol,0.5mL·min-1and 3BV.Ultraviolet absorption showed that Mulgedium tataricum L.polyphenol purity was improved after column adsorption,which indicated D-101 could be furtherly used to purify Mulgedium tataricum L.polyphenol.
Key words:Mulgedium tataricum L.;polyphenol;purification;macroporousresin
植物多酚(plant polyphenol)是一类多羟基化合物,在植物中的含量仅次于纤维素、半纤维素和木质素,主要存在于植物的叶、果等部位[1]。植物多酚具有抗癌、抗氧化、抗病毒、降血压、降血糖、抗辐射、抗动脉硬化、防冠心病等一系列药理作用[2-3],但目前大多数研究集中在茶多酚、苹果多酚和葡萄多酚等方面[4-5]。乳苣(Mulgedium tataricum L.),又称蒙山莴苣、紫花山莴苣、苦菜,为菊科乳苣属多年生草本植物,广泛分布于欧洲及我国内蒙古及西北地区[6]。本课题组前期研究表明乳苣富含多酚类物质,高达36%[7],但关于大孔吸附树脂纯化乳苣多酚的工艺未见报道。大孔吸附树脂是一种不溶于酸、碱及各种有机溶剂的新型非离子型高分子聚合物,由于其具有物化稳定性高、比表面积大、吸附容量大、选择性强、吸附速度快、成本低和吸附解析条件温和等一系列优点,因而在天然活性物质,尤其是黄酮、皂苷和生物碱等水溶性化合物的分离纯化方面具有一定的优势[8-9]。本课题组在前期研究的基础上[7]以乳苣为材料,比较几种大孔吸附树脂对乳苣多酚的吸附性能,筛选出合适的树脂,并确定最佳的吸附和解吸附条件,对乳苣多酚的纯化效果进行比较,旨在探讨大孔吸附树脂吸附工艺,确定可靠的工艺参数,为进一步开发利用乳苣资源奠定基础。
1 材料与方法
1.1 材料与仪器
乳苣 采自甘肃靖远县水田边,经天水师范学院汪之波副教授鉴定为菊科乳苣属,50℃杀青粉碎过80目筛备用;Folin-Ciocaileu(Folin试剂) 试剂配制按王岸娜的方法稍作修改[10]︰在1L磨口回流装置内加入50g钨酸钠,12.5g钼酸钠,350mL蒸馏水,25mL 85%浓磷酸及50mL 37%浓盐酸,充分混匀以小火回流10h,加入75g硫酸锂,25mL蒸馏水,30mL H2O2,开口继续加热至沸,维持15min,驱除多余的溴,溶液呈金黄色,冷却后补足蒸馏水至500mL,置于冰箱中长期冷藏备用,临用时稀释1倍;NKA-9,AB-8,D-101三种大孔吸附树脂 天津南开大学化工厂;其余试剂均为分析纯。
722型分光光度计 上海欣茂仪器有限公司;UV1800型紫外分光光度计 日本岛津;电子天平德国梅特勒-托利多;旋转蒸发仪 上海亚荣。
1.2 实验方法
1.2.1 乳苣多酚粗提液的制备 在前期实验的基础上进行[7]。在提取时间40min,浸提温度35℃,液固比1∶25,乙醇浓度55%条件下进行乳苣多酚提取,3000r·min-1离心10min,保留上清液,滤渣进行第二次抽提,合并两次上清液,旋转蒸发浓缩并定容,得多酚粗提液。
1.2.2 标准曲线的制作及乳苣多酚含量的测定 按张汆的方法稍作修改[11]。精密称取没食子酸标准品0.05g,溶解并定容至100mL,得0.5mg·mL-1的标准溶液。准确吸取 0、1、2、3、4、5、6mL 标准溶液,置于50mL容量瓶中,蒸馏水定容。分别从上述不同浓度的标准溶液中移取5mL置50mL容量瓶中,各加入25mL蒸馏水,4mL Folin-试剂,摇匀,静置4~5min后各加入8mL 10%Na2CO3溶液,蒸馏水定容,置于75℃恒温水浴锅中10min,显色后于765nm波长处测定吸光度。以吸光度为纵坐标,没食子酸质量(mg)为横坐标,绘制标准曲线。取一定体积乳苣多酚液,同标准曲线操作,计算样液多酚含量,使用前稀释成一定浓度。
多酚含量(mg)=样液多酚含量(mg)/样液体积(mL)×提取液总体积(mL)×10
1.2.3 大孔吸附树脂的预处理 AB-8、NKA-9、D-101大孔吸附树脂用95%乙醇室温下密封浸泡24h,使之充分溶胀,用蒸馏水反复冲洗至无白色浑浊,然后加入4%氢氧化钠溶液浸泡12h,用蒸馏水洗至中性,再用4%的盐酸溶液浸泡12h,用蒸馏水洗至中性,滤出树脂备用[12]。
1.2.4 静态吸附解吸实验 准确称取用滤纸吸干的AB-8、NKA-9、D-101 树脂各0.5g,置于100mL 锥形瓶中,加入50mL 0.5mg·mL-1的乳苣多酚液,避光密封,在28℃恒温恒速振荡器中振荡(120r·min-1)吸附6h,每隔1h取1mL吸附液测其多酚含量;静态吸附后,过滤除去乳苣多酚溶液,用蒸馏水洗净滤干,树脂置于100mL锥形瓶中,加入50mL 95%乙醇,避光密封,在28℃恒温恒速振荡器中振荡(120r·min-1)解吸6h,每隔1h取1mL解吸液测其多酚含量,考察乳苣多酚不同树脂的静态吸附解吸曲线[13]。
吸附率A(%)=(C0-C1)/C0×100
式中 C0,C1-吸附前后样液多酚浓度,mg·mL-1;
解吸率D(%)=(C'1×V1)/(C'0×V0×A)×100
式中:A为吸附率;C'1-解吸后溶液浓度,mg·mL-1;V1-解吸液体积;V0-洗脱液体积,mL;C'0-吸附液起始浓度,mg·mL-1。
1.2.5 动态吸附解吸附实验
1.2.5.1 吸附实验 a.不同样液浓度对吸附率的影响:准确称取经预处理的一定质量的D-101树脂转入250mL具塞锥形瓶,分别加入不同体积的乳苣多酚样液,使其终浓度分别为 0.05、0.1、0.2、0.4、0.8mg·mL-1,28℃振荡(120r·min-1)吸附,测定溶液多酚浓度,计算吸附率。b.不同pH对吸附率的影响:在上述确定的乳苣多酚浓度下,分别加入pH为2、3、4、5、6、7的多酚样液,操作同上,测定溶液多酚浓度,计算吸附率。
1.2.5.2 解吸实验 a.不同洗脱剂的选择:以60%的甲醇、乙醇、丙酮和蒸馏水为洗脱剂,加入到含饱和吸附树脂的锥形瓶中,28℃振荡解吸附(120r·min-1),测定解吸率,考察不同洗脱剂对洗脱效果的影响。b.最佳洗脱剂浓度的选择:以40%、50%、60%、70%、80%、90%的乙醇为洗脱剂对已吸附饱和的D-101树脂进行解吸附,测定解吸液的多酚浓度,计算解吸率,考察最佳洗脱剂浓度。c.不同洗脱速度对乳苣多酚解吸的影响:取经过预处理的D-101树脂装入玻璃层析柱中(1×30cm)。在最佳吸附浓度和pH条件下上柱,考察流速分别为0.5、1、2、3mL·min-1时乳苣多酚样液的多酚含量,确定最佳流速。d.以多酚含量为纵坐标,洗脱体积为横坐标,绘制洗脱体积曲线。
1.2.6 纯化前后乳苣多酚波长扫描比较 纯化前后乳苣多酚在250~450nm范围内进行波长扫描,以考察乳苣多酚纯化情况。
2 结果与分析
2.1 标准曲线的制作
以没食子酸为标准品,多酚测定标准曲线回归方程为Y=2.9579X-0.01,R2=9991,线性良好,见图1,可用于乳苣多酚含量测定。式中︰Y为765nm处吸光度;X为多酚质量(mg)。

图1 没食子酸标准曲线Fig.1 Standard curve of gallic acid
2.2 大孔吸附树脂静态吸附及解吸附乳苣多酚比较
三种大孔树脂的基本特性见表1。影响大孔吸附树脂吸附性能的因素较多,包括树脂结构、极性、比表面积、粒径、孔径以及与被吸附分子的极性、分子大小等。多数多酚类化合物为弱极性分子,在非极性树脂上吸附效果更好[14]。一般非极性树脂易从极性溶剂中吸附非极性化合物,极性树脂易从非极性溶剂中吸附极性物质,而中等极性树脂不仅能从非水介质中吸附极性物质、也能从极性溶剂中吸附非极性物质。乳苣多酚静态吸附和解吸附结果见图2和图3。由图2可知,三种大孔树脂对乳苣多酚均具有一定的吸附能力,在吸附初期均能快速吸附乳苣多酚,且几乎成线性增长关系,150min后达到吸附平衡。D-101是非极性树脂且比表面积最大,故吸附率最大,达到18.47%。虽然AB-8比表面积大于NKA-9,但其平均孔径小于后者,限制了多酚的吸收,因此二者吸附率相差不大。吸附率顺序依次为:D-101>NKA-9>AB-8。解析率主要取决于吸附树脂和被吸附物结合力的强弱,D-101树脂吸附非极性和弱极性的主要作用力为范德华力,而NKA-9树脂吸附极性物质主要作用力为氢键,AB-8树脂吸附作用力两者均有。因此D-101吸附树脂解析率最高,达到98.5%。由图3可知,60%乙醇对三种大孔树脂均具有较好的解吸附能力,且解吸速率较快,120min内达到解吸平衡。解吸速率依次为D-101>AB-8>NKA-9。结合三种大孔树脂对乳苣多酚的吸附和解吸附能力可知,D-101对乳苣多酚具有最高的吸附率和解吸率,因此本实验选择D-101大孔吸附树脂作为纯化乳苣多酚的最佳树脂,选择150min为吸附平衡时间,120min为解吸平衡时间。

表1 三种大孔树脂的基本特性Table 1 Fundamental characteristic of three types of macroporousresin

图2 乳苣多酚吸附曲线Fig.2 Adsorption curve of polyphenol
2.3 动态吸附条件的确定

图3 乳苣多酚解吸附曲线Fig.3 Desorption curve of polyphenol
2.3.1 不同乳苣多酚浓度和pH对吸附率的影响不同乳苣多酚浓度吸附平衡时对吸附率的影响图见4(a)。由图可知在0.05~0.2mg·mL-1范围内,随多酚浓度的增加吸附率逐渐增加,0.2mg·mL-1时吸附率最大,达到32.4%,随后吸附率随多酚浓度增加而减少,这可能是树脂表面多酚分子过多,阻碍其它分子进入树脂内部,从而影响了多酚分子在树脂内部的扩散,导致吸附率下降。同时样液浓度增加致使杂质与多酚竞争机会增大[15],因此最佳上样浓度选择 0.2mg·mL-1。

图4 乳苣多酚浓度(a)和pH(b)对吸附率的影响Fig.4 Influence of polyphenol concentration(a)and pH(b)on adsorption rate
不同pH吸附平衡时对吸附率的影响见图4(b)。大孔吸附树脂主要以范德华力与有机物结合,因此有机物的存在形式直接影响其在树脂上的吸附效果[15]。实验中未考虑碱性范围,主要是多酚类化合物容易转变为钅羊盐,以盐的形式存在不易被树脂吸附,而且碱性条件下酚羟基容易氧化而使溶液颜色加深[16]。由图可知,在pH较低范围内,D-101树脂对乳苣多酚的吸附率呈缓慢上升趋势,主要原因是当溶液pH较小时,酚类物质糖苷键容易水解,影响树脂对其吸附[17];当pH=4时,吸附率最大;pH继续增大时,吸附率下降,这是由于乳苣多酚具有酚羟基,在偏离其pK范围内-OH基团上的H+可解离出来,以离子形式存在于水中,此时不易被树脂吸附;在酸性条件下具有酚羟基结构的多酚大部分以分子状态存在,可借助范德华力与树脂发生物理吸附作用[18],因此选择pH=4作为最佳pH。
2.4 动态解吸条件的确定
2.4.1 解吸剂的选择 由图5可知,3种解吸剂在120min内解吸率以60%乙醇最高,达到了95.64%。其次为 60%丙酮、60%甲醇,分别为 75.56%、47.76%。另外蒸馏水的效果最差,实验过程中几乎未检测到解吸率。考虑到甲醇、丙酮毒性较大,对后续工作不利[19],且乙醇解吸效果好,安全方便,所以选择乙醇为最佳洗脱剂。

图5 不同洗脱剂的选择Fig.5 Selection of different desorbent
2.4.2 乙醇浓度对解吸效果的影响 由图6可知,在40%~60%乙醇范围内,随着乙醇浓度的增加解吸率逐渐升高,当达到60%乙醇时解吸率最高。乙醇浓度高于60%时解吸率降低,可能是由于乙醇浓度增大将其他与树脂吸附的杂质也一起洗脱[20-21];同时考虑到生产成本增加及乙醇挥发性增强等因素,选择60%乙醇为最佳解吸附浓度。

图6 乙醇浓度的选择Fig.6 Selection of ethanol concentration
2.4.3 洗脱速率对解吸效果的影响 洗脱速率一般要求不能过快,否则洗脱带宽且拖尾严重,但也不能过慢,否则延长生产周期[22]。由图 7可知,2mL·min-1的洗脱峰形宽且洗脱液多酚含量最低[23],3mL·min-1的洗脱峰虽然较窄,但洗脱液多酚含量不高,且拖尾严重。与1mL·min-1的洗脱速率相比较,0.5mL·min-1的洗脱速率虽然洗脱液中多酚浓度相对稍低,但其洗脱峰窄,且没有拖尾现象。故选择0.5mL·min-1为最佳洗脱速率。
2.4.4 洗脱体积对解吸效果的影响 经计算1BV约为20mL,由图8可知,D-101树脂吸附的乳苣多酚极易洗脱,当洗脱速度为0.5mL·min-1时,60%乙醇仅0.25BV时乳苣多酚可被洗脱检测,为0.0727mg·mL-1;洗脱体积增至0.75BV时,多酚浓度达到最大值,为1.3861mg·mL-1。随后洗脱效果开始下降,当洗脱液达3BV时,乳苣多酚基本洗脱完全,多酚浓度为 0.0473mg·mL-1。
2.5 乳苣多酚纯化前后波长扫描比较
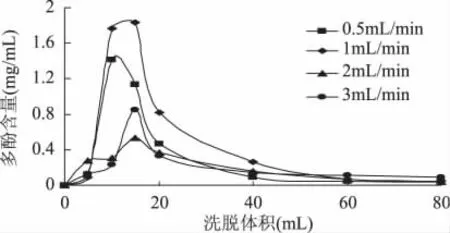
图7 洗脱速率的选择Fig.7 Selection of elution rate

图8 乳苣多酚洗脱体积Fig.8 Elution volume of polyphenol
由图9可以看出,纯化前后样品具有相似的紫外吸收光谱,在270~280nm和350~370nm处的吸收峰符合酚类化合物吸收特征[24-25]。相同浓度下纯化后样品光吸收值明显高于粗提物,由此可见,D-101大孔吸附树脂适合乳苣多酚的进一步纯化。
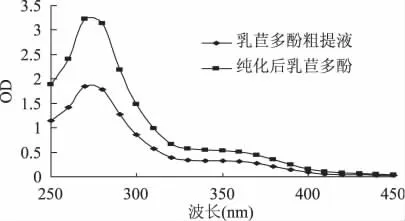
图9 乳苣多酚纯化前后紫外吸收光谱比较Fig.9 Comparison of ultraviolet absorption of polyphenol
3 结论
通过对3种大孔吸附树脂的吸附和解吸附特性的比较,可知D-101树脂适合于乳苣多酚的纯化。吸附和解吸附最佳实验条件:D-101树脂在150min达到吸附平衡,120min解吸平衡。最佳浓度为0.2mg·mL-1,pH4,解吸剂浓度为60%乙醇,洗脱速率为0.5mL·min-1,洗脱体积为3BV。结果表明,D-101树脂成本低,操作简单和周期短,适合乳苣多酚吸附和解吸附及大规模生产等。
[1]宋立江,狄莹,石碧.植物多酚研究与利用的意义及发展趋势[J].化学进展,2000,12(2):161-170.
[2]刘璇,林松毅,王二雷,等.长白山笃斯越桔叶片中多酚类化合物提取技术研究[J].食品科学,2007,28(11):249-252.
[3]Jiangsu institute of Botany,Xinhua compendium of meteriamedica[M].Shanghai Science Technical Publishing Press,China,1990,435.
[4]程正涛,丁庆波,张昊,等.海红果多酚提取工艺优化[J].食品科学,2010,31(24):172-176.
[5]王博,王新现,吕舂茂,等.苹果渣中多酚类物质的提取和应用研究进展[J].食品工业科技,2011,32(6):421-423.
[6]中国科学院中国植物志编写委员会.中国植物志[M].第80卷,第一分册.北京:科学出版社,1997:75.
[7]周向军,高义霞,李娟娟,等.乳苣多酚提取工艺及其抗氧化研究[J].中国酿造,2011(9):118-121.
[8]吕群金,衣杰荣,丁勇.大孔吸附树脂对杨桃渣多酚吸附分离的优化[J].食品科学,2010,31(1):39-42.
[9]熊何健,吴国宏.大孔吸附树脂分离纯化葡萄多酚的研究[J].食品研究与开发,2007,28(11):74-77.
[10]王岸娜,徐山宝,刘小彦,等.福林法测定猕猴桃多酚含量的研究[J].食品科学,2008,29(7):398-401.
[11]张汆,李敏,薛连海,等.三种吸附剂对芡实多酚的吸附特性研究[J].食品工业科技,2010,31(10):101-104.
[12]欧阳玉祝,吕程丽,郑胜丰,等.大孔树脂吸附法分离过路黄中的总多酚[J].食品科学,2009,30(22):213-216.
[13]刘晓丽,吴克刚,柴向华,等.海带多酚的纯化及其抗氧化活性研究[J].食品工业科技,2010,31(5):160-163.
[14]汤建萍,周春山,丁立稳.大孔吸附树脂分离纯化荔枝核黄酮类化合物的研究[J].离子交换与吸附,2006,22(6):551-558.
[15]艾志录,王育红,王海,等.大孔树脂对苹果渣中多酚物质的吸附研究[J].农业工程学报,2007,23(8):245-248.
[16]陈从瑾,黄克瀛,李姣娟,等.大孔吸附树脂分离纯化香椿叶总黄酮的研究[J].离子交换与吸附,2008,24(4):335-344.
[17]张立华,张元湖,安春艳,等.石榴皮提取物的大孔树脂纯化及其抗氧化性能[J].农业工程学报,2009,25(S1):142-147.
[18]叶春,阚建全,谭书明,等.鱼腥草叶总黄酮的提取分离[J].农业工程学报,2008,24(10):227-232.
[19]金莹,孙爱东.大孔树脂纯化苹果多酚的研究[J].食品科学,2007,28(4):160-163.
[20]徐青,卢莹莹,辛建美,等.大孔树脂吸附分离海芦笋中黄酮类化合物工艺[J].食品科学,2011,32(2):115-119.
[21]冯建光.大孔吸附树脂分离纯化朝鲜蓟叶中洋蓟素的研究[J].中草药,2011,42(6):1109-1113.
[22]张海晖,段玉清,李金凤,等.板栗壳中原花青素大孔吸附树脂分离纯化工艺优化[J].农业机械学报,2011,42(5):156-155.
[23]李娜,鲁晓翔.大孔吸附树脂分离纯化红花总黄酮的研究[J].食品工业科技,2011,32(4):276-279.
[24]张茜,贾冬英,姚开,等.大孔吸附树脂纯化石榴皮多酚[J].精细化工,2007,24(4):345-349.
[25]刘军,郎爱东,聂磊.柿叶黄酮类成分的HPLC指纹图谱研究[J].中国中药杂志,2008,33(6):694-695.
Purification of polyphenol in Mulgedium tataricum L.with macroporousresin
ZHOU Xiang-jun1,GAO Yi-xia1,ZHANG Hui-fang1,ZHANG Ji1,2,*
(1.College of Life Science and Chemistry,Tianshui Normal University,Tianshui 741001,China;2.Department of Life Science,Northwest Normal University,Lanzhou 730070,China)
TS255.1
B
1002-0306(2012)12-0281-05
2011-10-20 *通讯联系人
周向军(1980-),男,研究生,讲师,主要从事天然产物研究与开发方面的研究。
天水师范学院重点学科支持项目(ZD08037);国家自然科学基金资助项目(50773064)。
