酵母细胞壁多糖分子量分布和结构的初步分析
2012-09-11成建国张善飞赵长新郭继强
成建国,张善飞,张 利,赵长新,郭继强
(大连工业大学生物工程学院,辽宁大连116034)
酵母细胞壁多糖分子量分布和结构的初步分析
成建国,张善飞,张 利,赵长新,郭继强*
(大连工业大学生物工程学院,辽宁大连116034)
以啤酒酵母细胞壁多糖为研究对象,比较了Sevage法和三氯乙酸(TCA)法脱蛋白效果,利用凝胶渗透色谱法(GPC)测定了细胞壁多糖的分子量分布,用葡聚糖凝胶G-100对多糖进行了纯化,最后用红外光谱法分析了多糖组分D的结构,结果表明:Sevage法脱蛋白效果较好,GPC测定结果得出酵母细胞壁多糖有5个组分,其重均分子量为1.31745×105、7.0863 ×104、3.6988 ×104、1.8277 ×104、8.342 ×103。红外光谱分析得出多糖组分 D 在 890.51cm-1和808.48cm-1有特征吸收,为β-D-吡喃型结构,在844cm-1处没有吸收峰,不含有或含有少量的α-型糖苷键。
细胞壁多糖,凝胶渗透色谱法,红外光谱法
Abstract:Yeast cell wall polysaccharides was used as raw material,the effect of Sevage method and trichloroacetic acid(TCA)method for removing protein were compared.The molecular weight distribution of cell wall polysaccharides was measured by gel permeation chromatography(GPC).Purified polysaccharides with Sephadex G-200,and the structure of cell wall polysaccharides was analyzed by infrared spectroscopy analysis.The results showed that sevage method showed the better deproteinization effect.GPC measured result showed that yeast cell wall polysaccharides had five components,the corresponding average molecular weight(Mw)of the five constituents were 1.31745 ×105、7.0863 ×104、3.6988 ×104、1.8277 ×104、8.342 ×103.The IR spectra showed that the polysaccharide D characteristic was β-D-pyran-type structure which had characteristic absorption in 890.51cm-1and 808.48cm-1,there did not find the absorption peak in the 844cm-1,so not or less of the α-type glycosidic bond.
Key words:cell wall polysaccharides;gel permeation chromatography(GPC);infrared spectroscopy
近年来,由于多糖和多糖的复合物糖肽具有很好的生物活性,在抗氧化、抗肿瘤、抗病毒等方面起到了有效的作用,并且微生物多糖具有安全无毒、理化性质独特、来源广泛等优良性质[1-4],因此越来越受到广大食品、医学、生物学家们的关注。目前对啤酒酵母的综合利用大多数集中在蛋白质、核酸、维生素、微量元素和酶方面,对其细胞壁多糖的开发应用研究很少,所以对酵母细胞壁多糖的研究很有前景。在酵母细胞壁多糖的研究中对多糖进行纯化是很重要的一个环节,而且一般提取到的多糖组成也比较复杂,酵母多糖的生物活性和结构与相对其分子量大小有着密切的联系。本文以啤酒酵母为材料,对细胞壁多糖进行了提取纯化[5],利用(GPC)凝胶色谱进行了多糖分子量分布测定[6-9],并且还利用拉曼红外光谱法进行了结构分析[10-14],为今后研究酵母细胞壁多糖的生物活性和结构提供了方法和理论依据。
1 材料与方法
1.1 材料与仪器
啤酒酵母 大连工业大学菌种保藏中心提供;葡聚糖标准品(Dextran Standard)系列(色谱纯)、葡聚糖凝胶G-100、纤维素DEAE-52 Sigma公司;其它试剂 均为分析纯。
LABCONCO型低温冷冻干燥机 美国LABCONCO公司;低速离心机 安徽中科中佳科学仪器有限公司;UV-2550型紫外分光光度计 日本岛津;Nexus-870型傅里叶变换红外光谱仪 Nicolet公司;Waters 2695型凝胶渗透色谱系统 Waters公司。
1.2 实验方法
1.2.1 酵母菌的培养 将酵母菌从斜面接种到YPD培养基中(酵母膏1%、蛋白胨2%、葡萄糖2%、pH6.0)500mL三角瓶装液量150mL培养16h达到对数生长期,按5%接种量接入YPD培养基中4.5L发酵罐培养(溶氧 60%、初始 pH6.0、30℃、转速200r/min),培养48h后收集培养液,4000r/min离心20min取沉淀,沉淀用0.05mol/L的PBS缓冲液反复洗涤三次得到酵母细胞,菌体进行冷冻干燥,-80℃保藏备用。
1.2.2 酵母细胞壁粗多糖的提取 取干酵母用0.1mol/L的 Tris-HCl缓冲液(0.5mmol/L EDTA、0.5mmol/L DTT)悬浮菌体料液比1∶20,进行超声波细胞破碎(800W,15min,冰浴),4000r/min离心20min收集沉淀,用PBS缓冲液反复洗涤沉淀直到上清液澄清为止,得到酵母细胞壁。然后把细胞壁用0.2mol/L的NaOH稀碱液悬浮,料液比1∶50,沸水浴震荡提取4h,4000r/min离心20min取上清液得到酵母细胞壁粗多糖进行下一步实验。
1.2.3 粗多糖脱蛋白 采用文献[6]的优化结果进行粗多糖中蛋白质的脱除(用Sevage萃取三次,4%的TCA盐析过夜),最后再用3倍体积无水乙醇进行醇沉过夜,4000r/min离心20min取沉淀用去离子水溶解,然后用3ku分子量的透析袋进行透析24h,冷冻干燥,取冻干的多糖配制成2mg/mL,用紫外分光光度计在180~1100nm范围内进行全波长扫描,通过检测有无蛋白和核酸特征吸收峰来确定脱蛋白效果。
1.2.4 GPC酵母细胞壁多糖分子量分布测定
1.2.4.1 GPC校正曲线的制作 色谱条件:色谱柱TOSOH 公司 Shodex SUGAR SC1211(6μm,250mm ×6mm),流动相0.05mol/L NaH2PO4/Na2HPO4缓冲溶液,pH7.0;流速0.5mL/min;柱温40℃;进样量20μL。
将相对分子质量分别为 5900、11800、22800、47300、112000、212000、404000 的葡聚糖 标 准品Dextran用流动相配成质量浓度为1.0mg/mL的标准样品液,进样量为20μL,采集色谱图。以标准葡聚糖分子量的对数lgMw为纵坐标,洗脱体积Ev为横坐标,绘制“lg Mw-Ev”曲线,用 Breeze GPC系统软件对曲线进行n次回归拟合(n=1~5),得出与曲线相关度较好的葡聚糖GPC校正曲线方程[6-9]。
1.2.4.2 啤酒酵母细胞壁多糖分子量分布测定 采用1.2.3中脱蛋白方法较好地进行细胞壁多糖的精制,把干燥好的多糖样品用流动相配制成2.0mg/mL,过0.45μm水系微孔复合膜,取1mL手动上样,采集色谱图。根据1.2.4.1所得到的葡聚糖校正曲线,利用Breeze GPC系统软件分析酵母细胞壁多糖的GPC谱图,计算出多糖各组分的重均分子量Mw和相应峰面积。
1.2.5 葡聚糖凝胶G-100纯化酿酒酵母细胞壁多糖
葡聚糖凝胶G-100经过处理后装柱到60cm,取脱蛋白后冻干的粗多糖配制成5mg/mL,上样2mL,以0.2mol/L的 NaCl进行洗脱,控制洗脱速度0.5mL/min,每管收集3mL,用紫外可见分光光度计在220nm处测定吸光值,检测多糖吸收峰,取吸收峰面积最大的组分D,透析冻干进行纯度鉴定。
1.2.6 多糖的DEAE-52柱层析纯度鉴定 纤维素凝胶DEAE-52用1mol/L的HCl和1mol/L的NaOH先后处理4h,然后用去离子水洗至中性,装柱40cm用去离子水平衡3h,然后取冻干的多糖组分D,用水稀释到一定浓度上样,再用0.05~1.0mol/L的NaCl梯度洗脱,流速1mL/min,每管3mL收集洗脱液,紫外分光光度计220nm处检测结果。
1.2.7 红外光谱法分析细胞壁多糖结构 取冻成干粉的酵母细胞壁多糖样品组分D 50mg,加入1g干燥溴化钾粉末在玛瑙研钵中混匀,然后取出压片,在拉曼红外光谱仪上进行扫描分析,波长范围:400~4000cm-1,保存图谱进行结构分析[10-14]。
2 结果与分析
2.1 纯化后酵母细胞壁多糖紫外全波长扫描结果
细胞壁多糖经过Sevage法脱除蛋白,透析除去小分子量杂质后紫外分光光度计全波长扫描结果见图1。
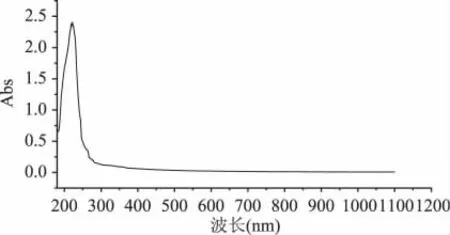
图1 Sevage法脱蛋白多糖的紫外特征吸收曲线Fig.1 UV absorption curve for Sevage method on deproteinization polysaccharide
细胞壁多糖经过TCA法脱除蛋白,透析除去小分子量杂质后紫外分光光度计全波长扫描结果见图2。

图2 TCA法脱蛋白多糖的紫外特征吸收曲线Fig.2 UV absorption curve for TCA method on deproteinization polysaccharide
由图1和图2可以看出酵母细胞壁多糖在紫外210~220nm处有强的特征吸收,所以我们可以通过检测在该波长范围有无特征吸收、吸收强弱来判定样品有无酵母细胞壁多糖以及多糖含量。由图1可以看出,利用Sevage法脱除蛋白后的细胞壁多糖样品在260nm和280nm处没有明显的吸收峰,说明样品中蛋白和核酸类杂质去除干净,多糖纯度高。图2在260nm和280nm处与图1相比较有明显的吸收,说明用TCA法蛋白质的效果不如Sevage法。综上得出文献[6]多糖中蛋白质的脱除方法也适用于酵母细胞壁多糖中蛋白、核酸等杂质的脱除;此外得出,运用紫外分光光度计在210~220nm处测定吸光度来检测酵母多糖。

表2 糖类物质红外特征吸收基团[10-12]Table 2 Infrared characteristic absorption of Carbohydrate groups
2.2 GPC校正曲线
用Breeze GPC软件以标准葡聚糖相对分子质量的对数lgMw对洗脱体积Elution Volume作图,如图3所示,并进行回归处理,得到葡聚糖标准方程:lgMw=-0.0036x3+0.1483x2-2.3688x+18.911(x为洗脱体积),R2=0.9998具有良好的线性关系。
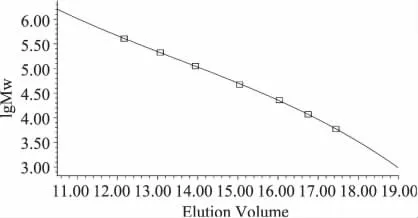
图3 葡聚糖系列标准品回归曲线Fig.3 Regression curve of a series of dextrans standard substances
2.3 酵母细胞壁多糖分子量分布趋势
由图4和表1可以看出酵母细胞壁多糖分子量分布范围较广,主要有五个分子量组分其中组分3和组分4重均分子量为分别为3.6988×104和1.8277×104,二者相对含量最多分别为 45.88%和36.143%,组分2分子量为7.0863×104相对含量为13.552%,大分子量组分1和小分子量组分5相对含量较少分别为6.0987%和7.57%。

图4 啤酒酵母细胞壁多糖GPC分布曲线Fig.4 GPC curve of yeast cell wall polysaccharides
2.4 细胞壁多糖分离纯化结果
图5为脱蛋白后的啤酒酵母细胞壁多糖经过葡聚糖凝胶G-100分离结果,上图显示通过对不同洗脱时间收集液在220nm处测定吸光度得到B、C、D、E四个不同组分的多糖。其中组分D含量最高,组分B、C、E相对含量较少,所以取组分D的洗脱液进行冷冻干燥,进行进一步的纯度鉴定。
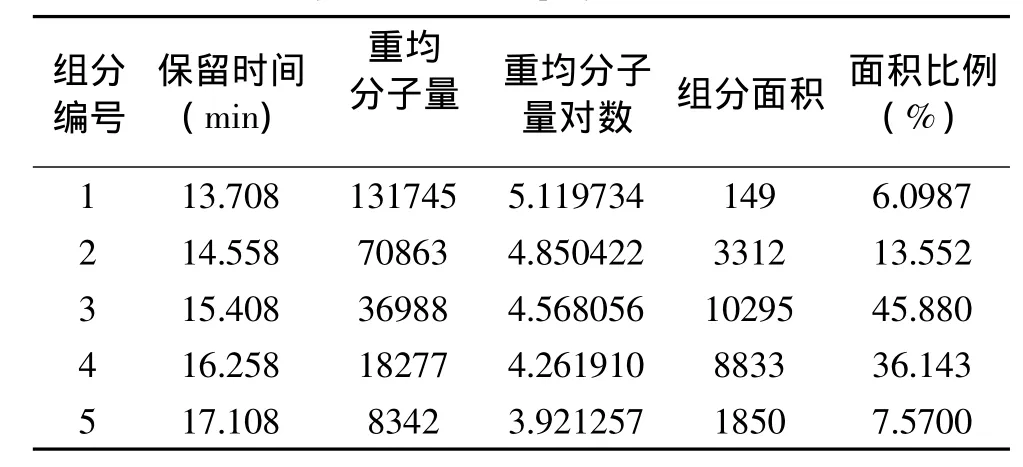
表1 啤酒酵母细胞壁多糖分子量分布分析结果Table 1 Molecular weight distribution analysis result of yeast cell wall polysaccharides
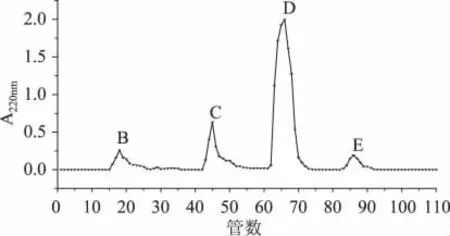
图5 酵母细胞壁多糖的葡聚糖凝胶G-100洗脱曲线Fig.5 Sephadex G-100 elution curve for yeast cell wall polysaccharides
2.5 细胞壁多糖DEAE-52洗脱结果
图6显示对细胞壁多糖组分D经过纤维素柱DEAE-52梯度洗脱经检测得到单一峰,说明多糖组分D是经过脱蛋白和葡聚糖凝胶纯化后可以得到分子量均一的纯度很高的多糖样品。
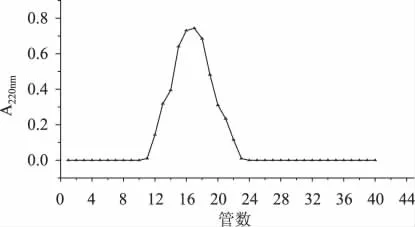
图6 DEAE-52洗脱曲线Fig.6 Elution curve of DEAE-52
2.6 啤酒酵母细胞壁多糖组分D红外图谱
由表2和图7分析得出,啤酒酵母细胞壁多糖组分D在3367.46cm-1处有很强的特征吸收峰,为C—H分子内或分子间伸缩振动;在2931.25cm-1处有较强的吸收峰,说明多糖中有较多的甲基和亚甲基,也说明了多糖分子链较长,分子量很大;在1657.97cm-1处的吸收峰,说明多糖中还处在有大量的酰胺基,多糖组成中可能含有氨基糖;在1700~1400cm-1波段的吸收峰是糖链中 C=C、C=O键的特征吸收;在1064.47cm-1处的强吸收,说明多糖中存在吡喃环结构的糖链;在指纹区890.51cm-1和808.48cm-1处的吸收峰,进一步证明糖链是 β-D-吡喃结构;在844cm-1处没有吸收强吸收峰,说明糖链中α-型糖苷键键型很少。综上说明酵母细胞壁多糖组分D中单糖主要以β-型糖苷键相连接,可能含有氨基糖。

图7 啤酒酵母细胞壁多糖红外图谱Fig.7 IR spectrum of yeast cell wall polysaccharides
3 结论
本文对啤酒酵母细胞壁多糖脱蛋白方法进行了比较,利用紫外全波长扫描得出Sevage法脱蛋白比TCA法更彻底,蛋白脱除效果好,更有利于多糖的性质分析。GPC测定多糖分子量得出:细胞壁多糖主要有5个组分,其中组分3和组分4含量较多。利用葡聚糖凝胶G-100进行酵母细胞壁多糖的纯化得到4个组分,对含量最多的组分D进行纯化鉴定为分子量单一的纯多糖,通过拉曼红外光谱初步分析了酵母细胞壁多糖组分D的简单构型,得出多糖D是β-D-吡喃型糖,主要以β-型苷键连接,α-型糖苷键较少,含有部分氨基糖。
[1]Oci V E,Liu F.Immunomodulation and anti-cancer activity of polysaccharide-protein complexes[J].Currentmedicinal chemistry,2000(7):715-729.
[2]吴小刚.酵母多糖的研究[D].武汉:湖北工业大学,2006.
[3]王义华,徐梅珍,江萍,等.啤酒酵母多糖的提纯、化学组成及抗氧化性质鉴定[J].微生物学通报,2006,30(4):51-54.
[4]杜昱光,白雪芳,虞星炬,等.寡聚糖类物质生理活性的研究[J].中国生化药物杂质,1997,18(5):268-270.
[5]刘玉潭,梁华,蔡永萍,等.天麻多糖提取纯化方法及性质的初步研究[J].激光生物学报,2007,16(4):495-500.
[6]郑必胜,何禄英.广东虫草多糖脱蛋白及凝胶渗透色谱法表征其分子量分布的研究[J].现代食品科技,2009,25(6):707-710.
[7]金鑫,赖凤英.仙人掌多糖的提取、分离纯化及GPC法测定其分子量[J].现代食品科技,2006,22(2):138-140,149.
[8]耿安静,陈健,徐晓飞.GPC法测定香菇多糖的含量及相对分子质量 [J].现代食品科技,2009,25(4):458-460.
[9]赵峡,苗辉,范惠红,等.用GPC法测定硫酸多糖911的分子量和分子量分布[J].青岛海洋大学学报,2000,30(4):623-626.
[10]李健,张竹青,陈辉.气相色谱法和红外光谱对金针菇多糖的分析研究[J].食品工业科技,2010,31(9):147-149.
[11]张剑韵,包立军,梁进,等.桑叶多糖的分离及红外光谱和气相色谱法分析[J].蚕业科学,2007,33(4):549-552.
[12]张声俊.红外光谱法对冬虫夏草的三级鉴定和研究[J].山地农业生物学报,2011,30(3):230-234.
[13]王溪,张益波,查晓清,等.基于小波包变换的云芝蛋白和多糖的近红外光谱分析[J].时珍国医国药,2010,21(10):2549-2551.
[14]铁梅,李闯,费金岩,等.富硒金针菇子实体的硒多糖的分离纯化技术及红外光谱研究[J].分析测试学报,2008,27(2):158-161.
Analysis of molecular weight distribution and primary structural of yeast cell wall polysaccharides
CHENG Jian-guo,ZHANG Shan-fei,ZHANG Li,ZHAO Chang-xin,GUO Ji-qiang*
(Biological Engineering Institue,Dalian Polytechnic University,Dalian 116034,China)
TS201.2+3
A
1002-0306(2012)12-0143-04
2011-10-26 *通讯联系人
成建国(1985-),在读硕士研究生,研究方向:微生物代谢衰老机制。
